沪教版化学九年级上册 第3章 第1节 构成物质的基本微粒 课件(共25张PPT)
文档属性
| 名称 | 沪教版化学九年级上册 第3章 第1节 构成物质的基本微粒 课件(共25张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-03 11:32:21 | ||
图片预览








文档简介
(共25张PPT)
化学九年级上册 H
第 3章 物质构成的奥秘
第1节 构成物质的基本微粒
常温下水是液体、二氧化碳是气体、食盐是晶体,这些物质里面究竟是什么东西?这些物质里面的东西是不是一样的?铜是什么构成的?
构成水的最小的微粒是什么?构成金刚石的最小微粒是什么?二氧化碳、食盐是由什么构成的?
水通电后会生成氢气和氧气。氢气、氧气和水各有自己独特的性质。为什么水不具有氢气、氧气的性质?
因为它们是由不同的微粒构成的。
构成物质的基本粒子有分子、原子和离子。
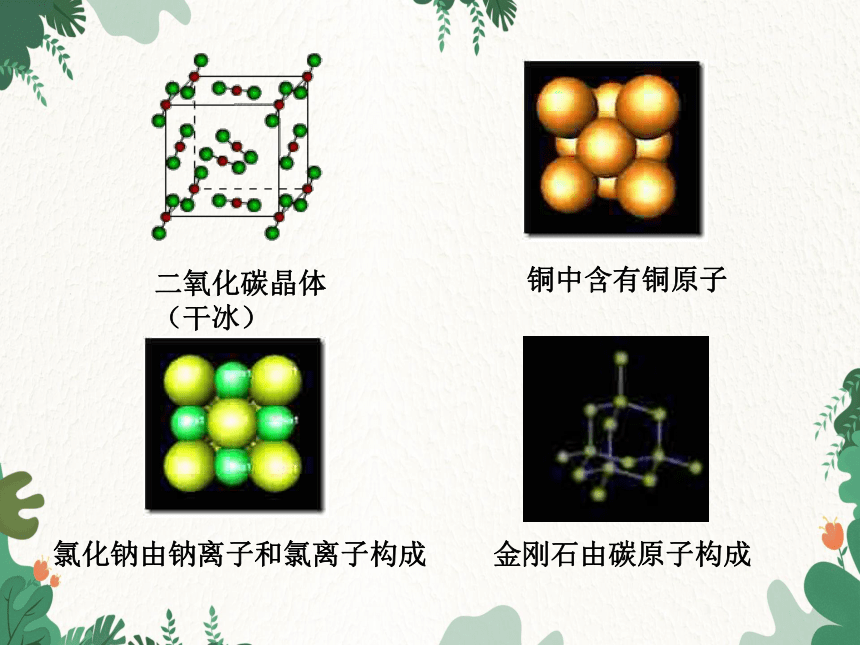
二氧化碳晶体(干冰)
铜中含有铜原子
氯化钠由钠离子和氯离子构成
金刚石由碳原子构成
一、分子
意大利化学家、物理学 家阿佛加德罗(Amedeo Avogadro,1776~1856) 提出了分子学说。
分子是构成物质的一种微粒。
氧气、水、二氧化碳等大多数物质是由分子构成,而且它们的分子不同,导致性质不同。这些物质是许多分子聚集而成。
分子的特征:
每个水分子约为3×10-26kg,计算一下一滴水(1/20g)中含有水分子的个数为 多少?
分子有一定的质量和体积,但分子很小,肉眼看不见,不能用天平来称量。
分子总在不断运动,分子间有一定间隔。同种分子性质相同,不同种分子性质不同。
1.7×1021 个
氧气分子
水分子
二氧化碳分子
结论:
分子不同,化学性质不同。分子变了,化学性质一定变。
分子是保持物质化学性质的一种微粒。
所以,保持CO2化学性质的最小微粒是CO2
分子。保持水的化学性质的最小微粒是__.
同样的几种原子,如果形成了不同的分子,其不同分子的化学性质也不相同。如CO与CO2、O2与O3、SO2与SO3等。
放大了几百万倍的分子才这么大
分子可以再分吗?
1、水变成水蒸气
水分子运动到空气中去了,分子本身没有发生改变,水分子间的距离增大了。
问题:电解水时,水分子又发生了怎样的变化呢?
(物理变化)
分子在化学反应中可以再分
2、在水分解的过程中,发生变化的是什么?不变的又是什么?
水分子分解为氢原子和氧原子,可以认为分子在化学变化中可分;
化学变化中原子可以重新组合成新的分子;两个氢原子结合成一个氢分子,两个氧原子结合成一个氧气分子,看到在化学变化中原子没有再被分割。
电解水的微观示意图
二、原子
原子是构成物质的又一种基本粒子。
原子可以构成分子,也能直接构成物质。
直接由原子构成的物质:常见的金属(铁、铜、汞等)、稀有气体(如氦、氖等)、碳、硅等。
化学变化中,分子可以分成原子,而原子不能分。
原子是化学变化中的最小微粒。
原子小但现代技术可操纵原子。
通过移动硅原子构成的文字
原子操纵术
人类对原子的认识
原子学说创始人--道尔顿
展示:1、汤姆生发现电子的阴极射线的实验过程,并介绍枣糕型原子模型
2、卢瑟福的α粒子散射实验(α粒子,即氦原子的原子核)
现象:绝大部分的α粒子沿着原来的行进方向,没有发生偏转;少部分α粒子的运动方向有所改变;甚至有极少数的α粒子有很大的偏转,甚至是180度。
原子的构成的探讨
提问:请大家来解释一下这种现象的原因
讨论:因为α粒子粒子带正电荷,原子核也带正电荷,同种电荷相互排斥,由于斥力的原因,所以有少数的α粒子会有偏转;而因为金原子中原子核存在,而且体积小,质量大,所以只有很少的机会与α粒子相碰撞,并且能反弹。
提问:原子带电吗?为什么?
回答:原子本身不带电,由于原子核与电子两者所带的电荷电量相等,电性相反,所以原子呈电中性。
设问:物质可以分为原子、分子、离子,分子能分为原子,原子又能分为原子核与电子,那么原子
核能不能再分了呢?卢瑟福同样通过α粒子散射实验,将金原子改为氮原子,发现了原子中含有质子,经过其他的科学家的不懈努力,终于发现原子核中由质子和中子构成的。一个质子带一个单位的正电荷,而中子不带电。
小结:
对于原子而言:
⑴核电荷数=核内质子数=核外电子数;⑵原子的质量主要集中在原子核上(主要由质子和中子决定);⑶原子核内的质子数不一定等于中子数。
注意:并非所有的原子核内都有中子。氢原子是最小的原子。
讨论:怎样理解整个原子是不带电的?“电性相反”和“电量相等”
引入:原子核外电子是如何排布的呢?
原子核外电子离原子核越近,电子能量越小,离原子核越远电子能量越大。即原子核外的电子按照能量由低到高的顺序由里往外依次排布的。
离子
1.概念:带电的原子或原子团。
2.分类
阳离子:带正电荷的原子或原子团
阴离子:带负电荷的原子或原子团
3、离子的形成:
⑴原子失去电子,使原子核外电子所带的负电荷比原子核带的正电荷少,使原子带上正电荷,就变成了阳离子;(核电荷数=质子数>核外电子数)
⑵原子得到电子,使原子核外电子所带的负电荷比原子核带的正电荷多,使原子带上负电荷,就变成了阴离子。(核电荷数=质子数<核外电子数)
4、⑴阳离子
原子
阴离子;
原子
阴离子。
小结:分子、原子、离子之间的关系:
⑵阳离子
分子与原子的比较
分子是保持物质化学性质的一种微粒。
原子是化学变化中的最小微粒。
不断地运动;微粒间有间隙;质量和体积都很小。
在化学变化中,分子可分,原子不可分。
分子和原子都是构成物质的微粒;分子由原子构成。
用分子、原子的知识解释物质的变化
1.水变成水蒸汽
2.水电解生成氢气和氧气
化学九年级上册 H
第 3章 物质构成的奥秘
第1节 构成物质的基本微粒
常温下水是液体、二氧化碳是气体、食盐是晶体,这些物质里面究竟是什么东西?这些物质里面的东西是不是一样的?铜是什么构成的?
构成水的最小的微粒是什么?构成金刚石的最小微粒是什么?二氧化碳、食盐是由什么构成的?
水通电后会生成氢气和氧气。氢气、氧气和水各有自己独特的性质。为什么水不具有氢气、氧气的性质?
因为它们是由不同的微粒构成的。
构成物质的基本粒子有分子、原子和离子。
二氧化碳晶体(干冰)
铜中含有铜原子
氯化钠由钠离子和氯离子构成
金刚石由碳原子构成
一、分子
意大利化学家、物理学 家阿佛加德罗(Amedeo Avogadro,1776~1856) 提出了分子学说。
分子是构成物质的一种微粒。
氧气、水、二氧化碳等大多数物质是由分子构成,而且它们的分子不同,导致性质不同。这些物质是许多分子聚集而成。
分子的特征:
每个水分子约为3×10-26kg,计算一下一滴水(1/20g)中含有水分子的个数为 多少?
分子有一定的质量和体积,但分子很小,肉眼看不见,不能用天平来称量。
分子总在不断运动,分子间有一定间隔。同种分子性质相同,不同种分子性质不同。
1.7×1021 个
氧气分子
水分子
二氧化碳分子
结论:
分子不同,化学性质不同。分子变了,化学性质一定变。
分子是保持物质化学性质的一种微粒。
所以,保持CO2化学性质的最小微粒是CO2
分子。保持水的化学性质的最小微粒是__.
同样的几种原子,如果形成了不同的分子,其不同分子的化学性质也不相同。如CO与CO2、O2与O3、SO2与SO3等。
放大了几百万倍的分子才这么大
分子可以再分吗?
1、水变成水蒸气
水分子运动到空气中去了,分子本身没有发生改变,水分子间的距离增大了。
问题:电解水时,水分子又发生了怎样的变化呢?
(物理变化)
分子在化学反应中可以再分
2、在水分解的过程中,发生变化的是什么?不变的又是什么?
水分子分解为氢原子和氧原子,可以认为分子在化学变化中可分;
化学变化中原子可以重新组合成新的分子;两个氢原子结合成一个氢分子,两个氧原子结合成一个氧气分子,看到在化学变化中原子没有再被分割。
电解水的微观示意图
二、原子
原子是构成物质的又一种基本粒子。
原子可以构成分子,也能直接构成物质。
直接由原子构成的物质:常见的金属(铁、铜、汞等)、稀有气体(如氦、氖等)、碳、硅等。
化学变化中,分子可以分成原子,而原子不能分。
原子是化学变化中的最小微粒。
原子小但现代技术可操纵原子。
通过移动硅原子构成的文字
原子操纵术
人类对原子的认识
原子学说创始人--道尔顿
展示:1、汤姆生发现电子的阴极射线的实验过程,并介绍枣糕型原子模型
2、卢瑟福的α粒子散射实验(α粒子,即氦原子的原子核)
现象:绝大部分的α粒子沿着原来的行进方向,没有发生偏转;少部分α粒子的运动方向有所改变;甚至有极少数的α粒子有很大的偏转,甚至是180度。
原子的构成的探讨
提问:请大家来解释一下这种现象的原因
讨论:因为α粒子粒子带正电荷,原子核也带正电荷,同种电荷相互排斥,由于斥力的原因,所以有少数的α粒子会有偏转;而因为金原子中原子核存在,而且体积小,质量大,所以只有很少的机会与α粒子相碰撞,并且能反弹。
提问:原子带电吗?为什么?
回答:原子本身不带电,由于原子核与电子两者所带的电荷电量相等,电性相反,所以原子呈电中性。
设问:物质可以分为原子、分子、离子,分子能分为原子,原子又能分为原子核与电子,那么原子
核能不能再分了呢?卢瑟福同样通过α粒子散射实验,将金原子改为氮原子,发现了原子中含有质子,经过其他的科学家的不懈努力,终于发现原子核中由质子和中子构成的。一个质子带一个单位的正电荷,而中子不带电。
小结:
对于原子而言:
⑴核电荷数=核内质子数=核外电子数;⑵原子的质量主要集中在原子核上(主要由质子和中子决定);⑶原子核内的质子数不一定等于中子数。
注意:并非所有的原子核内都有中子。氢原子是最小的原子。
讨论:怎样理解整个原子是不带电的?“电性相反”和“电量相等”
引入:原子核外电子是如何排布的呢?
原子核外电子离原子核越近,电子能量越小,离原子核越远电子能量越大。即原子核外的电子按照能量由低到高的顺序由里往外依次排布的。
离子
1.概念:带电的原子或原子团。
2.分类
阳离子:带正电荷的原子或原子团
阴离子:带负电荷的原子或原子团
3、离子的形成:
⑴原子失去电子,使原子核外电子所带的负电荷比原子核带的正电荷少,使原子带上正电荷,就变成了阳离子;(核电荷数=质子数>核外电子数)
⑵原子得到电子,使原子核外电子所带的负电荷比原子核带的正电荷多,使原子带上负电荷,就变成了阴离子。(核电荷数=质子数<核外电子数)
4、⑴阳离子
原子
阴离子;
原子
阴离子。
小结:分子、原子、离子之间的关系:
⑵阳离子
分子与原子的比较
分子是保持物质化学性质的一种微粒。
原子是化学变化中的最小微粒。
不断地运动;微粒间有间隙;质量和体积都很小。
在化学变化中,分子可分,原子不可分。
分子和原子都是构成物质的微粒;分子由原子构成。
用分子、原子的知识解释物质的变化
1.水变成水蒸汽
2.水电解生成氢气和氧气
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
