化学人教版2019选择性必修1 3.2.3 酸碱中和滴定(共25张ppt)
文档属性
| 名称 | 化学人教版2019选择性必修1 3.2.3 酸碱中和滴定(共25张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-03 17:37:23 | ||
图片预览







文档简介
(共25张PPT)
第二节 水的电离和溶液的pH
第三课时 酸碱中和滴定
第三章 水溶液中的离子反应与平衡
本课件内嵌有高清视频供老师参考使用
视频:酸碱中和滴定实验
本页可自行删除
【考纲要求】
通过实验探究,掌握酸碱中和滴定的原理。
结合真实情境中的应用实例,掌握酸碱中和滴定的操作方法和误差分析。
结合真实情境中的应用实例,了解酸碱中和滴定在生产、生活中的应用。
知识导航
一.酸碱中和滴定的原理
1.含义:
酸碱中和滴定是依据中和反应,用已知浓度的酸(或碱)来测定
未知浓度的碱(或酸)的方法。
2.原理:
中和反应中酸提供的H+与碱提供的OH-的物质的量相等。
即 c(H+)·V酸=c(OH-)·V碱
3.待测液的浓度计算:c待测=
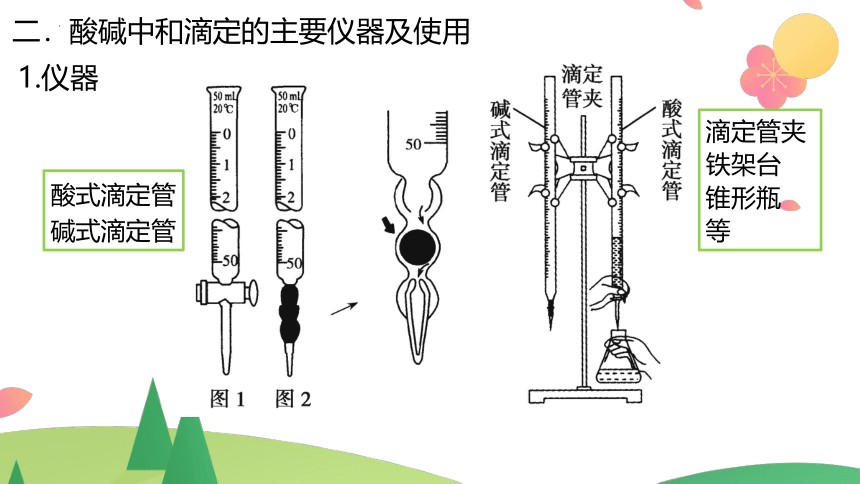
二.酸碱中和滴定的主要仪器及使用
滴定管夹
铁架台
锥形瓶
等
酸式滴定管
碱式滴定管
1.仪器
酸式滴定管(A) 碱式滴定管(B)
相同点
不同点
①标有规格、温度、“0”刻度线在上方,尖嘴部分无刻度
②最小刻度为0.1 mL,可估读到0.01 mL
①带有玻璃活塞
②可装酸性、
强氧化性溶液
①带有玻璃球的乳胶管
②只能装碱性溶液
2.酸式滴定管与碱式滴定管构造
3.使用方法
项目 具体结构或操作
检漏 检查滴定管活塞是否漏水
润洗 加入反应液之前,滴定管要用所要盛装的溶液润洗2~3次
装液 将反应液加入相应的滴定管中,使液面位于“0”刻度线以上2~3 mL
排气泡 滴定前排出尖嘴处的气泡
调液面 调节活塞,使液面处于“0”刻度或“0”刻度以下的某刻度,并记录读取数值
【注意】
滴定管的“0”刻度在最上面,越往下数值越大,因为下端有一部分没有刻度,所以滴定管的实际容积大于它的标定容积。滴定管读数时要精确到0.01mL。注意量筒与滴定管的区别
4.酸碱指示剂及其变色范围
指示剂 甲基橙 石蕊 酚酞
变色范围pH 3.1-4.4 5.0-8.0 8.2-10.0
溶液颜色 红、橙、黄 红、紫、蓝 无色、浅红、红
三.酸碱中和滴定操作
以标准盐酸滴定待测NaOH溶液为例:
排气泡
酸式滴定管:
控制活塞,使液体快速流下
碱式滴定管:
尖嘴朝上,轻轻挤压乳胶管中的玻璃球
控制活塞
锥形瓶
内溶液颜色变化
摇动锥形瓶
边滴边振荡→滴速先快后慢→左手控制滴定管活塞,且结束前不能离开,右手摇动锥形瓶,眼睛注视锥形瓶内溶液变化→判定终点→读数
数据处理:
为减小误差,滴定时,要求重复实验2~3次,求平均值。将测得的实验数据代入中和滴定计算公式计算。
滴定终点判断答题模板:
半
滴定种类 选用的指示剂 滴定终点颜色变化 指示剂用量 滴定终点判断标准
强酸滴定强碱 甲基橙 黄色→橙色 2~3滴 当指示剂刚好变色并在半分钟内不恢复原色,即认为达到滴定终点
强碱滴定强酸 酚酞 无色→浅红色
强碱滴定弱酸 酚酞 无色→粉红色
强酸滴定弱碱 甲基橙 黄色→橙色
弱碱滴定强酸 红色→橙色
指示剂的选择与颜色变化
酸碱中和滴定曲线
滴定终点不一定呈中性
四.酸碱中和滴定误差分析
由c待测= 可知,c标准和V待测均为定值,
所以c待测的误差主要来自V标准
V标准偏大则c待测偏高,V标准偏小则c待测偏低
【典例】若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
步骤 操作 V标准 c待测
滴定 酸式滴定管滴定前有气泡,滴定终点时气泡消失
振荡锥形瓶时部分液体溅出
部分酸液滴出锥形瓶外
溶液颜色较浅时滴入酸液过快,停止滴定后再加一滴NaOH溶液无变化
读数 滴定前读数正确,滴定后俯视读数(或前仰后俯)
滴定前读数正确,滴定后仰视读数(或前俯后仰)
变大
偏高
变小
偏低
变大
偏高
变大
偏高
变小
偏低
变大
偏高
效果检测
1.(2021·北京市第十二中学高二期末)下列操作或仪器名称不正确的是
A.排出滴定管内气泡 B.读取滴定管读数
C.锥形瓶无需用待测液润洗 D.酸式滴定管
【答案】D
2.(2021·海原县第一中学高二期中)下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;
③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液。
正确的操作顺序是
A.③①②⑤④ B.①②④③⑤ C.⑤④③②① D.③①②④⑤
【答案】A
3.(2021·浙江省诸暨市第二高级中学高二期中)下列实验中,由于错误操作导致所测出的数据一定偏低的是
A.用量筒量取一定体积液体时,俯视读出的读数
B.用标准盐酸滴定未知浓度的NaOH溶液,酸式滴定管未用标准盐酸润洗,所测出的碱液的浓度值
C.同一滴定实验,一般做三次,取三次实验的平均值进行计算,但某同学只做了一次
D.达到滴定终点时,俯视读数标准液滴定未知物质的量浓度的HCl溶液
【答案】D
4.(2021·宁夏银川一中高二期中)下列有关实验操作的说法错误的是
A.中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响
B.在酸碱中和滴定实验中,滴定管使用前应润洗
C.滴定时,左手控制滴定管活塞,右手握持锥形瓶边滴边振荡,眼睛注视滴定管中的液面
D.称量时,称量物放在称量纸上或烧杯内,置于托盘天平的左盘,砝码放在托盘天平的右盘
【答案】C
5.(2021·浙江)下列说法不正确的是
A.容量瓶、分液漏斗、滴定管使用前均要检漏
B.pH计可用于酸碱中和滴定终点的判断
C.用酸式滴定管量取18.20 mL Na2SiO3溶液
D.用简易量热计测反应热时需要用到环形玻璃搅拌棒
【答案】C
6.(2021·河南高二月考)用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作或说法错误的是
A.酸式滴定管未润洗就装标准溶液滴定会使测定结果偏高
B.锥形瓶用蒸馏水洗净后未干燥直接加入待测的NaOH溶液
C.若用甲基橙作指示剂则滴定终点颜色由黄色变为橙色
D.滴定管润洗后应将润洗液从上口倒出
【答案】D
本课结束
第二节 水的电离和溶液的pH
第三课时 酸碱中和滴定
第三章 水溶液中的离子反应与平衡
本课件内嵌有高清视频供老师参考使用
视频:酸碱中和滴定实验
本页可自行删除
【考纲要求】
通过实验探究,掌握酸碱中和滴定的原理。
结合真实情境中的应用实例,掌握酸碱中和滴定的操作方法和误差分析。
结合真实情境中的应用实例,了解酸碱中和滴定在生产、生活中的应用。
知识导航
一.酸碱中和滴定的原理
1.含义:
酸碱中和滴定是依据中和反应,用已知浓度的酸(或碱)来测定
未知浓度的碱(或酸)的方法。
2.原理:
中和反应中酸提供的H+与碱提供的OH-的物质的量相等。
即 c(H+)·V酸=c(OH-)·V碱
3.待测液的浓度计算:c待测=
二.酸碱中和滴定的主要仪器及使用
滴定管夹
铁架台
锥形瓶
等
酸式滴定管
碱式滴定管
1.仪器
酸式滴定管(A) 碱式滴定管(B)
相同点
不同点
①标有规格、温度、“0”刻度线在上方,尖嘴部分无刻度
②最小刻度为0.1 mL,可估读到0.01 mL
①带有玻璃活塞
②可装酸性、
强氧化性溶液
①带有玻璃球的乳胶管
②只能装碱性溶液
2.酸式滴定管与碱式滴定管构造
3.使用方法
项目 具体结构或操作
检漏 检查滴定管活塞是否漏水
润洗 加入反应液之前,滴定管要用所要盛装的溶液润洗2~3次
装液 将反应液加入相应的滴定管中,使液面位于“0”刻度线以上2~3 mL
排气泡 滴定前排出尖嘴处的气泡
调液面 调节活塞,使液面处于“0”刻度或“0”刻度以下的某刻度,并记录读取数值
【注意】
滴定管的“0”刻度在最上面,越往下数值越大,因为下端有一部分没有刻度,所以滴定管的实际容积大于它的标定容积。滴定管读数时要精确到0.01mL。注意量筒与滴定管的区别
4.酸碱指示剂及其变色范围
指示剂 甲基橙 石蕊 酚酞
变色范围pH 3.1-4.4 5.0-8.0 8.2-10.0
溶液颜色 红、橙、黄 红、紫、蓝 无色、浅红、红
三.酸碱中和滴定操作
以标准盐酸滴定待测NaOH溶液为例:
排气泡
酸式滴定管:
控制活塞,使液体快速流下
碱式滴定管:
尖嘴朝上,轻轻挤压乳胶管中的玻璃球
控制活塞
锥形瓶
内溶液颜色变化
摇动锥形瓶
边滴边振荡→滴速先快后慢→左手控制滴定管活塞,且结束前不能离开,右手摇动锥形瓶,眼睛注视锥形瓶内溶液变化→判定终点→读数
数据处理:
为减小误差,滴定时,要求重复实验2~3次,求平均值。将测得的实验数据代入中和滴定计算公式计算。
滴定终点判断答题模板:
半
滴定种类 选用的指示剂 滴定终点颜色变化 指示剂用量 滴定终点判断标准
强酸滴定强碱 甲基橙 黄色→橙色 2~3滴 当指示剂刚好变色并在半分钟内不恢复原色,即认为达到滴定终点
强碱滴定强酸 酚酞 无色→浅红色
强碱滴定弱酸 酚酞 无色→粉红色
强酸滴定弱碱 甲基橙 黄色→橙色
弱碱滴定强酸 红色→橙色
指示剂的选择与颜色变化
酸碱中和滴定曲线
滴定终点不一定呈中性
四.酸碱中和滴定误差分析
由c待测= 可知,c标准和V待测均为定值,
所以c待测的误差主要来自V标准
V标准偏大则c待测偏高,V标准偏小则c待测偏低
【典例】若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
步骤 操作 V标准 c待测
滴定 酸式滴定管滴定前有气泡,滴定终点时气泡消失
振荡锥形瓶时部分液体溅出
部分酸液滴出锥形瓶外
溶液颜色较浅时滴入酸液过快,停止滴定后再加一滴NaOH溶液无变化
读数 滴定前读数正确,滴定后俯视读数(或前仰后俯)
滴定前读数正确,滴定后仰视读数(或前俯后仰)
变大
偏高
变小
偏低
变大
偏高
变大
偏高
变小
偏低
变大
偏高
效果检测
1.(2021·北京市第十二中学高二期末)下列操作或仪器名称不正确的是
A.排出滴定管内气泡 B.读取滴定管读数
C.锥形瓶无需用待测液润洗 D.酸式滴定管
【答案】D
2.(2021·海原县第一中学高二期中)下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;
③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液。
正确的操作顺序是
A.③①②⑤④ B.①②④③⑤ C.⑤④③②① D.③①②④⑤
【答案】A
3.(2021·浙江省诸暨市第二高级中学高二期中)下列实验中,由于错误操作导致所测出的数据一定偏低的是
A.用量筒量取一定体积液体时,俯视读出的读数
B.用标准盐酸滴定未知浓度的NaOH溶液,酸式滴定管未用标准盐酸润洗,所测出的碱液的浓度值
C.同一滴定实验,一般做三次,取三次实验的平均值进行计算,但某同学只做了一次
D.达到滴定终点时,俯视读数标准液滴定未知物质的量浓度的HCl溶液
【答案】D
4.(2021·宁夏银川一中高二期中)下列有关实验操作的说法错误的是
A.中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响
B.在酸碱中和滴定实验中,滴定管使用前应润洗
C.滴定时,左手控制滴定管活塞,右手握持锥形瓶边滴边振荡,眼睛注视滴定管中的液面
D.称量时,称量物放在称量纸上或烧杯内,置于托盘天平的左盘,砝码放在托盘天平的右盘
【答案】C
5.(2021·浙江)下列说法不正确的是
A.容量瓶、分液漏斗、滴定管使用前均要检漏
B.pH计可用于酸碱中和滴定终点的判断
C.用酸式滴定管量取18.20 mL Na2SiO3溶液
D.用简易量热计测反应热时需要用到环形玻璃搅拌棒
【答案】C
6.(2021·河南高二月考)用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作或说法错误的是
A.酸式滴定管未润洗就装标准溶液滴定会使测定结果偏高
B.锥形瓶用蒸馏水洗净后未干燥直接加入待测的NaOH溶液
C.若用甲基橙作指示剂则滴定终点颜色由黄色变为橙色
D.滴定管润洗后应将润洗液从上口倒出
【答案】D
本课结束
