化学人教版(2019)选择性必修1 2.1.2影响化学反应速率的因素(共50张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.1.2影响化学反应速率的因素(共50张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-04 11:03:29 | ||
图片预览










文档简介
(共50张PPT)
教师教
第一节 化学反应速率
第二课时 影响化学反应速率的因素
合成氨工业是关系我国国民经济的重要行业,是我国化肥工业的基础,也是传统煤化工的重要组成部分。氨是重要的化工原料,主要用于制造氮肥、硝酸、丁腈橡胶等;氨在冶金、机械加工、电子、造纸等行业用途广泛。
氨的应用
制尿素
制纯碱
制硝酸
制冷剂
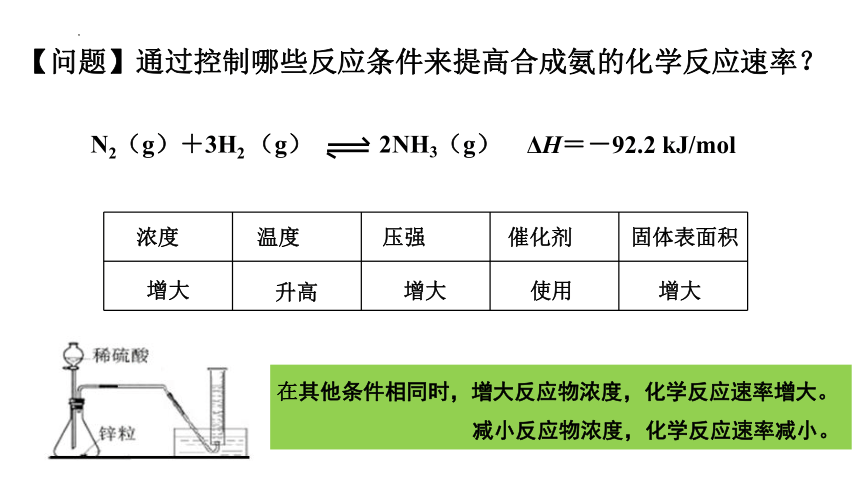
N2(g)+3H2 (g) 2NH3(g)
ΔH=-92.2 kJ/mol
【问题】通过控制哪些反应条件来提高合成氨的化学反应速率?
浓度 温度 压强 催化剂 固体表面积
增大
增大
使用
增大
升高
在其他条件相同时,增大反应物浓度,化学反应速率增大。
减小反应物浓度,化学反应速率减小。
1. 选取同一个反应,探究不同因素产生的影响。
实验原理
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
2H2O2 2H2O + O2
设计思路
现象明显
操作简单
浑浊
气泡
试管
秒表
温度计
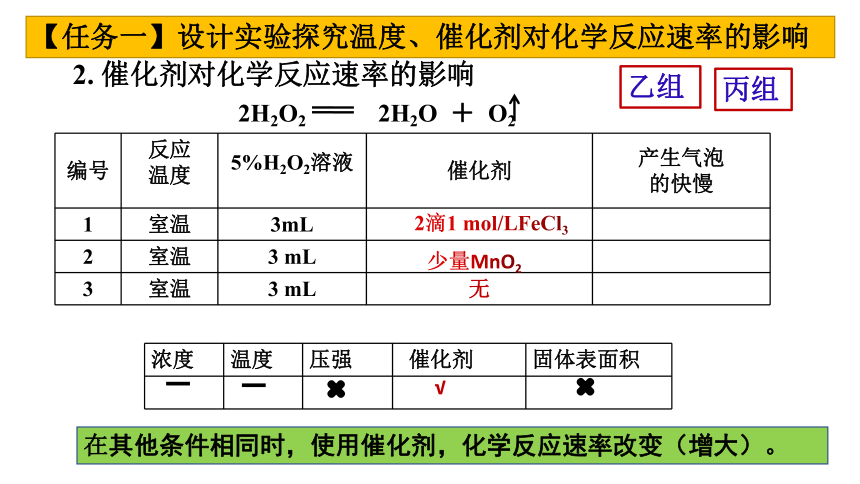
【任务一】设计实验探究温度、催化剂对化学反应速率的影响
2.选取不同的反应,探究同一因素产生的影响。
实验用品:试管、烧杯、量筒、试管架、胶头滴管、温度计、秒表。
实验药品:0.1 mol/L Na2S2O3溶液、 0.1mol/L H2SO4溶液、5% H2O2溶液、
1 mol/L FeCl3溶液、MnO2,蒸馏水、热水。
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
2H2O2 2H2O + O2
分工合作
分享交流
小组 甲组 乙组 丙 组
任务 温度 催化剂 温度、催化剂
【任务一】设计实验探究温度、催化剂对化学反应速率的影响
浓度 温度 压强 催化剂 固体表面积
编号 水浴 温度/℃ 0.1 mol/L Na2S2O3 溶液的体积/mL 0.5 mol/L H2SO4 溶液的体积/mL 出现浑浊
的时间/s
1
2
5
20
5
5
5
1. 温度对化学反应速率的影响
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
60
甲组
×
×
×
√
【任务一】设计实验探究温度、催化剂对化学反应速率的影响
1. 温度对化学反应速率的影响
甲组
2H2O2 2H2O + O2
编号 水浴 温度/℃ 5%H2O2 溶液/mL 1 mol/L FeCl3溶液 产生气
泡的快慢
1
2
20
60
3
3
2滴
2滴
浓度 温度 压强 催化剂 固体表面积
×
×
√
相同时间产生气体的体积
【任务一】设计实验探究温度、催化剂对化学反应速率的影响
在其他条件相同时,升高温度,化学反应速率增大。
降低温度,化学反应速率减小。
丙组
2. 催化剂对化学反应速率的影响
编号 反应 温度 5%H2O2溶液 催化剂 产生气泡
的快慢
1 室温 3mL
2 室温 3 mL
3 室温 3 mL 无
2H2O2 2H2O + O2
2滴1 mol/LFeCl3
少量MnO2
乙组
浓度 温度 压强 催化剂 固体表面积
×
×
√
在其他条件相同时,使用催化剂,化学反应速率改变(增大)。
丙组
【任务一】设计实验探究温度、催化剂对化学反应速率的影响
1、认识化学反应的历程
【阅读并思考】造成化学反应速率千差万别的原因是什么?
教材25页
研究表明,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。例如,2HI=H2+I2实际上是经过下列两步反应完成的:
2HI H2+2I·
2I· I2
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI=H2+I2的反应历程。反应历程又称反应机理。
微粒I·存在未成对电子,它称为自由基,自由基的反应活性很强,寿命极短。
资料卡片
【任务二】解释改变浓度、温度、催化剂影响化学反应速率的原因
化学反应是有历程的,化学反应速率与反应历程密切相关。
.
.
.
.
.
.
.
.
.
.
.
【任务二】解释改变浓度、温度、催化剂影响化学反应速率的原因
合成氨的反应历程
N2 +3H2 2NH3
2、碰撞理论模型和活化能
【阅读并思考】:教材25-26页
1. 有效碰撞的前提条件;
2. 活化分子、活化能及活化分子百分数的关系。
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
(1)
(2)
碰撞时取向不合适
(3)
有效碰撞
碰撞时能量不够
HI分解反应中分子碰撞示意图
有效碰撞:
能发生化学反应的碰撞。
发生有效碰撞的条件
足够能量
合理取向
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
活化分子:具有足够的能量、能够发生有效碰撞的分子。
活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差。
活化能
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
请尝试用碰撞理论和活化能解释
单位体积内反应物
分子总数
×
反应物中
活化分子的百分数
=
单位体积内的
活化分子数
③
反应热
微观解释
1. 浓度对化学反应速率的影响
浓度增大一倍
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
单位体积内反应物
分子总数
×
反应物中
活化分子的百分数
=
单位体积内的
活化分子数
有效碰撞
几率
化学反应速率
有效碰撞
几率
2. 温度对化学反应速率的影响
升高温度
微观解释
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
单位体积内反应物
分子总数
×
反应物中
活化分子的百分数
=
单位体积内的
活化分子数
化学反应速率
催化剂改变反应历程,
催化剂改变反应历程、降低反应活化能示意图
3. 催化剂对化学反应速率的影响
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
单位体积内反应物
分子总数
×
反应物中
活化分子的百分数
=
单位体积内的
活化分子数
催化剂不会改变总反应的焓变。
降低反应的活化能
合成氨催化剂的选择
德国化学家博施
据统计,约90%以上的化学工业过程中都使用催化剂。合成氨需要用到催化剂铁触媒,为了寻找合适的催化剂,博施及其研究组进行了大量的试验,一直到1922年,共进行了超过2500 种配方的20000 多次试验,终于筛选出了合成氨工业用催化剂。尽管后来不断地改进,但这种类型的催化剂一直沿用至今。
2016 年,中国科学院大连化学物理研究所的研究团队研制了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa,这是近年来合成氨反应研究中的重要突破,为发展更加节能的催化剂提供了新的思路。
可见,催化剂在工业生产及能源问题中发挥着巨大作用。
如何选择工业合成氨的反应条件
N2 +3H2 2NH3
高温
高压
使用催化剂
700K左右,
20~50 MPa
铁触媒
反馈应用
单位体积内分子总数 活化分子百分数 单位体积内活化分子数 有效碰撞几率 化学反应速率
温度
浓度
气体压强
催化剂
影响化学反应速率的因素
整理与小结
有机碳
+
+
H2O2
CO2
2.工业上制备磷酸时,可用 H2O2 将粗磷酸中的有机碳氧化为
CO2 脱除。
H2O
如何提高单位时间内的脱除率?
增大c(H2O2)
(80 ℃ 后,H2O2分解速率大,
浓度显著降低)
升高温度
适当
反馈应用
工业制备硫酸生产过程中哪些措施可以加快反应速率?
请你用碰撞理论来解释。
反馈应用
课后作业
完成教材:选择性必修一33页第7题
上述实验探究中,你对探究影响化学反应速率的因素有哪些新的认识?你用到了哪些科学方法?你能解释压强改变对反应速率影响的微观本质么?
可以用一个反应研究不同因素对反应速率的影响,也可以用不同反应研究同一个因素对反应速率的影响。
思考与讨论
控制变量法、科学归纳法、对照实验法、定性观察法、定量测定法。
增大压强,相当于缩小体积,反应物浓度增大,活化分子数增多,有效碰撞几率增大,反应速率加快。
实验设计
编号 Na2S2O3溶液 H2SO4溶液 出现浑浊 的快慢 反应温度
浓度/(mol/L) 体积/mL 浓度/(mol/L) 体积/mL
1 室温
2 室温
0.1
5
5
0.1
5
0.1
5
1. 浓度对化学反应速率的影响
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
0.5
甲组设计
实验设计
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
编号 0.1 mol/L Na2S2O3溶液 蒸馏水 0.1 mol/L H2SO4溶液 出现浑浊的快慢 反应
温度
1 室温
2 室温
5 mL
3 mL
5 mL
5 mL
0 mL
1. 浓度对化学反应速率的影响
2 mL
乙组设计
实验设计
1. 浓度对化学反应速率的影响
丙组设计
2H2O2 2H2O + O2
编号 5%H2O2溶液 1 mol/L FeCl3溶液 蒸馏水 相同时间出现 气泡的多少 反应温度
1 1 mL 室温
2 1 mL 室温
4 mL
2 mL
2 mL
0 mL
0.1 mol/L H2SO4
0.5 mol/L H2SO4
1. 浓度对化学反应速率的影响
甲组设计
实验设计
编号 Na2S2O3溶液 H2SO4溶液 出现浑浊 的快慢 反应温度
浓度/(mol/L) 体积/mL 浓度/(mol/L) 体积/mL
1 较快 室温
2 室温
0.1
5
5
0.1
5
0.1
5
实验结论
其他条件相同时,增大反应物浓度化学反应速率增大,减小反应物浓度化学反应速率减小。
较慢
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
1. 浓度对化学反应速率的影响
较快
0.5
甲组设计
编号 水浴 温度/℃ 0.1 mol/L Na2S2O3 溶液的体积/mL 0.1 mol/L H2SO4 溶液的体积/mL 出现浑浊
的时间/s
1
2
5
20
5
5
实验设计
5
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
2. 温度对化学反应速率的影响
70
87
16
实验结论
其他条件相同时,升高温度化学反应速率增大,降低温度化学反应速率减小。
乙组设计
影响化学反应速率的因素
北京市第八中学 付金鸽
人教版 高中化学选必1 第二章第一节
1
2
3
教材分析
教学方法
教学过程
4
教学反思
目录
01
教材分析
教材分析
教材地位和作用
教学目标
教学重难点
在实验、观察、思考、交流与合作中引导学生自主建构知识,提高化学学习能力。
化学反应速率属于化学动力学范畴,是物理化学的重要内容,也是《化学反应原理》模块的核心概念;“影响化学反应速率的因素”属于化学反应规律的研究范畴,实验的本质是研究变量与变量之间的关系,实验设计的核心思想是变量控制。
知道化学反应是有历程的,认识基元
反应活化能对化学反应速率的影响
通过实验探究外界条件对化学反应速率的影响
通过微观角度分析影响化学反应速率的各种因素
教材分析
教材地位和作用
教学目标
教学重难点
教材分析
教材地位和作用
教学重难点
教学目标
外界条件对化学反应速率的影响
化学反应速率的影响因素微观分析
重点
难点
02
教学方法
能力层面:
具备一定的变量控制思想和实验操作能力
知识层面:
从定性的角度对化学反应速率及影响因素有了一定认识
发展方向:
精心设计问题和活动任务激发学生探究欲望,维持学生的探究热情,学习到更高层次的知识与思维模式
学情分析
教学方法
教学方法
学情分析
教学方法
教学方法
01
02
实验探究法
自主学习与小组合作
03
教学过程
环节一
创设情境导入新课
教学过程
环节二
认识历程
构建理论
实验探究
微观分析
环节三
环节四
总结提升
目标达成
介绍工业合成氨的发展
环节二
认识历程
构建理论
环节一
创设情境
导入新课
环节三
实验探究
微观分析
环节四
总结提升
目标达成
认识合成氨工业的应用
分析工业合成氨的反应
通过合成氨反应过程的能量变化图,知道化学反应是有历程的。
环节一
创设情境
导入新课
环节二
认识历程
构建理论
环节三
实验探究
微观分析
环节四
总结提升
目标达成
通过任务一,阅读材料,交流研讨,认识化学反应的历程。
通过任务二,阅读教材,思考,构建简单碰撞理论模型和活化分子、活化能及活化分子百分数概念。
环节一
创设情境
导入新课
环节二
认识历程
构建理论
环节三
实验探究
微观分析
环节四
总结提升
目标达成
通过实验探究,培养学生主动参与意识,提高学生的创新思维能力,并获取科学方法。
知道反应历程影响反应速率,提出影响合成氨反应速率的外界条件。
通过思考与讨论,让学生尝试用碰撞理论解释微观机理。
环节一
创设情境
导入新课
环节二
认识历程
构建理论
环节三
实验探究
微观分析
环节四
总结提升
目标达成
环节一
创设情境
导入新课
环节二
认识历程
构建理论
环节三
实验探究
微观分析
环节四
总结提升
目标达成
环节一
创设情境
导入新课
环节二
认识历程
构建理论
环节三
实验探究
微观分析
环节四
总结提升
目标达成
04
教学反思
1
在核心素养的引领下设计教学,教学设计环节都尽可能指向发展学生的化学学科核心素养。
2
重视情境、问题、活动三者的融合贯穿。
3
实验探究能激发学生学习化学的兴趣、提高动手能力,培养热爱科学的态度。
教学反思
谢谢大家!
教师教
第一节 化学反应速率
第二课时 影响化学反应速率的因素
合成氨工业是关系我国国民经济的重要行业,是我国化肥工业的基础,也是传统煤化工的重要组成部分。氨是重要的化工原料,主要用于制造氮肥、硝酸、丁腈橡胶等;氨在冶金、机械加工、电子、造纸等行业用途广泛。
氨的应用
制尿素
制纯碱
制硝酸
制冷剂
N2(g)+3H2 (g) 2NH3(g)
ΔH=-92.2 kJ/mol
【问题】通过控制哪些反应条件来提高合成氨的化学反应速率?
浓度 温度 压强 催化剂 固体表面积
增大
增大
使用
增大
升高
在其他条件相同时,增大反应物浓度,化学反应速率增大。
减小反应物浓度,化学反应速率减小。
1. 选取同一个反应,探究不同因素产生的影响。
实验原理
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
2H2O2 2H2O + O2
设计思路
现象明显
操作简单
浑浊
气泡
试管
秒表
温度计
【任务一】设计实验探究温度、催化剂对化学反应速率的影响
2.选取不同的反应,探究同一因素产生的影响。
实验用品:试管、烧杯、量筒、试管架、胶头滴管、温度计、秒表。
实验药品:0.1 mol/L Na2S2O3溶液、 0.1mol/L H2SO4溶液、5% H2O2溶液、
1 mol/L FeCl3溶液、MnO2,蒸馏水、热水。
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
2H2O2 2H2O + O2
分工合作
分享交流
小组 甲组 乙组 丙 组
任务 温度 催化剂 温度、催化剂
【任务一】设计实验探究温度、催化剂对化学反应速率的影响
浓度 温度 压强 催化剂 固体表面积
编号 水浴 温度/℃ 0.1 mol/L Na2S2O3 溶液的体积/mL 0.5 mol/L H2SO4 溶液的体积/mL 出现浑浊
的时间/s
1
2
5
20
5
5
5
1. 温度对化学反应速率的影响
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
60
甲组
×
×
×
√
【任务一】设计实验探究温度、催化剂对化学反应速率的影响
1. 温度对化学反应速率的影响
甲组
2H2O2 2H2O + O2
编号 水浴 温度/℃ 5%H2O2 溶液/mL 1 mol/L FeCl3溶液 产生气
泡的快慢
1
2
20
60
3
3
2滴
2滴
浓度 温度 压强 催化剂 固体表面积
×
×
√
相同时间产生气体的体积
【任务一】设计实验探究温度、催化剂对化学反应速率的影响
在其他条件相同时,升高温度,化学反应速率增大。
降低温度,化学反应速率减小。
丙组
2. 催化剂对化学反应速率的影响
编号 反应 温度 5%H2O2溶液 催化剂 产生气泡
的快慢
1 室温 3mL
2 室温 3 mL
3 室温 3 mL 无
2H2O2 2H2O + O2
2滴1 mol/LFeCl3
少量MnO2
乙组
浓度 温度 压强 催化剂 固体表面积
×
×
√
在其他条件相同时,使用催化剂,化学反应速率改变(增大)。
丙组
【任务一】设计实验探究温度、催化剂对化学反应速率的影响
1、认识化学反应的历程
【阅读并思考】造成化学反应速率千差万别的原因是什么?
教材25页
研究表明,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。例如,2HI=H2+I2实际上是经过下列两步反应完成的:
2HI H2+2I·
2I· I2
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI=H2+I2的反应历程。反应历程又称反应机理。
微粒I·存在未成对电子,它称为自由基,自由基的反应活性很强,寿命极短。
资料卡片
【任务二】解释改变浓度、温度、催化剂影响化学反应速率的原因
化学反应是有历程的,化学反应速率与反应历程密切相关。
.
.
.
.
.
.
.
.
.
.
.
【任务二】解释改变浓度、温度、催化剂影响化学反应速率的原因
合成氨的反应历程
N2 +3H2 2NH3
2、碰撞理论模型和活化能
【阅读并思考】:教材25-26页
1. 有效碰撞的前提条件;
2. 活化分子、活化能及活化分子百分数的关系。
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
(1)
(2)
碰撞时取向不合适
(3)
有效碰撞
碰撞时能量不够
HI分解反应中分子碰撞示意图
有效碰撞:
能发生化学反应的碰撞。
发生有效碰撞的条件
足够能量
合理取向
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
活化分子:具有足够的能量、能够发生有效碰撞的分子。
活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差。
活化能
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
请尝试用碰撞理论和活化能解释
单位体积内反应物
分子总数
×
反应物中
活化分子的百分数
=
单位体积内的
活化分子数
③
反应热
微观解释
1. 浓度对化学反应速率的影响
浓度增大一倍
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
单位体积内反应物
分子总数
×
反应物中
活化分子的百分数
=
单位体积内的
活化分子数
有效碰撞
几率
化学反应速率
有效碰撞
几率
2. 温度对化学反应速率的影响
升高温度
微观解释
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
单位体积内反应物
分子总数
×
反应物中
活化分子的百分数
=
单位体积内的
活化分子数
化学反应速率
催化剂改变反应历程,
催化剂改变反应历程、降低反应活化能示意图
3. 催化剂对化学反应速率的影响
【任务】解释改变浓度、温度、催化剂影响化学反应速率的原因
单位体积内反应物
分子总数
×
反应物中
活化分子的百分数
=
单位体积内的
活化分子数
催化剂不会改变总反应的焓变。
降低反应的活化能
合成氨催化剂的选择
德国化学家博施
据统计,约90%以上的化学工业过程中都使用催化剂。合成氨需要用到催化剂铁触媒,为了寻找合适的催化剂,博施及其研究组进行了大量的试验,一直到1922年,共进行了超过2500 种配方的20000 多次试验,终于筛选出了合成氨工业用催化剂。尽管后来不断地改进,但这种类型的催化剂一直沿用至今。
2016 年,中国科学院大连化学物理研究所的研究团队研制了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa,这是近年来合成氨反应研究中的重要突破,为发展更加节能的催化剂提供了新的思路。
可见,催化剂在工业生产及能源问题中发挥着巨大作用。
如何选择工业合成氨的反应条件
N2 +3H2 2NH3
高温
高压
使用催化剂
700K左右,
20~50 MPa
铁触媒
反馈应用
单位体积内分子总数 活化分子百分数 单位体积内活化分子数 有效碰撞几率 化学反应速率
温度
浓度
气体压强
催化剂
影响化学反应速率的因素
整理与小结
有机碳
+
+
H2O2
CO2
2.工业上制备磷酸时,可用 H2O2 将粗磷酸中的有机碳氧化为
CO2 脱除。
H2O
如何提高单位时间内的脱除率?
增大c(H2O2)
(80 ℃ 后,H2O2分解速率大,
浓度显著降低)
升高温度
适当
反馈应用
工业制备硫酸生产过程中哪些措施可以加快反应速率?
请你用碰撞理论来解释。
反馈应用
课后作业
完成教材:选择性必修一33页第7题
上述实验探究中,你对探究影响化学反应速率的因素有哪些新的认识?你用到了哪些科学方法?你能解释压强改变对反应速率影响的微观本质么?
可以用一个反应研究不同因素对反应速率的影响,也可以用不同反应研究同一个因素对反应速率的影响。
思考与讨论
控制变量法、科学归纳法、对照实验法、定性观察法、定量测定法。
增大压强,相当于缩小体积,反应物浓度增大,活化分子数增多,有效碰撞几率增大,反应速率加快。
实验设计
编号 Na2S2O3溶液 H2SO4溶液 出现浑浊 的快慢 反应温度
浓度/(mol/L) 体积/mL 浓度/(mol/L) 体积/mL
1 室温
2 室温
0.1
5
5
0.1
5
0.1
5
1. 浓度对化学反应速率的影响
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
0.5
甲组设计
实验设计
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
编号 0.1 mol/L Na2S2O3溶液 蒸馏水 0.1 mol/L H2SO4溶液 出现浑浊的快慢 反应
温度
1 室温
2 室温
5 mL
3 mL
5 mL
5 mL
0 mL
1. 浓度对化学反应速率的影响
2 mL
乙组设计
实验设计
1. 浓度对化学反应速率的影响
丙组设计
2H2O2 2H2O + O2
编号 5%H2O2溶液 1 mol/L FeCl3溶液 蒸馏水 相同时间出现 气泡的多少 反应温度
1 1 mL 室温
2 1 mL 室温
4 mL
2 mL
2 mL
0 mL
0.1 mol/L H2SO4
0.5 mol/L H2SO4
1. 浓度对化学反应速率的影响
甲组设计
实验设计
编号 Na2S2O3溶液 H2SO4溶液 出现浑浊 的快慢 反应温度
浓度/(mol/L) 体积/mL 浓度/(mol/L) 体积/mL
1 较快 室温
2 室温
0.1
5
5
0.1
5
0.1
5
实验结论
其他条件相同时,增大反应物浓度化学反应速率增大,减小反应物浓度化学反应速率减小。
较慢
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
1. 浓度对化学反应速率的影响
较快
0.5
甲组设计
编号 水浴 温度/℃ 0.1 mol/L Na2S2O3 溶液的体积/mL 0.1 mol/L H2SO4 溶液的体积/mL 出现浑浊
的时间/s
1
2
5
20
5
5
实验设计
5
Na2S2O3+H2SO4 Na2SO4+SO2 +S +H2O
2. 温度对化学反应速率的影响
70
87
16
实验结论
其他条件相同时,升高温度化学反应速率增大,降低温度化学反应速率减小。
乙组设计
影响化学反应速率的因素
北京市第八中学 付金鸽
人教版 高中化学选必1 第二章第一节
1
2
3
教材分析
教学方法
教学过程
4
教学反思
目录
01
教材分析
教材分析
教材地位和作用
教学目标
教学重难点
在实验、观察、思考、交流与合作中引导学生自主建构知识,提高化学学习能力。
化学反应速率属于化学动力学范畴,是物理化学的重要内容,也是《化学反应原理》模块的核心概念;“影响化学反应速率的因素”属于化学反应规律的研究范畴,实验的本质是研究变量与变量之间的关系,实验设计的核心思想是变量控制。
知道化学反应是有历程的,认识基元
反应活化能对化学反应速率的影响
通过实验探究外界条件对化学反应速率的影响
通过微观角度分析影响化学反应速率的各种因素
教材分析
教材地位和作用
教学目标
教学重难点
教材分析
教材地位和作用
教学重难点
教学目标
外界条件对化学反应速率的影响
化学反应速率的影响因素微观分析
重点
难点
02
教学方法
能力层面:
具备一定的变量控制思想和实验操作能力
知识层面:
从定性的角度对化学反应速率及影响因素有了一定认识
发展方向:
精心设计问题和活动任务激发学生探究欲望,维持学生的探究热情,学习到更高层次的知识与思维模式
学情分析
教学方法
教学方法
学情分析
教学方法
教学方法
01
02
实验探究法
自主学习与小组合作
03
教学过程
环节一
创设情境导入新课
教学过程
环节二
认识历程
构建理论
实验探究
微观分析
环节三
环节四
总结提升
目标达成
介绍工业合成氨的发展
环节二
认识历程
构建理论
环节一
创设情境
导入新课
环节三
实验探究
微观分析
环节四
总结提升
目标达成
认识合成氨工业的应用
分析工业合成氨的反应
通过合成氨反应过程的能量变化图,知道化学反应是有历程的。
环节一
创设情境
导入新课
环节二
认识历程
构建理论
环节三
实验探究
微观分析
环节四
总结提升
目标达成
通过任务一,阅读材料,交流研讨,认识化学反应的历程。
通过任务二,阅读教材,思考,构建简单碰撞理论模型和活化分子、活化能及活化分子百分数概念。
环节一
创设情境
导入新课
环节二
认识历程
构建理论
环节三
实验探究
微观分析
环节四
总结提升
目标达成
通过实验探究,培养学生主动参与意识,提高学生的创新思维能力,并获取科学方法。
知道反应历程影响反应速率,提出影响合成氨反应速率的外界条件。
通过思考与讨论,让学生尝试用碰撞理论解释微观机理。
环节一
创设情境
导入新课
环节二
认识历程
构建理论
环节三
实验探究
微观分析
环节四
总结提升
目标达成
环节一
创设情境
导入新课
环节二
认识历程
构建理论
环节三
实验探究
微观分析
环节四
总结提升
目标达成
环节一
创设情境
导入新课
环节二
认识历程
构建理论
环节三
实验探究
微观分析
环节四
总结提升
目标达成
04
教学反思
1
在核心素养的引领下设计教学,教学设计环节都尽可能指向发展学生的化学学科核心素养。
2
重视情境、问题、活动三者的融合贯穿。
3
实验探究能激发学生学习化学的兴趣、提高动手能力,培养热爱科学的态度。
教学反思
谢谢大家!
