化学必修人教版(2019)第一册1.2.3. 离子共存(共29张ppt)
文档属性
| 名称 | 化学必修人教版(2019)第一册1.2.3. 离子共存(共29张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-04 15:04:22 | ||
图片预览







文档简介
(共29张PPT)
离子共存
学习目标
1.通过阅读课本16-18页,根据复习复分解反应发生的条件,学会判断离子是否能共存。
2.通过阅读课本16-18页,掌握离子不能共存的几种原因。
3.通过阅读课本16-18页,掌握解决离子共存类型问题的解答方法。
【重难点】 隐含条件下的离子共存判断
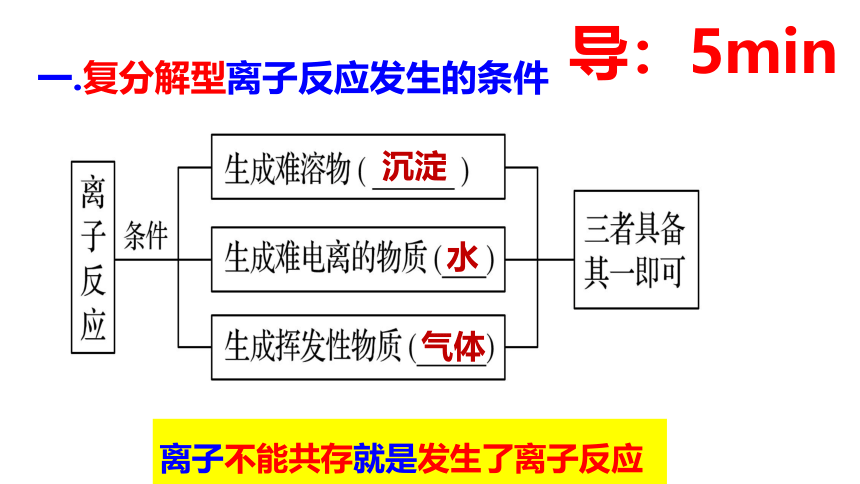
一.复分解型离子反应发生的条件
沉淀
水
气体
导:5min
离子不能共存就是发生了离子反应
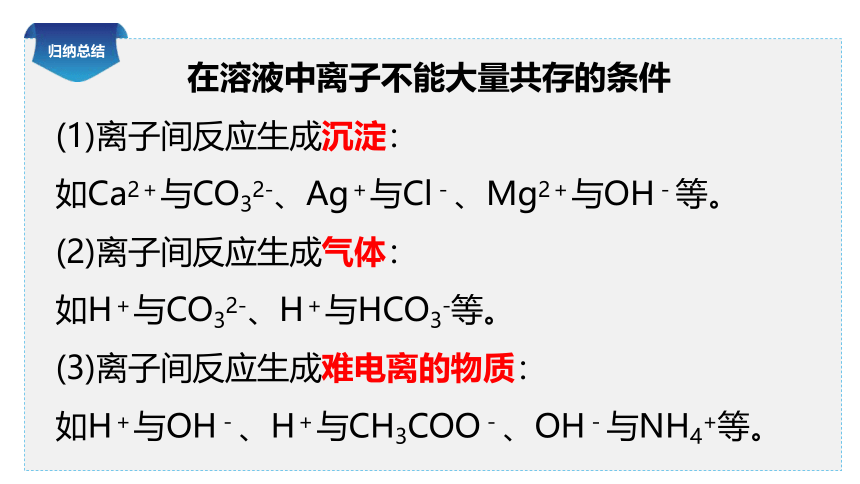
归纳总结
在溶液中离子不能大量共存的条件
(1)离子间反应生成沉淀:
如Ca2+与CO32-、Ag+与Cl-、Mg2+与OH-等。
(2)离子间反应生成气体:
如H+与CO32-、H+与HCO3-等。
(3)离子间反应生成难电离的物质:
如H+与OH-、H+与CH3COO-、OH-与NH4+等。
1.电解质在溶液中混合一定能发生反应吗?
不一定。对于复分解反应若不能形成沉淀、气体或难电离物质则不能发生反应。
2.Cl-和哪种阳离子不能在溶液中大量共存?
与Ag+不能在溶液中大量共存。
思考
3. CO32-与Ca2+、HCO3-与H+、H+和OH-
在溶液中能否大量共存?你知道其中的原因吗?
Ca2+与CO32-形成沉淀、
HCO3-与H+生成气体、
H+和OH-生成水而不能大量共存。
离子不能共存就是发生了离子反应
离子之间不共存
1.什么是离子共存?什么离子能共存?什么离子不能共存?
2.判断离子共存需要注意什么条件?
3.解答离子共存类型问题的方法是什么?
前5分钟(阅读课本16 -18页)
后8分钟完成导学提纲上的内容
思
(1)若把四种盐分别溶解于四支试管中,只有C的溶液呈蓝色。
(2)若向(1)的四支试管中分别加入盐酸,B溶液有沉淀产生,D溶液有无色无味气体逸出。
根据(1)(2)中的实验事实,可推断它们的化学式分别是A________、B________、C________、D________。
AgNO3
Na2CO3
前3min讨论题
后2min议导学提纲上的内容
BaCl2
CuSO4
C
B
D
自由展
展
8分钟
规范用语:我提问、我回答、我质
疑、我纠错、我补充、、、
A.HCO3-、K+、OH-、Na+ B. Cu2+、K+、SO42-、NO3-
C. Ba2+、Cl-、Na+、SO42- D. Fe3+、K+、Cl-、OH-
例1.下列各组离子中,能在溶液中大量共存的是
√
预设展
例2 下列各组离子能大量共存的是
√
例3 下列各组离子在溶液中可大量共存的是
√
二、离子不能大量共存的两类情况
(1)能发生复分解反应
生成难溶性或微溶性物质的离子不能大量共存;
①难溶性的盐:Ca2+与CO32-,Ba2+与CO32- 、SO42-,Ag+与Cl-等;
②难溶性的碱:OH-与Cu2+、Fe2+、Fe3+、Mg2+、Al3+等;
生成气体的离子不能大量共存:如H+与CO32-、HCO3-等;
生成水或其他难电离物质的离子不能大量共存:
H+和OH-、CH3COO-,OH-与NH4+;
评
时间:6min
(2)能发生置换反应
金属单质与金属阳离子之间的置换反应,
如Fe与CuSO4溶液的反应,
实际上是Fe与Cu2+之间的置换反应。
1.生成难溶性物质:如SO42- 、 CO32-与Ba2+、Pb2+、Ag+
2.生成难电离物质--弱酸、弱碱、少数盐、水
3.生成易挥发性物质:
CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等
易挥发的弱酸的酸根离子与H+反应不能大量共存。
OH-与NH4+反应不能大量共存。
如:CO32-、HCO3-、CH3COO-、HS-、S2-、F-、SO32-、HSO3 、PO43-、HPO42-、ClO-等都不能与H+大量共存。
离子不能大量共存的情况
4.溶解性表中不存在的物质所对应的离子不能共存。
OH-与Ag+
CO32-与Fe3+、Al3+、Cu2+(生活中最常见的金属)
附录I 部分酸、碱、盐溶解性表(室温)
阴离子 阳离子 OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 -
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 -
Cu2+ 不 溶 溶 溶 -
Ag+ - 溶 不 微 不
说明:“溶”表示那种物质溶于水。“不”表示不溶于水。“微”表示微溶于水,“挥”表示挥发性。“-”表示物质不存在或遇到水就分解。
盐的溶解性
(1)“无色透明”溶液。
①“无色”是指溶液中不含有带有颜色的离子
Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、 MnO4-(紫红色)。
②“透明溶液”意味着无难溶物和微溶物,
但并不意味着溶液无色。
2.判断离子共存的注意事项 ——“隐含条件”
(2)酸性溶液中不能大量存在与H+反应的离子。
“酸性”溶液的不同描述: ① 酸性溶液
② 常温下,pH<7的溶液
③ 使石蕊试纸变红色的溶液
(3)碱性溶液中不能大量存在与OH-反应的离子。
“碱性”溶液的不同描述: ① 碱性溶液
② 常温下,pH>7的溶液
③ 使石蕊试纸变蓝色的溶液
④ 使酚酞变红的溶液
解答离子共存问题的方法
一看是否含有隐含的限制条件,如碱性、酸性、无色等。
二看能否发生复分解反应,分三步进行:
①查H+,主要看是否有弱酸根离子和酸式酸根离子等;
②查OH-,主要看是否有NH4+、酸式酸根离子和金属离子;
③查金属离子,主要看是否与酸根离子产生难溶性或微溶性盐。
瞻前顾后
类型 举例
生成难溶性或微溶性物质 ①Ca2+与CO32-,Ba2+与(CO32- 、SO42- ),Ag+与Cl-等
②OH-与Cu2+、Fe2+、Fe3+、Mg2+、Al3+等
③(微溶)Ag+与SO4,Ca2+与(SO4、OH-),Mg2+与CO32-。
生成气体 H+与CO32-、HCO32-、SO32-、HSO32-、S2-、HS-等。
生成水或其他难电离的物质 H+与OH-、HCO3、HS-、HSO3 等,
OH-与HCO3、HS-、NH4-
发生氧化还原反应
下课预习,下节课讲
2-
2-
-
-
-
结
1.下列各组中的离子,能在溶液中大量共存的是
解析 选项A中的OH-与H+不能大量共存;
√
检
2.(2018·江苏高一检测)对四组无色透明溶液进行离子检验,四位同学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是
√
选项 B 中Mg2+与OH-不能共存;
3.下列各组离子一定能大量共存的是
√
解析 选项A中Ba2+与SO42-、CO32-不能大量共存;
选项B中H+与HCO3-不能大量共存;
选项C中OH-、CO32-与Mg2+不能大量共存。
解析 A项,MnO4-是紫红色;
B项,酸性时CO32-+2H+=CO2↑+H2O,碱性时Al3+生成沉淀;
D项,酸性时HCO3-+H+=CO2↑+H2O,
碱性时HCO3-+OH-=CO32-+H2O。
√
5. 25 ℃时,在强碱性溶液中可以大量共存的离子组是( )
√
本课结束
下节提示:氧化还原反应
离子共存
学习目标
1.通过阅读课本16-18页,根据复习复分解反应发生的条件,学会判断离子是否能共存。
2.通过阅读课本16-18页,掌握离子不能共存的几种原因。
3.通过阅读课本16-18页,掌握解决离子共存类型问题的解答方法。
【重难点】 隐含条件下的离子共存判断
一.复分解型离子反应发生的条件
沉淀
水
气体
导:5min
离子不能共存就是发生了离子反应
归纳总结
在溶液中离子不能大量共存的条件
(1)离子间反应生成沉淀:
如Ca2+与CO32-、Ag+与Cl-、Mg2+与OH-等。
(2)离子间反应生成气体:
如H+与CO32-、H+与HCO3-等。
(3)离子间反应生成难电离的物质:
如H+与OH-、H+与CH3COO-、OH-与NH4+等。
1.电解质在溶液中混合一定能发生反应吗?
不一定。对于复分解反应若不能形成沉淀、气体或难电离物质则不能发生反应。
2.Cl-和哪种阳离子不能在溶液中大量共存?
与Ag+不能在溶液中大量共存。
思考
3. CO32-与Ca2+、HCO3-与H+、H+和OH-
在溶液中能否大量共存?你知道其中的原因吗?
Ca2+与CO32-形成沉淀、
HCO3-与H+生成气体、
H+和OH-生成水而不能大量共存。
离子不能共存就是发生了离子反应
离子之间不共存
1.什么是离子共存?什么离子能共存?什么离子不能共存?
2.判断离子共存需要注意什么条件?
3.解答离子共存类型问题的方法是什么?
前5分钟(阅读课本16 -18页)
后8分钟完成导学提纲上的内容
思
(1)若把四种盐分别溶解于四支试管中,只有C的溶液呈蓝色。
(2)若向(1)的四支试管中分别加入盐酸,B溶液有沉淀产生,D溶液有无色无味气体逸出。
根据(1)(2)中的实验事实,可推断它们的化学式分别是A________、B________、C________、D________。
AgNO3
Na2CO3
前3min讨论题
后2min议导学提纲上的内容
BaCl2
CuSO4
C
B
D
自由展
展
8分钟
规范用语:我提问、我回答、我质
疑、我纠错、我补充、、、
A.HCO3-、K+、OH-、Na+ B. Cu2+、K+、SO42-、NO3-
C. Ba2+、Cl-、Na+、SO42- D. Fe3+、K+、Cl-、OH-
例1.下列各组离子中,能在溶液中大量共存的是
√
预设展
例2 下列各组离子能大量共存的是
√
例3 下列各组离子在溶液中可大量共存的是
√
二、离子不能大量共存的两类情况
(1)能发生复分解反应
生成难溶性或微溶性物质的离子不能大量共存;
①难溶性的盐:Ca2+与CO32-,Ba2+与CO32- 、SO42-,Ag+与Cl-等;
②难溶性的碱:OH-与Cu2+、Fe2+、Fe3+、Mg2+、Al3+等;
生成气体的离子不能大量共存:如H+与CO32-、HCO3-等;
生成水或其他难电离物质的离子不能大量共存:
H+和OH-、CH3COO-,OH-与NH4+;
评
时间:6min
(2)能发生置换反应
金属单质与金属阳离子之间的置换反应,
如Fe与CuSO4溶液的反应,
实际上是Fe与Cu2+之间的置换反应。
1.生成难溶性物质:如SO42- 、 CO32-与Ba2+、Pb2+、Ag+
2.生成难电离物质--弱酸、弱碱、少数盐、水
3.生成易挥发性物质:
CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等
易挥发的弱酸的酸根离子与H+反应不能大量共存。
OH-与NH4+反应不能大量共存。
如:CO32-、HCO3-、CH3COO-、HS-、S2-、F-、SO32-、HSO3 、PO43-、HPO42-、ClO-等都不能与H+大量共存。
离子不能大量共存的情况
4.溶解性表中不存在的物质所对应的离子不能共存。
OH-与Ag+
CO32-与Fe3+、Al3+、Cu2+(生活中最常见的金属)
附录I 部分酸、碱、盐溶解性表(室温)
阴离子 阳离子 OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 -
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 -
Cu2+ 不 溶 溶 溶 -
Ag+ - 溶 不 微 不
说明:“溶”表示那种物质溶于水。“不”表示不溶于水。“微”表示微溶于水,“挥”表示挥发性。“-”表示物质不存在或遇到水就分解。
盐的溶解性
(1)“无色透明”溶液。
①“无色”是指溶液中不含有带有颜色的离子
Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、 MnO4-(紫红色)。
②“透明溶液”意味着无难溶物和微溶物,
但并不意味着溶液无色。
2.判断离子共存的注意事项 ——“隐含条件”
(2)酸性溶液中不能大量存在与H+反应的离子。
“酸性”溶液的不同描述: ① 酸性溶液
② 常温下,pH<7的溶液
③ 使石蕊试纸变红色的溶液
(3)碱性溶液中不能大量存在与OH-反应的离子。
“碱性”溶液的不同描述: ① 碱性溶液
② 常温下,pH>7的溶液
③ 使石蕊试纸变蓝色的溶液
④ 使酚酞变红的溶液
解答离子共存问题的方法
一看是否含有隐含的限制条件,如碱性、酸性、无色等。
二看能否发生复分解反应,分三步进行:
①查H+,主要看是否有弱酸根离子和酸式酸根离子等;
②查OH-,主要看是否有NH4+、酸式酸根离子和金属离子;
③查金属离子,主要看是否与酸根离子产生难溶性或微溶性盐。
瞻前顾后
类型 举例
生成难溶性或微溶性物质 ①Ca2+与CO32-,Ba2+与(CO32- 、SO42- ),Ag+与Cl-等
②OH-与Cu2+、Fe2+、Fe3+、Mg2+、Al3+等
③(微溶)Ag+与SO4,Ca2+与(SO4、OH-),Mg2+与CO32-。
生成气体 H+与CO32-、HCO32-、SO32-、HSO32-、S2-、HS-等。
生成水或其他难电离的物质 H+与OH-、HCO3、HS-、HSO3 等,
OH-与HCO3、HS-、NH4-
发生氧化还原反应
下课预习,下节课讲
2-
2-
-
-
-
结
1.下列各组中的离子,能在溶液中大量共存的是
解析 选项A中的OH-与H+不能大量共存;
√
检
2.(2018·江苏高一检测)对四组无色透明溶液进行离子检验,四位同学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是
√
选项 B 中Mg2+与OH-不能共存;
3.下列各组离子一定能大量共存的是
√
解析 选项A中Ba2+与SO42-、CO32-不能大量共存;
选项B中H+与HCO3-不能大量共存;
选项C中OH-、CO32-与Mg2+不能大量共存。
解析 A项,MnO4-是紫红色;
B项,酸性时CO32-+2H+=CO2↑+H2O,碱性时Al3+生成沉淀;
D项,酸性时HCO3-+H+=CO2↑+H2O,
碱性时HCO3-+OH-=CO32-+H2O。
√
5. 25 ℃时,在强碱性溶液中可以大量共存的离子组是( )
√
本课结束
下节提示:氧化还原反应
