化学必修人教版(2019)第一册2.1.1.活泼的金属单质—钠(共33张ppt)
文档属性
| 名称 | 化学必修人教版(2019)第一册2.1.1.活泼的金属单质—钠(共33张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 20.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-04 16:13:49 | ||
图片预览









文档简介
(共33张PPT)
活泼的金属单质—钠
学习目标
通过阅读课本第32-35页、
1.掌握钠元素的物理性质与用途.
2.掌握钠元素的结构与化学性质.
【重难点】 钠的化学性质
导:5min
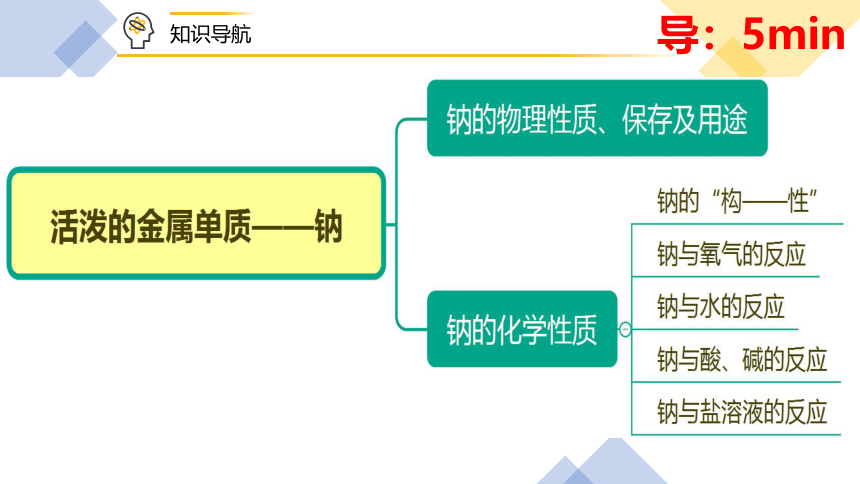
知识导航
导:5min
1.物理性质:______色固体;密度0.97g·cm-3 ,比水____,比煤油____;质软,熔点97.8℃,______。
2.保存方法:_______液封、_______固封。
银白
小
大
较低
煤油
石蜡
一、钠的物理性质与用途
3.用途
(1)作还原剂来制取活泼金属;
(2)制作高压钠灯;
(3)制钠钾合金,用于原子反应堆导热剂。
钠在高温下能将TiCl4中的Ti置换出来
TiCl4 + 4Na 4NaCl + Ti
一、钠的物理性质与用途
1. 钠的“构——性”
钠的原子结构示意图为
最外层只有1个电子,在化学反应中很容易_____1个电子,因此金属钠的化学性质非常________,表现出很强的________,在自然界中均以________态存在。
失去
活泼
还原性
化合
二、钠的化学性质
金属钠有哪些化学性质呢?
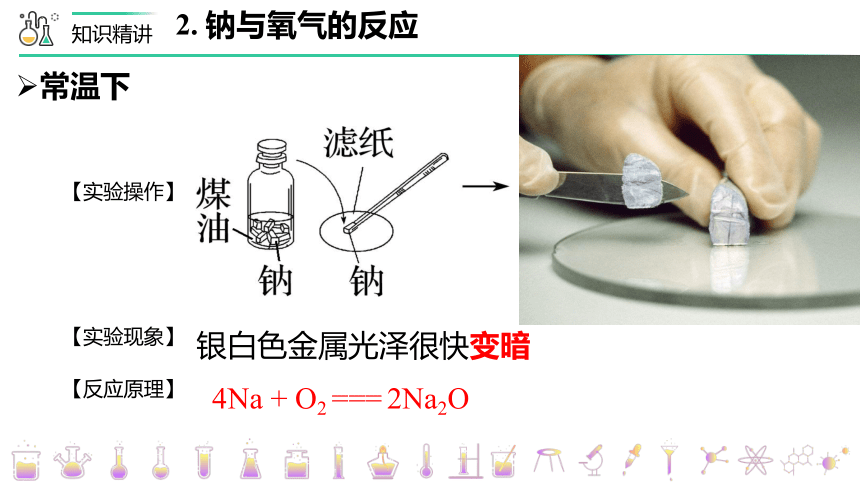
2. 钠与氧气的反应
常温下
银白色金属光泽很快变暗
【实验现象】
【实验操作】
【反应原理】
4Na + O2 === 2Na2O
2. 钠与氧气的反应
加热 / 点燃 条件下
熔成小球,剧烈燃烧,发出______火焰,生成________固体
【实验现象】
【反应原理】
黄色
淡黄色
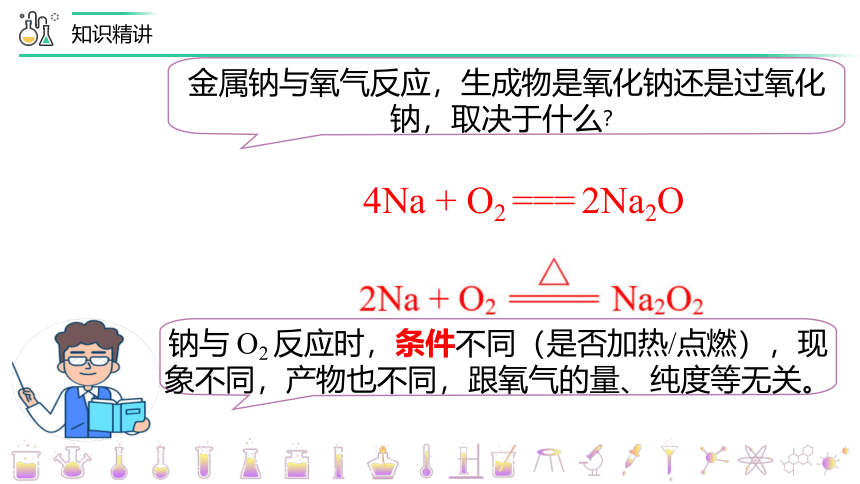
金属钠与氧气反应,生成物是氧化钠还是过氧化钠,取决于什么?
4Na + O2 === 2Na2O
钠与 O2 反应时,条件不同(是否加热/点燃),现象不同,产物也不同,跟氧气的量、纯度等无关。
根据金属活动顺序表可知,金属钠很活泼。如果把金属钠放进水里,会发生什么呢?
(1)实验操作
(2)实验现象及解释
浮
熔
游
钠的密度比水小
反应放热,钠的熔点低
生成气体,推动钠四处游动
响
反应剧烈
红
生成了碱性物质 NaOH
2Na + 2H2O === 2NaOH + H2↑
金属钠与水的反应,其实质是钠与水电离出的H+反应
(3)实验原理
3. 钠与水的反应
切割完钠块后,剩余的钠应该如何处理?
放入原来盛有煤油的试剂瓶中,取用钾时也要这样做。
因为钠、钾等金属的活泼性非常强,易与水或氧气反应造成失火或爆炸,为保证实验安全,放回原试剂瓶比较稳妥。
做实验时,金属钠不慎失火,能否用水灭火?
不能用水灭火,应该用干燥的沙土来灭火
钠与水剧烈反应且生成氢气,会放出大量的热,甚至能引起氢气燃烧爆炸
思考与交流:写出下列反应的现象,如有第②步反应的,请写出离子方程式。
(1)金属钠加入到NaHCO3溶液中
(2)金属钠加入到饱和 NaCl 溶液中
浮、熔、游、响;OH- + === H2O +
浮、熔、游、响、析出白色固体
注意“饱和”二字。金属钠消耗了水,溶液变为过饱和溶液,固有晶体析出。
思:13min
阅读课本第32-35页、回答下列问题:
1.钠是什么颜色,常温下什么状态,如何保存钠?
2.钠与氧气反应的产物有几种?
3. 钠与水反应有什么现象,反应原理是什么?
4. 钠与酸、碱、盐反应分别有什么现象,反应原理是什么?
前7分钟
后6分钟:完成相应的练习题
存在的疑问写在【我有问题要问】
议和展
在合作中解决问题
讨论重点:
1.看课本时有疑问的地方。
2.学案中存在的问题及迁移应用中
答案不一致的题目。
要求: 拿起资料,全员参与,
求同解疑,注重效率。
5min
展
自由展
规范用语:我提问、我回答、我质疑、
我纠错、我补充、
【1】下列有关钠的物理性质叙述正确的是
①银白色金属 ②质软,可以用小刀切割 ③熔点较低 ④密度比水小
⑤热和电的良导体
A.①②④ B.②③⑤ C.①③④ D.①②③④⑤
D
题型一:金属钠的物理性质
预设展
【2】取一块金属钠,放在燃烧匙里加热,下列对实验现象的描述正确的是( )
①金属先熔化 ②在空气中燃烧,产生黄色火花 ③燃烧后得白色固体
④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体
A.②⑤ B.①②③ C.①④⑤ D.④⑤
C
题型二:金属钠与氧气的反应
【3】某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实验并验证钠的物理性质。请回答下列问题:
(1)实验开始时,欲使钠与水接触发生反应,应如何操作 __________。
(2)反应开始后,试管中能观察到的实验现象是_________(填标号)。
A.钠在水层中反应,熔成小球并四处游动
B.钠在两液体界面处反应,熔成小球并上下跳动
C.钠块不断减小直至消失
D.钠停留在煤油层中不反应
E.煤油中有气泡产生
(3)通过上述现象,能够验证钠的哪些物理性质 _________。
题型三:金属钠与水的反应
【答案】拔出大头针,使大头针下端的钠落入试管内的水中 BCE 钠的熔点低,钠的密度比水小,但比煤油大
金属钠除了与氧气、水反应,还可以跟哪些物质反应?
评:8min
1.钠与酸的反应
(1)与强酸反应的离子方程式:_________________________________。
(2)钠与酸反应时,先与酸反应,如果钠过量,钠把酸反应完之后,再与水反应。
2. 钠与碱的反应
钠与碱溶液的反应,实质就是钠与水的反应。
2Na + 2H+ === 2Na+ + H2↑
3.钠与盐溶液的反应
浮、熔、游、响,产生蓝色沉淀
实验现象
实验原理
金属钠与硫酸铜溶液反应
2Na+2H2O===2NaOH+H2↑ ①
CuSO4+2NaOH===Na2SO4+Cu(OH)2↓ ②
你能写出总反应吗?
①+②,消掉 NaOH 即可
2Na+2H2O+CuSO4===Na2SO4+Cu(OH)2↓+H2↑
如果是金属钠与硫酸铁溶液反应呢?
积累本上写出你的答案
钠先与水反应: 2Na + 2H2O === 2NaOH + H2 ↑
消耗了水,若是饱和盐溶液,会有晶体析出
考虑生成的 NaOH 是否与该盐溶液反应
结
总结: 金属钠与盐溶液反应的分析思路
资料卡片——钠与其他非金属单质的反应
(1)钠与硫混合研磨生成Na2S:2Na+S===Na2S (研磨时容易爆炸)
(2)在氯气中燃烧:2Na+Cl2 2NaCl (产生黄色火焰,生成白烟)
(3)与氢气反应生成NaH:2Na+H2 NaH(金属氢化物中,氢为-1价)
(4)与氮气反应生成Na3N:6Na+N2 2Na3N
【1】将金属钠投入盛有下列溶液的小烧杯中,既有气体生成,又有白色沉淀产生的是(不考虑反应中溶液温度的变化)
①MgSO4溶液 ②NaCl溶液 ③Na2SO4溶液 ④饱和Ca(OH)2溶液 ⑤CuSO4溶液 ⑥饱和NaCl溶液 ⑦Fe2(SO4)3溶液
A.①②④ B.②③⑥ C.①④⑥ D.④⑤⑥
C
题型四:金属钠与盐溶液的反应
检
【2】下列反应的离子方程式书写正确的是
A.氧化钠与盐酸反应 O2-+2H+=H2O
B.钠与CuSO4溶液反应 2Na+Cu2+=2Na++Cu
C.钠与水反应 2Na+2H2O = 2Na++ 2OH-+H2↑
D.碳酸氢钠与稀硫酸反应:CO32- +2H+=CO2↑+H2O
C
题型五:离子反应方程式正误判断(与Na相关)
【3】2.3 g 纯净的金属钠在干燥的空气中被氧化后得到 3.9 g 固体,由此判断其产物是( )
A.只有Na2O B.只有Na2O2 C.Na2O和Na2O2 D.无法确定
B
题型六:金属钠的相关计算
【4】将 4.6 g 金属钠投入到足量水中,得 ag 溶液;将 4.8 g 金属镁投入到足量盐酸中,得 bg 溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为 ( )
A.a=b B.a>b
C.aA
题型六:金属钠的相关计算
下节提示:
钠的氧化物
活泼的金属单质—钠
学习目标
通过阅读课本第32-35页、
1.掌握钠元素的物理性质与用途.
2.掌握钠元素的结构与化学性质.
【重难点】 钠的化学性质
导:5min
知识导航
导:5min
1.物理性质:______色固体;密度0.97g·cm-3 ,比水____,比煤油____;质软,熔点97.8℃,______。
2.保存方法:_______液封、_______固封。
银白
小
大
较低
煤油
石蜡
一、钠的物理性质与用途
3.用途
(1)作还原剂来制取活泼金属;
(2)制作高压钠灯;
(3)制钠钾合金,用于原子反应堆导热剂。
钠在高温下能将TiCl4中的Ti置换出来
TiCl4 + 4Na 4NaCl + Ti
一、钠的物理性质与用途
1. 钠的“构——性”
钠的原子结构示意图为
最外层只有1个电子,在化学反应中很容易_____1个电子,因此金属钠的化学性质非常________,表现出很强的________,在自然界中均以________态存在。
失去
活泼
还原性
化合
二、钠的化学性质
金属钠有哪些化学性质呢?
2. 钠与氧气的反应
常温下
银白色金属光泽很快变暗
【实验现象】
【实验操作】
【反应原理】
4Na + O2 === 2Na2O
2. 钠与氧气的反应
加热 / 点燃 条件下
熔成小球,剧烈燃烧,发出______火焰,生成________固体
【实验现象】
【反应原理】
黄色
淡黄色
金属钠与氧气反应,生成物是氧化钠还是过氧化钠,取决于什么?
4Na + O2 === 2Na2O
钠与 O2 反应时,条件不同(是否加热/点燃),现象不同,产物也不同,跟氧气的量、纯度等无关。
根据金属活动顺序表可知,金属钠很活泼。如果把金属钠放进水里,会发生什么呢?
(1)实验操作
(2)实验现象及解释
浮
熔
游
钠的密度比水小
反应放热,钠的熔点低
生成气体,推动钠四处游动
响
反应剧烈
红
生成了碱性物质 NaOH
2Na + 2H2O === 2NaOH + H2↑
金属钠与水的反应,其实质是钠与水电离出的H+反应
(3)实验原理
3. 钠与水的反应
切割完钠块后,剩余的钠应该如何处理?
放入原来盛有煤油的试剂瓶中,取用钾时也要这样做。
因为钠、钾等金属的活泼性非常强,易与水或氧气反应造成失火或爆炸,为保证实验安全,放回原试剂瓶比较稳妥。
做实验时,金属钠不慎失火,能否用水灭火?
不能用水灭火,应该用干燥的沙土来灭火
钠与水剧烈反应且生成氢气,会放出大量的热,甚至能引起氢气燃烧爆炸
思考与交流:写出下列反应的现象,如有第②步反应的,请写出离子方程式。
(1)金属钠加入到NaHCO3溶液中
(2)金属钠加入到饱和 NaCl 溶液中
浮、熔、游、响;OH- + === H2O +
浮、熔、游、响、析出白色固体
注意“饱和”二字。金属钠消耗了水,溶液变为过饱和溶液,固有晶体析出。
思:13min
阅读课本第32-35页、回答下列问题:
1.钠是什么颜色,常温下什么状态,如何保存钠?
2.钠与氧气反应的产物有几种?
3. 钠与水反应有什么现象,反应原理是什么?
4. 钠与酸、碱、盐反应分别有什么现象,反应原理是什么?
前7分钟
后6分钟:完成相应的练习题
存在的疑问写在【我有问题要问】
议和展
在合作中解决问题
讨论重点:
1.看课本时有疑问的地方。
2.学案中存在的问题及迁移应用中
答案不一致的题目。
要求: 拿起资料,全员参与,
求同解疑,注重效率。
5min
展
自由展
规范用语:我提问、我回答、我质疑、
我纠错、我补充、
【1】下列有关钠的物理性质叙述正确的是
①银白色金属 ②质软,可以用小刀切割 ③熔点较低 ④密度比水小
⑤热和电的良导体
A.①②④ B.②③⑤ C.①③④ D.①②③④⑤
D
题型一:金属钠的物理性质
预设展
【2】取一块金属钠,放在燃烧匙里加热,下列对实验现象的描述正确的是( )
①金属先熔化 ②在空气中燃烧,产生黄色火花 ③燃烧后得白色固体
④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体
A.②⑤ B.①②③ C.①④⑤ D.④⑤
C
题型二:金属钠与氧气的反应
【3】某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实验并验证钠的物理性质。请回答下列问题:
(1)实验开始时,欲使钠与水接触发生反应,应如何操作 __________。
(2)反应开始后,试管中能观察到的实验现象是_________(填标号)。
A.钠在水层中反应,熔成小球并四处游动
B.钠在两液体界面处反应,熔成小球并上下跳动
C.钠块不断减小直至消失
D.钠停留在煤油层中不反应
E.煤油中有气泡产生
(3)通过上述现象,能够验证钠的哪些物理性质 _________。
题型三:金属钠与水的反应
【答案】拔出大头针,使大头针下端的钠落入试管内的水中 BCE 钠的熔点低,钠的密度比水小,但比煤油大
金属钠除了与氧气、水反应,还可以跟哪些物质反应?
评:8min
1.钠与酸的反应
(1)与强酸反应的离子方程式:_________________________________。
(2)钠与酸反应时,先与酸反应,如果钠过量,钠把酸反应完之后,再与水反应。
2. 钠与碱的反应
钠与碱溶液的反应,实质就是钠与水的反应。
2Na + 2H+ === 2Na+ + H2↑
3.钠与盐溶液的反应
浮、熔、游、响,产生蓝色沉淀
实验现象
实验原理
金属钠与硫酸铜溶液反应
2Na+2H2O===2NaOH+H2↑ ①
CuSO4+2NaOH===Na2SO4+Cu(OH)2↓ ②
你能写出总反应吗?
①+②,消掉 NaOH 即可
2Na+2H2O+CuSO4===Na2SO4+Cu(OH)2↓+H2↑
如果是金属钠与硫酸铁溶液反应呢?
积累本上写出你的答案
钠先与水反应: 2Na + 2H2O === 2NaOH + H2 ↑
消耗了水,若是饱和盐溶液,会有晶体析出
考虑生成的 NaOH 是否与该盐溶液反应
结
总结: 金属钠与盐溶液反应的分析思路
资料卡片——钠与其他非金属单质的反应
(1)钠与硫混合研磨生成Na2S:2Na+S===Na2S (研磨时容易爆炸)
(2)在氯气中燃烧:2Na+Cl2 2NaCl (产生黄色火焰,生成白烟)
(3)与氢气反应生成NaH:2Na+H2 NaH(金属氢化物中,氢为-1价)
(4)与氮气反应生成Na3N:6Na+N2 2Na3N
【1】将金属钠投入盛有下列溶液的小烧杯中,既有气体生成,又有白色沉淀产生的是(不考虑反应中溶液温度的变化)
①MgSO4溶液 ②NaCl溶液 ③Na2SO4溶液 ④饱和Ca(OH)2溶液 ⑤CuSO4溶液 ⑥饱和NaCl溶液 ⑦Fe2(SO4)3溶液
A.①②④ B.②③⑥ C.①④⑥ D.④⑤⑥
C
题型四:金属钠与盐溶液的反应
检
【2】下列反应的离子方程式书写正确的是
A.氧化钠与盐酸反应 O2-+2H+=H2O
B.钠与CuSO4溶液反应 2Na+Cu2+=2Na++Cu
C.钠与水反应 2Na+2H2O = 2Na++ 2OH-+H2↑
D.碳酸氢钠与稀硫酸反应:CO32- +2H+=CO2↑+H2O
C
题型五:离子反应方程式正误判断(与Na相关)
【3】2.3 g 纯净的金属钠在干燥的空气中被氧化后得到 3.9 g 固体,由此判断其产物是( )
A.只有Na2O B.只有Na2O2 C.Na2O和Na2O2 D.无法确定
B
题型六:金属钠的相关计算
【4】将 4.6 g 金属钠投入到足量水中,得 ag 溶液;将 4.8 g 金属镁投入到足量盐酸中,得 bg 溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为 ( )
A.a=b B.a>b
C.aA
题型六:金属钠的相关计算
下节提示:
钠的氧化物
