化学人教版(2019)必修第一册1.3.4.氧化性和还原性(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.4.氧化性和还原性(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 675.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-04 16:51:19 | ||
图片预览







文档简介
(共24张PPT)
第4课时 氧化性和还原性
第二章 第三节 氧化还原反应
学习目标
1.通过阅读课本20-24页,复习氧化还原反应的实质是什么。
2.通过阅读课本20-24页,学习氧化还原反应的基本规律。
3.通过阅读课本20-24页,学习歧化反应和归中反应。
【重难点】 氧化还原反应的基本规律
导
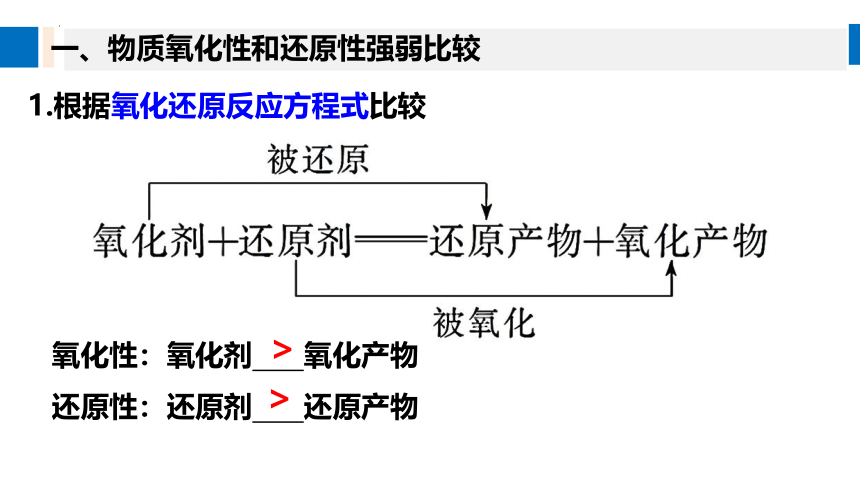
1.根据氧化还原反应方程式比较
氧化性:氧化剂 氧化产物
还原性:还原剂 还原产物
>
>
一、物质氧化性和还原性强弱比较
一、物质氧化性和还原性强弱比较
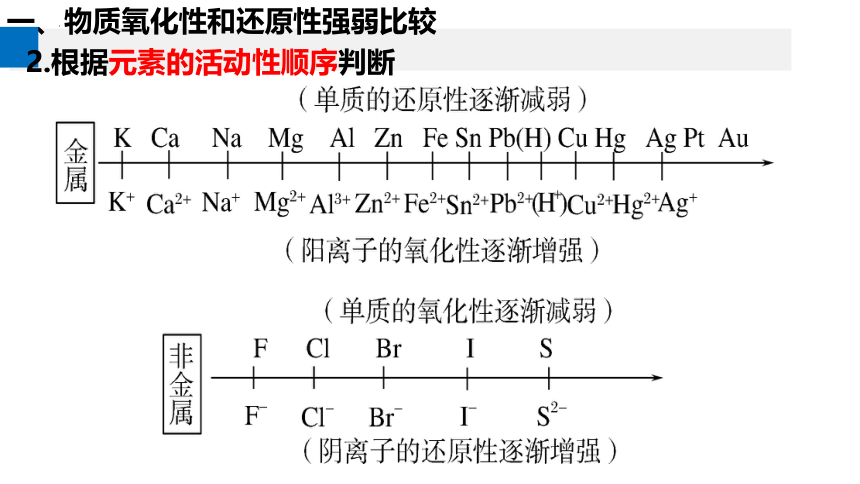
2.根据元素的活动性顺序判断
3.根据反应难易判断
一、物质氧化性和还原性强弱比较
①不同的氧化剂与同一还原剂反应,反应越容易,说明氧化剂的氧化性 。
如MnO2 + 4HCl = MnCl2 + Cl2↑+ 2H2O(需要加热)
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O(不用加热),
则MnO2的氧化性比KMnO4 (填强、弱)
弱
强
二、氧化性与还原性
4.价态规律
1、常见的氧化剂及对应的还原产物
Cl2 — — Cl-
浓硫酸 — — SO2
HNO3 — — NO/NO2
KMnO4 (H+) — —Mn2+
Fe3+ — — Fe2+/Fe
2、常见的还原剂及对应的氧化产物
Zn — — Zn2+ I- — — I2
H2 — — H+ Cl- — — Cl2
CO — — CO2 Br- — — Br2
H2S — — S
Fe2+ — — Fe3+
1.氧化还原反应的实质是什么?
2.电子守恒规律是什么?
3.氧化性和还原性的比较方法有哪几种?
4.具有氧化性和还原性的物质化合价有什么特点?
思:13分钟
议:5分钟
前3分钟:
后两分钟议导学提纲上的内容
1.氧化剂的氧化性强于氧化产物,还原剂的还原性强于还原产物,根据反应
Cl2 +2KBr= Br2 + 2KCI 、Br2 + 2KI =I2+ 2KBr
分析氧化剂氧化性的强、弱顺序及还原剂还原性的强、弱顺序
自由展
展
8分钟
规范用语:我提问、我回答、我质
疑、我纠错、我补充、、、
1.(2018·长春高一检测)在反应2KMnO4 K2MnO4+MnO2+O2↑中,还原产物是
A.只有K2MnO4 B.只有MnO2
C.K2MnO4和MnO2 D.O2
√
解析 KMnO4中的锰元素得到电子,化合价分别降低为+6价和+4价,其还原产物为K2MnO4和MnO2。
预设展
解析 CaH2为还原剂,其中H元素的化合价由-1价升高为0价;
H2O为氧化剂,其中O元素的化合价由+1价降低为0价;
H2既是氧化产物又是还原产物,其物质的量之比为1∶1。
2 CaH2可作为生氢剂,CaH2+2H2O = Ca(OH)2+2H2↑。
下列说法错误的是
CaH2既是氧化剂又是还原剂
H2既是氧化产物又是还原产物
C. CaH2是还原剂,H2O是氧化剂
D. 氧化产物与还原产物的质量比为1∶1
√
归纳总结
理解氧化还原反应的相关概念,要抓住两条线:
①还原剂化合价升高→失去电子→发生氧化反应(被氧化)→生成氧化产物。
②氧化剂化合价降低→得到电子→发生还原反应(被还原)→生成还原产物。
评
3.根据反应的难易(反应条件)比较
如:①2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
由反应条件可判断氧化性:KMnO4 MnO2。
>
4.根据变价元素被氧化或被还原的程度比较
如:①2Fe+3Cl2 2FeCl3
②Fe+S FeS
铁元素被氯气氧化为+3价,被硫氧化为+2价,则氧化性:Cl2 S
>
结
1.现有下列几个离子反应:
②2Fe2++Br2=2Fe3++2Br-
下列有关性质的比较正确的是
√
检
还原性强弱顺序为SO2>Fe2+>Br->Cl->Cr3+。
解析 根据氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,并结合卤素单质及阴离子的性质递变规律可推知,氧化性强弱顺序为
Cr2O72->Cl2>Br2>Fe3+> SO42-;
2.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O===2Fe2++ SO42- +4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.2Fe2++I2===2Fe3++2I-
D.H2O2+SO2===H2SO4
√
解析 解答本题可根据每个氧化还原反应中还原剂的还原性大于还原产物的还原性。对于A项SO2是还原剂,Fe2+是还原产物,故还原性为SO2>Fe2+,A项能发生;
B项中SO2是还原剂,HI是还原产物,故还原性为SO2>I-,B项正确;
C项中Fe2+是还原剂,I-是还原产物,故还原性为Fe2+>I-,与已知信息矛盾,故C项错;
D项中SO2是还原剂,H2O2是氧化剂,故还原性为SO2>H2O2,D项正确。
3.判断正误(正确的打“√”,错误的打“×”)
(1)氧化剂得电子被氧化为还原产物( )
(2)非金属单质在反应中只作氧化剂( )
(3)在氧化还原反应中,金属单质作反应物时一定是还原剂( )
(4)还原剂失去电子具有氧化性( )
(5)元素处于最高化合价时一定具有强氧化性( )
(6)碘化氢中碘为最低价,碘化氢只具有还原性( )
(7)还原剂在反应中失去的电子数越多,其还原性越强( )
(8)阳离子只能得电子被还原,阴离子只能失电子被氧化( )
(9)由反应Cu+2Fe3+=Cu2++2Fe2+可判断Fe3+的氧化性强于Cu2+( )
(10)经反应2H2O2 2H2O+O2↑,生成1 mol氧气转移2 mol电子( )
×
×
√
×
×
×
×
×
√
√
4.已知常温下,在溶液中可发生如下反应:Ce4++Fe2+=Fe3++Ce3+,Sn2++2Fe3+=2Fe2++Sn4+。由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是
A.Sn2+、Fe2+、Ce3+ B.Fe2+、Ce3+、Sn2+
C.Fe2+、Sn2+、Ce3+ D.Ce3+、Fe2+、Sn2+
解析 根据同一氧化还原反应中还原剂的还原性大于还原产物的还原性,由两个化学方程式可以得到还原性强弱顺序为Fe2+>Ce3+,Sn2+>Fe2+。
√
下节提示:
钠及其化合物
第4课时 氧化性和还原性
第二章 第三节 氧化还原反应
学习目标
1.通过阅读课本20-24页,复习氧化还原反应的实质是什么。
2.通过阅读课本20-24页,学习氧化还原反应的基本规律。
3.通过阅读课本20-24页,学习歧化反应和归中反应。
【重难点】 氧化还原反应的基本规律
导
1.根据氧化还原反应方程式比较
氧化性:氧化剂 氧化产物
还原性:还原剂 还原产物
>
>
一、物质氧化性和还原性强弱比较
一、物质氧化性和还原性强弱比较
2.根据元素的活动性顺序判断
3.根据反应难易判断
一、物质氧化性和还原性强弱比较
①不同的氧化剂与同一还原剂反应,反应越容易,说明氧化剂的氧化性 。
如MnO2 + 4HCl = MnCl2 + Cl2↑+ 2H2O(需要加热)
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O(不用加热),
则MnO2的氧化性比KMnO4 (填强、弱)
弱
强
二、氧化性与还原性
4.价态规律
1、常见的氧化剂及对应的还原产物
Cl2 — — Cl-
浓硫酸 — — SO2
HNO3 — — NO/NO2
KMnO4 (H+) — —Mn2+
Fe3+ — — Fe2+/Fe
2、常见的还原剂及对应的氧化产物
Zn — — Zn2+ I- — — I2
H2 — — H+ Cl- — — Cl2
CO — — CO2 Br- — — Br2
H2S — — S
Fe2+ — — Fe3+
1.氧化还原反应的实质是什么?
2.电子守恒规律是什么?
3.氧化性和还原性的比较方法有哪几种?
4.具有氧化性和还原性的物质化合价有什么特点?
思:13分钟
议:5分钟
前3分钟:
后两分钟议导学提纲上的内容
1.氧化剂的氧化性强于氧化产物,还原剂的还原性强于还原产物,根据反应
Cl2 +2KBr= Br2 + 2KCI 、Br2 + 2KI =I2+ 2KBr
分析氧化剂氧化性的强、弱顺序及还原剂还原性的强、弱顺序
自由展
展
8分钟
规范用语:我提问、我回答、我质
疑、我纠错、我补充、、、
1.(2018·长春高一检测)在反应2KMnO4 K2MnO4+MnO2+O2↑中,还原产物是
A.只有K2MnO4 B.只有MnO2
C.K2MnO4和MnO2 D.O2
√
解析 KMnO4中的锰元素得到电子,化合价分别降低为+6价和+4价,其还原产物为K2MnO4和MnO2。
预设展
解析 CaH2为还原剂,其中H元素的化合价由-1价升高为0价;
H2O为氧化剂,其中O元素的化合价由+1价降低为0价;
H2既是氧化产物又是还原产物,其物质的量之比为1∶1。
2 CaH2可作为生氢剂,CaH2+2H2O = Ca(OH)2+2H2↑。
下列说法错误的是
CaH2既是氧化剂又是还原剂
H2既是氧化产物又是还原产物
C. CaH2是还原剂,H2O是氧化剂
D. 氧化产物与还原产物的质量比为1∶1
√
归纳总结
理解氧化还原反应的相关概念,要抓住两条线:
①还原剂化合价升高→失去电子→发生氧化反应(被氧化)→生成氧化产物。
②氧化剂化合价降低→得到电子→发生还原反应(被还原)→生成还原产物。
评
3.根据反应的难易(反应条件)比较
如:①2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
由反应条件可判断氧化性:KMnO4 MnO2。
>
4.根据变价元素被氧化或被还原的程度比较
如:①2Fe+3Cl2 2FeCl3
②Fe+S FeS
铁元素被氯气氧化为+3价,被硫氧化为+2价,则氧化性:Cl2 S
>
结
1.现有下列几个离子反应:
②2Fe2++Br2=2Fe3++2Br-
下列有关性质的比较正确的是
√
检
还原性强弱顺序为SO2>Fe2+>Br->Cl->Cr3+。
解析 根据氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,并结合卤素单质及阴离子的性质递变规律可推知,氧化性强弱顺序为
Cr2O72->Cl2>Br2>Fe3+> SO42-;
2.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O===2Fe2++ SO42- +4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.2Fe2++I2===2Fe3++2I-
D.H2O2+SO2===H2SO4
√
解析 解答本题可根据每个氧化还原反应中还原剂的还原性大于还原产物的还原性。对于A项SO2是还原剂,Fe2+是还原产物,故还原性为SO2>Fe2+,A项能发生;
B项中SO2是还原剂,HI是还原产物,故还原性为SO2>I-,B项正确;
C项中Fe2+是还原剂,I-是还原产物,故还原性为Fe2+>I-,与已知信息矛盾,故C项错;
D项中SO2是还原剂,H2O2是氧化剂,故还原性为SO2>H2O2,D项正确。
3.判断正误(正确的打“√”,错误的打“×”)
(1)氧化剂得电子被氧化为还原产物( )
(2)非金属单质在反应中只作氧化剂( )
(3)在氧化还原反应中,金属单质作反应物时一定是还原剂( )
(4)还原剂失去电子具有氧化性( )
(5)元素处于最高化合价时一定具有强氧化性( )
(6)碘化氢中碘为最低价,碘化氢只具有还原性( )
(7)还原剂在反应中失去的电子数越多,其还原性越强( )
(8)阳离子只能得电子被还原,阴离子只能失电子被氧化( )
(9)由反应Cu+2Fe3+=Cu2++2Fe2+可判断Fe3+的氧化性强于Cu2+( )
(10)经反应2H2O2 2H2O+O2↑,生成1 mol氧气转移2 mol电子( )
×
×
√
×
×
×
×
×
√
√
4.已知常温下,在溶液中可发生如下反应:Ce4++Fe2+=Fe3++Ce3+,Sn2++2Fe3+=2Fe2++Sn4+。由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是
A.Sn2+、Fe2+、Ce3+ B.Fe2+、Ce3+、Sn2+
C.Fe2+、Sn2+、Ce3+ D.Ce3+、Fe2+、Sn2+
解析 根据同一氧化还原反应中还原剂的还原性大于还原产物的还原性,由两个化学方程式可以得到还原性强弱顺序为Fe2+>Ce3+,Sn2+>Fe2+。
√
下节提示:
钠及其化合物
