化学人教版(2019)必修第一册1.3.3.氧化剂还原剂(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.3.氧化剂还原剂(共18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 553.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-04 17:19:19 | ||
图片预览






文档简介
(共18张PPT)
第3课时 氧化剂与还原剂
第一章 第三节 氧化还原反应
导
学习目标 通过阅读课本23-24页掌握
氧化剂和还原剂概念并会判断,知道常见的氧化剂还原剂
五组概念的判断:
氧化剂与还原剂、氧化性与还原性、被氧化与被还原
氧化反应与还原反应、氧化产物与还原产物
重点、难点:氧化剂、还原剂的判断;
五组概念判断辨析
得 到
偏 向
降 低
失 去
偏 离
升 高
1. 氧化剂与还原剂
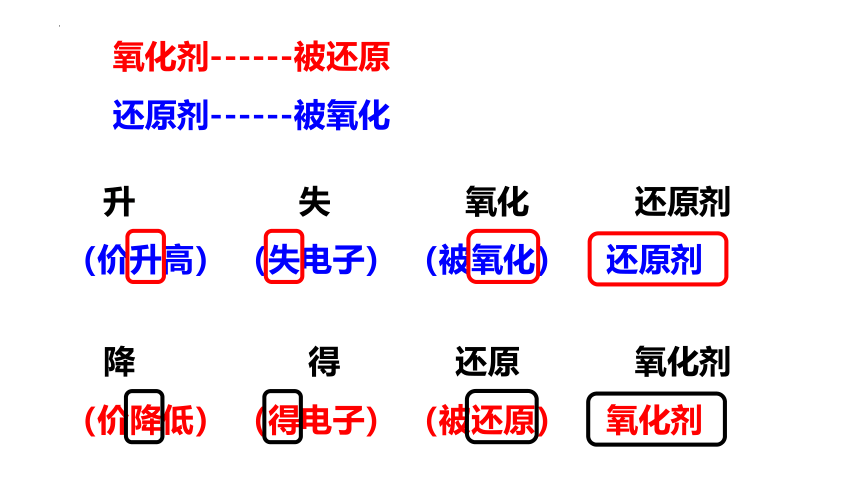
升 失 氧化 还原剂
(价升高) (失电子) (被氧化) 还原剂
降 得 还原 氧化剂
(价降低) (得电子) (被还原) 氧化剂
氧化剂------被还原
还原剂------被氧化
氧化性:得电子的能力 (氧化剂具有氧化性)
还原性:失电子的能力 (还原剂具有还原性)
氧化产物:发生氧化反应后的生成物
还原产物:发生还原反应后的生成物
2. 氧化产物和还原产物
3. 氧化性与还原性
思
前7分钟 (课本23-24页)
后6分钟 完成对应的练习题
如何判断氧化剂和还原剂?
怎么理解五组概念:
氧化剂与还原剂、氧化性与还原性、被氧化与被还原
氧化反应与还原反应、氧化产物与还原产物
议和展
在合作中解决问题
讨论重点:
1.看课本时有疑问的地方。
2.学案中存在的问题及迁移应用中答案不一致的题目
要求: 拿起资料,全员参与,
求同解疑,注重效率。
时间:5min
展
自由展
规范用语:我提问、我回答、我质疑、
我纠错、我补充、
例1 分析下列反应并按要求填空
氧化剂是_____ 还原剂是____
Cl2
Fe
氧化剂是 ________ 还原剂是 ________
氧化产物是 还原产物是__ __ _
KMnO4
KMnO4
预设展
K2MnO4
MnO2
O2
5. 常见的氧化剂和还原剂
1、常见的氧化剂
①活泼性较强的非金属单质:如Cl2、O2
②变价元素的高价态化合物:
如KMnO4、FeCl3、HNO3、浓硫酸、KClO3
③过氧化物:如Na2O2、H2O2
④其他:如HClO、漂白粉、MnO2
5. 常见的氧化剂和还原剂
2、常见的氧化剂及对应的还原产物
Cl2 — — Cl-、
浓硫酸 — — SO2
HNO3 — — NO/NO2
KMnO4 (H+) — —Mn2+
Fe3+ — — Fe2+/Fe
3、常见的还原剂
①活泼性较强的金属单质:如Al、Fe、Zn
②某些非金属单质:如H2、S、C
③变价元素的低价态化合物:如CO2、SO2
④其他:如浓盐酸、NH3 、H2S
5. 常见的氧化剂和还原剂
5. 常见的氧化剂和还原剂
4、常见的还原剂及对应的氧化产物
Zn — — Zn2+ I- — — I2
H2 — — H+ CI- — — Cl2
CO — — CO2 Br- — — Br2
H2S — — S
Fe2+ — — Fe3+
学习小结
结
1在下列反应中,CO2作氧化剂的是
A.Ca(OH)2+CO2===CaCO3↓+H2O
解析 选项A中CO2中C元素化合价无变化;
选项B中CO2中C元素化合价由+4价降低为+2价,作氧化剂;
选项C、D中CO2都为氧化产物。
√
解析 CaH2为还原剂,其中H元素的化合价由-1价升高为0价;
H2O为氧化剂,其中O元素的化合价由+1价降低为0价;
H2既是氧化产物又是还原产物,其物质的量之比为1∶1。
2 CaH2可作为生氢剂,CaH2+2H2O = Ca(OH)2+2H2↑。下列说法错误的是
CaH2既是氧化剂又是还原剂
H2既是氧化产物又是还原产物
C. CaH2是还原剂,H2O是氧化剂
D. 氧化产物与还原产物的质量比为1∶1
√
3、下列物质转化需要加入还原剂才能实现的是( )
A.SO32- →SO2 B.HCl→Cl2
C.Na →Na+ D.SO2→S
4、在下列分子、原子、或离子中,既具有还原性又具有氧化性的是( )
A.Al3+ B.Cl- C.Fe D.SO2
√
√
下节提示:
氧化性、还原性的比较
第3课时 氧化剂与还原剂
第一章 第三节 氧化还原反应
导
学习目标 通过阅读课本23-24页掌握
氧化剂和还原剂概念并会判断,知道常见的氧化剂还原剂
五组概念的判断:
氧化剂与还原剂、氧化性与还原性、被氧化与被还原
氧化反应与还原反应、氧化产物与还原产物
重点、难点:氧化剂、还原剂的判断;
五组概念判断辨析
得 到
偏 向
降 低
失 去
偏 离
升 高
1. 氧化剂与还原剂
升 失 氧化 还原剂
(价升高) (失电子) (被氧化) 还原剂
降 得 还原 氧化剂
(价降低) (得电子) (被还原) 氧化剂
氧化剂------被还原
还原剂------被氧化
氧化性:得电子的能力 (氧化剂具有氧化性)
还原性:失电子的能力 (还原剂具有还原性)
氧化产物:发生氧化反应后的生成物
还原产物:发生还原反应后的生成物
2. 氧化产物和还原产物
3. 氧化性与还原性
思
前7分钟 (课本23-24页)
后6分钟 完成对应的练习题
如何判断氧化剂和还原剂?
怎么理解五组概念:
氧化剂与还原剂、氧化性与还原性、被氧化与被还原
氧化反应与还原反应、氧化产物与还原产物
议和展
在合作中解决问题
讨论重点:
1.看课本时有疑问的地方。
2.学案中存在的问题及迁移应用中答案不一致的题目
要求: 拿起资料,全员参与,
求同解疑,注重效率。
时间:5min
展
自由展
规范用语:我提问、我回答、我质疑、
我纠错、我补充、
例1 分析下列反应并按要求填空
氧化剂是_____ 还原剂是____
Cl2
Fe
氧化剂是 ________ 还原剂是 ________
氧化产物是 还原产物是__ __ _
KMnO4
KMnO4
预设展
K2MnO4
MnO2
O2
5. 常见的氧化剂和还原剂
1、常见的氧化剂
①活泼性较强的非金属单质:如Cl2、O2
②变价元素的高价态化合物:
如KMnO4、FeCl3、HNO3、浓硫酸、KClO3
③过氧化物:如Na2O2、H2O2
④其他:如HClO、漂白粉、MnO2
5. 常见的氧化剂和还原剂
2、常见的氧化剂及对应的还原产物
Cl2 — — Cl-、
浓硫酸 — — SO2
HNO3 — — NO/NO2
KMnO4 (H+) — —Mn2+
Fe3+ — — Fe2+/Fe
3、常见的还原剂
①活泼性较强的金属单质:如Al、Fe、Zn
②某些非金属单质:如H2、S、C
③变价元素的低价态化合物:如CO2、SO2
④其他:如浓盐酸、NH3 、H2S
5. 常见的氧化剂和还原剂
5. 常见的氧化剂和还原剂
4、常见的还原剂及对应的氧化产物
Zn — — Zn2+ I- — — I2
H2 — — H+ CI- — — Cl2
CO — — CO2 Br- — — Br2
H2S — — S
Fe2+ — — Fe3+
学习小结
结
1在下列反应中,CO2作氧化剂的是
A.Ca(OH)2+CO2===CaCO3↓+H2O
解析 选项A中CO2中C元素化合价无变化;
选项B中CO2中C元素化合价由+4价降低为+2价,作氧化剂;
选项C、D中CO2都为氧化产物。
√
解析 CaH2为还原剂,其中H元素的化合价由-1价升高为0价;
H2O为氧化剂,其中O元素的化合价由+1价降低为0价;
H2既是氧化产物又是还原产物,其物质的量之比为1∶1。
2 CaH2可作为生氢剂,CaH2+2H2O = Ca(OH)2+2H2↑。下列说法错误的是
CaH2既是氧化剂又是还原剂
H2既是氧化产物又是还原产物
C. CaH2是还原剂,H2O是氧化剂
D. 氧化产物与还原产物的质量比为1∶1
√
3、下列物质转化需要加入还原剂才能实现的是( )
A.SO32- →SO2 B.HCl→Cl2
C.Na →Na+ D.SO2→S
4、在下列分子、原子、或离子中,既具有还原性又具有氧化性的是( )
A.Al3+ B.Cl- C.Fe D.SO2
√
√
下节提示:
氧化性、还原性的比较
