化学人教版(2019)必修第一册2.1.2 钠的氧化物(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.2 钠的氧化物(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 928.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-04 18:49:05 | ||
图片预览




文档简介
(共20张PPT)
必修第一册
第二章 海水中的重要元素——钠和氯
第一节 钠及其化合物
第2课时 钠的氧化物
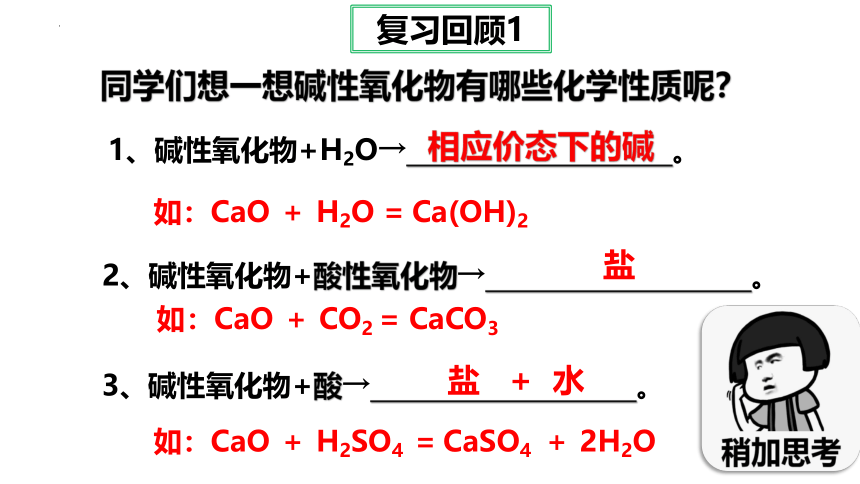
同学们想一想碱性氧化物有哪些化学性质呢?
1、碱性氧化物+H2O→ 。
2、碱性氧化物+酸性氧化物→ 。
3、碱性氧化物+酸→ 。
相应价态下的碱
盐
盐 + 水
如:CaO + H2O = Ca(OH)2
如:CaO + CO2 = CaCO3
如:CaO + H2SO4 = CaSO4 + 2H2O
复习回顾1
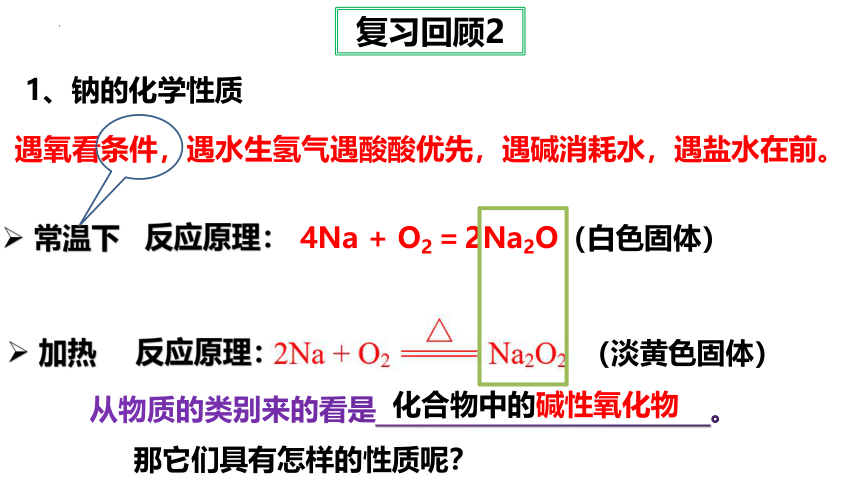
反应原理:
4Na + O2 = 2Na2O(白色固体)
常温下
加热
反应原理:
复习回顾2
遇氧看条件,遇水生氢气遇酸酸优先,遇碱消耗水,遇盐水在前。
1、钠的化学性质
(淡黄色固体)
从物质的类别来的看是 。
化合物中的碱性氧化物
那它们具有怎样的性质呢?
PART
01
PART
02
PART
03
核心素养发展目标
从物质类别、元素化合价的角度认识氧化钠与过氧化钠的性质。
熟知过氧化钠与水和二氧化碳反应的应用。
会设计实验探究过氧化钠与水的反应,增强科学探究与创新意识。
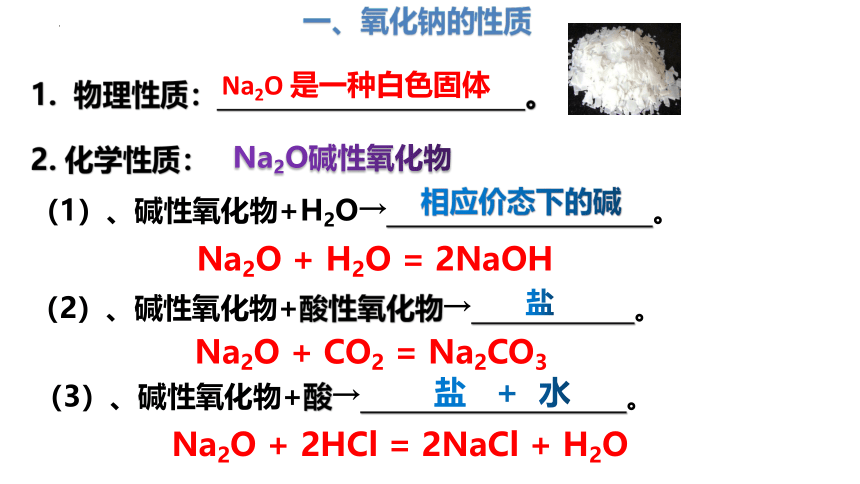
一、氧化钠的性质
1. 物理性质: 。
Na2O 是一种白色固体
2. 化学性质:
Na2O碱性氧化物
(1)、碱性氧化物+H2O→ 。
(2)、碱性氧化物+酸性氧化物→ 。
(3)、碱性氧化物+酸→ 。
相应价态下的碱
盐
盐 + 水
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
Na2O + 2HCl = 2NaCl + H2O
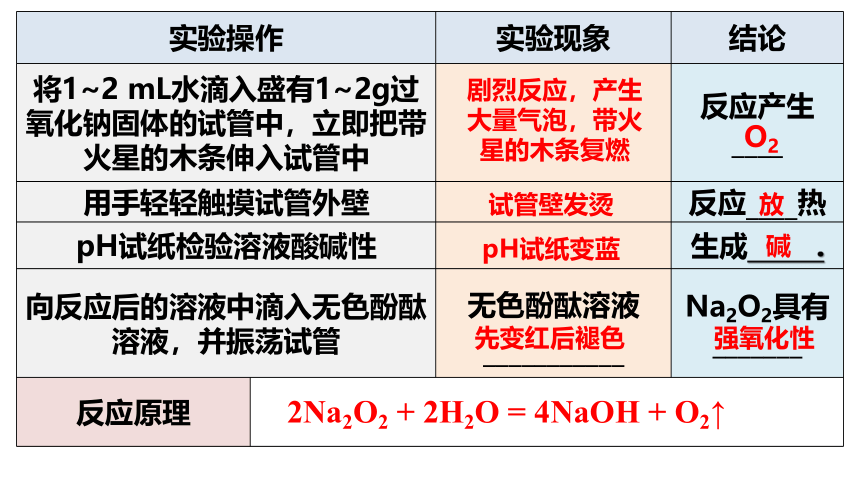
【交流讨论】【实验2-3】从物质的分类角度来看,氧化钠与过氧化钠都是氧化物,氧化钠与水反应生成氢氧化钠,过氧化钠与水反应会生成什么物质?
实验操作 实验现象 结论
将1~2 mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中 反应产生____
用手轻轻触摸试管外壁 反应____热
pH试纸检验溶液酸碱性 生成 .
向反应后的溶液中滴入无色酚酞溶液,并振荡试管 无色酚酞溶液___________ Na2O2具有_______
反应原理
O2
先变红后褪色
碱
剧烈反应,产生大量气泡,带火星的木条复燃
试管壁发烫
pH试纸变蓝
放
强氧化性
2Na2O2 + 2H2O = 4NaOH + O2↑
反应原理:
2Na2O2 + 2CO2 = 2Na2CO3+O2
1、观看吹气生为火实验,观察实验现象,思考反应原理
现象:
脱脂棉燃烧起来
过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠。
过氧化钠与二氧化碳的反应
2、思考:棉花燃烧原因
过氧化钠可在呼吸面具或潜水艇中作为 。
供氧剂
3、应用
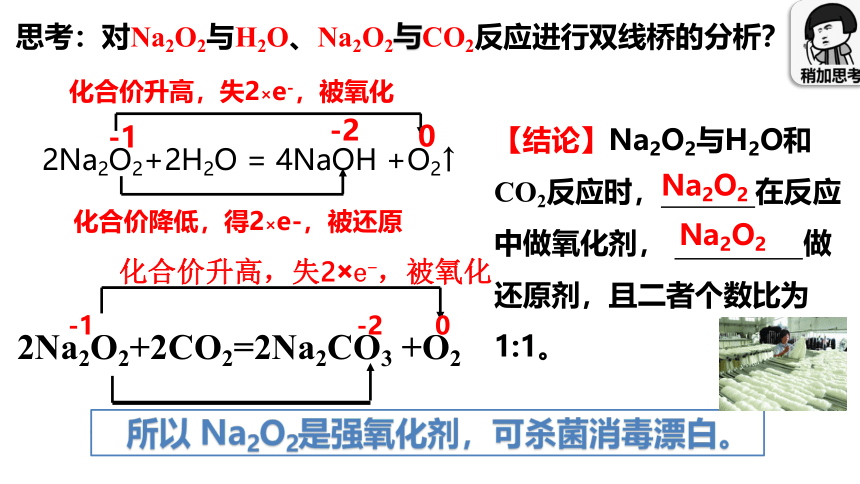
思考:对Na2O2与H2O、Na2O2与CO2反应进行双线桥的分析?
2Na2O2+2H2O = 4NaOH +O2↑
化合价升高,失2×e-,被氧化
化合价降低,得2×e-,被还原
-1
-2
0
2Na2O2+2CO2=2Na2CO3 +O2
化合价升高,失2×e-,被氧化
化合价降低,得到2×e-,被还原
-1 -2 0
【结论】Na2O2与H2O和CO2反应时, 在反应中做氧化剂, 做还原剂,且二者个数比为1:1。
Na2O2
Na2O2
所以 Na2O2是强氧化剂,可杀菌消毒漂白。
3、试根据Na2O2与水的反应,类比写出其与硫酸的反应方程式
2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑
思考1: Na2O2是不是碱性氧化物?
不是,碱性氧化物与酸反应只生成盐和水,Na2O2是过氧化物。
思考2:如何理解Na2O2与Na2O之间性质上的差异?
在Na2O2中,氧是-1价介于氧的两种较稳定化合价0和-2之间,Na2O2既有氧化性又有还原性,还可以在一定条件下发生自身氧化还原反应,但主要以氧化性为主。
2Na2O2 + 2H2O=4NaOH + O2↑
4、Na2O2的强氧化性与还原性
过氧化钠中的氧是-1价,处于中间价态,既能表现氧化性,又能表现还原性。
(1)强氧化性
①与Na2SO3溶液反应:
Na2O2+Na2SO3+H2O===Na2SO4+2NaOH
②有强氧化性,具有杀菌、消毒、漂白的作用。
如能使品红溶液褪色。
(2)还原性
遇KMnO4等强氧化剂时,Na2O2表现出还原性,
氧化产物为O2。
(3)遇CO2、H2O、H+时,Na2O2发生自身的氧化还原反应,氧元素的歧化反应。此时,Na2O2既是氧化剂又是还原剂。
(1)Na2O和Na2O2中氧元素的化合价分别为-2和-1。( )
(5)Na2O与Na2O2都是碱性氧化物( )
(4)Na2O2与H2O的反应中,H2O是还原剂( )
×
√
×
√
(2)Na2O与Na2O2中的氧元素的化合价不相同,钠元素的化合价相同( )
(3)Na2O与Na2O2的阴、阳离子个数比均为1∶2( )
明辩事非
Na2O2可以拆成2个Na+和1个O22-(过氧根离子是原子团)
Na2O2即氧化剂也是还原剂
×
碱性氧化物与酸反应只生成盐和水,Na2O2与盐酸反应时不仅生成NaCl和水,还会有氧气生成,故Na2O2不属于碱性氧化物。
思考2:将44 g CO2 通过足量的 Na2O2 固体,Na2O2固体质量增加多少?
2Na2O2+2CO2 = 2Na2CO3+O2 Δm(固体)
2×78 2×44 2×106 32 56
44g 28g
结论:Na2O2与CO2的反应,固体增重,实为CO的质量
思考1:将18 g 水蒸气通过足量的Na2O2固体,Na2O2固体质量增加多少?
2Na2O2+2H2O = 4NaOH+O2↑ Δm(固体)
2×78 2×18 4×40 4
18 g 2g
结论:Na2O2与H2O的反应,固体增重,实为H2的质量
探究过氧化钠与水、二氧化碳反应的定量关系
课堂小结:氧化钠与过氧化钠
Na2O Na2O2
颜色
阴阳离子个数比
氧元素的化合价
是否为碱性氧化物
与H2O反应
与CO2反应
与盐酸反应
氧化性/漂白性
主要用途
白色
淡黄色
1∶2
1∶2
-2
-1
是
否
Na2O + H2O = 2NaOH
2Na2O2 + 2H2O =4NaOH + O2↑
Na2O + CO2 =Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na2O + 2HCl = 2NaCl + H2O
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
无
有
制备NaOH
强氧化剂、漂白剂、供氧剂
1、下列对于Na2O、Na2O2的比较正确的一项是 ( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2、Na2O均可作供氧剂
同步练习
D
2、分别向下列溶液中加入少量的过氧化钠固体,不会出现浑浊的是 ( )
A.Na2CO3溶液 B.FeCl3溶液
C.饱和Ca(OH)2溶液 D.CuSO4溶液
A
3、下列判断正确的是( )
A.可用水来检验Na2O粉末中是否含有Na2O2
B.可用CO2来检验Na2O粉末中是否含有Na2O2
C.可利用在纯氧中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色
A
4、如图所示,试管b中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水。将气球用橡皮绳紧紧地系在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
A.U形管内浅红色的水褪色 B.试管内溶液变红
C.气球a被吹大 D.U形管内的水位:c高于d
C
5、下列叙述中不正确的是( )A.Na2O2是淡黄色固体,Na2O是白色固体,二者都能与水反应生成NaOHB.Na和O2在加热时反应生成Na2O2,在常温下反应生成Na2OC.Na2O与CO2发生反应生成Na2CO3,Na2O2与CO2反应生成Na2CO3和O2D.2 g H2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重18 g
D
解析:2 g H2充分燃烧后生成18 g水,完全被Na2O2固体吸收发生反应2Na2O2+2H2O=4NaOH+O2↑,由质量守恒可知,固体由Na2O2→NaOH,18 g水被吸收后生成16 g O2,即Na2O2固体增重2 g。
6、在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验仪器,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是制取CO2的装置,写出A中发生反应的离子方程式:____________
_____________________。
=Ca2++H2O+CO2↑
CaCO3+2H+
(2)写出过氧化钠与二氧化碳反应的化学方程式:____________________
_____________。
(3)用_____________检验F中收集到的气体,现象是_________。
2Na2CO3+O2
2Na2O2+2CO2=
带火星的木条
木条复燃
1、氧气还有哪些制备方法?用过氧化钠制备氧气有什么优点?
2、课后查阅文献,了解过氧化钠的更多用途。
名称: 。
肤色: 。
类别: 。
相对分了质量: 。
性格:活泼,爱憎分明,一见到二氧化碳,脸色就变,一落水就非常生气
简介
中学毕业后参军,后调海军某潜艇当班长,负责制造氧气,复原后,在立白化工厂当工人,曾与氯气,二氧化硫等一起光荣出席全国漂白积极分子群英会,
知识拓展:
过氧化钠
淡黄色
过氧化物
78
谢谢观看
必修第一册
第二章 海水中的重要元素——钠和氯
第一节 钠及其化合物
第2课时 钠的氧化物
同学们想一想碱性氧化物有哪些化学性质呢?
1、碱性氧化物+H2O→ 。
2、碱性氧化物+酸性氧化物→ 。
3、碱性氧化物+酸→ 。
相应价态下的碱
盐
盐 + 水
如:CaO + H2O = Ca(OH)2
如:CaO + CO2 = CaCO3
如:CaO + H2SO4 = CaSO4 + 2H2O
复习回顾1
反应原理:
4Na + O2 = 2Na2O(白色固体)
常温下
加热
反应原理:
复习回顾2
遇氧看条件,遇水生氢气遇酸酸优先,遇碱消耗水,遇盐水在前。
1、钠的化学性质
(淡黄色固体)
从物质的类别来的看是 。
化合物中的碱性氧化物
那它们具有怎样的性质呢?
PART
01
PART
02
PART
03
核心素养发展目标
从物质类别、元素化合价的角度认识氧化钠与过氧化钠的性质。
熟知过氧化钠与水和二氧化碳反应的应用。
会设计实验探究过氧化钠与水的反应,增强科学探究与创新意识。
一、氧化钠的性质
1. 物理性质: 。
Na2O 是一种白色固体
2. 化学性质:
Na2O碱性氧化物
(1)、碱性氧化物+H2O→ 。
(2)、碱性氧化物+酸性氧化物→ 。
(3)、碱性氧化物+酸→ 。
相应价态下的碱
盐
盐 + 水
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
Na2O + 2HCl = 2NaCl + H2O
【交流讨论】【实验2-3】从物质的分类角度来看,氧化钠与过氧化钠都是氧化物,氧化钠与水反应生成氢氧化钠,过氧化钠与水反应会生成什么物质?
实验操作 实验现象 结论
将1~2 mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中 反应产生____
用手轻轻触摸试管外壁 反应____热
pH试纸检验溶液酸碱性 生成 .
向反应后的溶液中滴入无色酚酞溶液,并振荡试管 无色酚酞溶液___________ Na2O2具有_______
反应原理
O2
先变红后褪色
碱
剧烈反应,产生大量气泡,带火星的木条复燃
试管壁发烫
pH试纸变蓝
放
强氧化性
2Na2O2 + 2H2O = 4NaOH + O2↑
反应原理:
2Na2O2 + 2CO2 = 2Na2CO3+O2
1、观看吹气生为火实验,观察实验现象,思考反应原理
现象:
脱脂棉燃烧起来
过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠。
过氧化钠与二氧化碳的反应
2、思考:棉花燃烧原因
过氧化钠可在呼吸面具或潜水艇中作为 。
供氧剂
3、应用
思考:对Na2O2与H2O、Na2O2与CO2反应进行双线桥的分析?
2Na2O2+2H2O = 4NaOH +O2↑
化合价升高,失2×e-,被氧化
化合价降低,得2×e-,被还原
-1
-2
0
2Na2O2+2CO2=2Na2CO3 +O2
化合价升高,失2×e-,被氧化
化合价降低,得到2×e-,被还原
-1 -2 0
【结论】Na2O2与H2O和CO2反应时, 在反应中做氧化剂, 做还原剂,且二者个数比为1:1。
Na2O2
Na2O2
所以 Na2O2是强氧化剂,可杀菌消毒漂白。
3、试根据Na2O2与水的反应,类比写出其与硫酸的反应方程式
2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑
思考1: Na2O2是不是碱性氧化物?
不是,碱性氧化物与酸反应只生成盐和水,Na2O2是过氧化物。
思考2:如何理解Na2O2与Na2O之间性质上的差异?
在Na2O2中,氧是-1价介于氧的两种较稳定化合价0和-2之间,Na2O2既有氧化性又有还原性,还可以在一定条件下发生自身氧化还原反应,但主要以氧化性为主。
2Na2O2 + 2H2O=4NaOH + O2↑
4、Na2O2的强氧化性与还原性
过氧化钠中的氧是-1价,处于中间价态,既能表现氧化性,又能表现还原性。
(1)强氧化性
①与Na2SO3溶液反应:
Na2O2+Na2SO3+H2O===Na2SO4+2NaOH
②有强氧化性,具有杀菌、消毒、漂白的作用。
如能使品红溶液褪色。
(2)还原性
遇KMnO4等强氧化剂时,Na2O2表现出还原性,
氧化产物为O2。
(3)遇CO2、H2O、H+时,Na2O2发生自身的氧化还原反应,氧元素的歧化反应。此时,Na2O2既是氧化剂又是还原剂。
(1)Na2O和Na2O2中氧元素的化合价分别为-2和-1。( )
(5)Na2O与Na2O2都是碱性氧化物( )
(4)Na2O2与H2O的反应中,H2O是还原剂( )
×
√
×
√
(2)Na2O与Na2O2中的氧元素的化合价不相同,钠元素的化合价相同( )
(3)Na2O与Na2O2的阴、阳离子个数比均为1∶2( )
明辩事非
Na2O2可以拆成2个Na+和1个O22-(过氧根离子是原子团)
Na2O2即氧化剂也是还原剂
×
碱性氧化物与酸反应只生成盐和水,Na2O2与盐酸反应时不仅生成NaCl和水,还会有氧气生成,故Na2O2不属于碱性氧化物。
思考2:将44 g CO2 通过足量的 Na2O2 固体,Na2O2固体质量增加多少?
2Na2O2+2CO2 = 2Na2CO3+O2 Δm(固体)
2×78 2×44 2×106 32 56
44g 28g
结论:Na2O2与CO2的反应,固体增重,实为CO的质量
思考1:将18 g 水蒸气通过足量的Na2O2固体,Na2O2固体质量增加多少?
2Na2O2+2H2O = 4NaOH+O2↑ Δm(固体)
2×78 2×18 4×40 4
18 g 2g
结论:Na2O2与H2O的反应,固体增重,实为H2的质量
探究过氧化钠与水、二氧化碳反应的定量关系
课堂小结:氧化钠与过氧化钠
Na2O Na2O2
颜色
阴阳离子个数比
氧元素的化合价
是否为碱性氧化物
与H2O反应
与CO2反应
与盐酸反应
氧化性/漂白性
主要用途
白色
淡黄色
1∶2
1∶2
-2
-1
是
否
Na2O + H2O = 2NaOH
2Na2O2 + 2H2O =4NaOH + O2↑
Na2O + CO2 =Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na2O + 2HCl = 2NaCl + H2O
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
无
有
制备NaOH
强氧化剂、漂白剂、供氧剂
1、下列对于Na2O、Na2O2的比较正确的一项是 ( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2、Na2O均可作供氧剂
同步练习
D
2、分别向下列溶液中加入少量的过氧化钠固体,不会出现浑浊的是 ( )
A.Na2CO3溶液 B.FeCl3溶液
C.饱和Ca(OH)2溶液 D.CuSO4溶液
A
3、下列判断正确的是( )
A.可用水来检验Na2O粉末中是否含有Na2O2
B.可用CO2来检验Na2O粉末中是否含有Na2O2
C.可利用在纯氧中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色
A
4、如图所示,试管b中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水。将气球用橡皮绳紧紧地系在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
A.U形管内浅红色的水褪色 B.试管内溶液变红
C.气球a被吹大 D.U形管内的水位:c高于d
C
5、下列叙述中不正确的是( )A.Na2O2是淡黄色固体,Na2O是白色固体,二者都能与水反应生成NaOHB.Na和O2在加热时反应生成Na2O2,在常温下反应生成Na2OC.Na2O与CO2发生反应生成Na2CO3,Na2O2与CO2反应生成Na2CO3和O2D.2 g H2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重18 g
D
解析:2 g H2充分燃烧后生成18 g水,完全被Na2O2固体吸收发生反应2Na2O2+2H2O=4NaOH+O2↑,由质量守恒可知,固体由Na2O2→NaOH,18 g水被吸收后生成16 g O2,即Na2O2固体增重2 g。
6、在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验仪器,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是制取CO2的装置,写出A中发生反应的离子方程式:____________
_____________________。
=Ca2++H2O+CO2↑
CaCO3+2H+
(2)写出过氧化钠与二氧化碳反应的化学方程式:____________________
_____________。
(3)用_____________检验F中收集到的气体,现象是_________。
2Na2CO3+O2
2Na2O2+2CO2=
带火星的木条
木条复燃
1、氧气还有哪些制备方法?用过氧化钠制备氧气有什么优点?
2、课后查阅文献,了解过氧化钠的更多用途。
名称: 。
肤色: 。
类别: 。
相对分了质量: 。
性格:活泼,爱憎分明,一见到二氧化碳,脸色就变,一落水就非常生气
简介
中学毕业后参军,后调海军某潜艇当班长,负责制造氧气,复原后,在立白化工厂当工人,曾与氯气,二氧化硫等一起光荣出席全国漂白积极分子群英会,
知识拓展:
过氧化钠
淡黄色
过氧化物
78
谢谢观看
