第四章生命之源—水单元测试题-2022-2023学年九年级化学科粤版(2012)上册(有答案)
文档属性
| 名称 | 第四章生命之源—水单元测试题-2022-2023学年九年级化学科粤版(2012)上册(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 179.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-04 21:30:14 | ||
图片预览


文档简介
第四章生命之源—水单元测试题-2022-2023学年九年级化学科粤版(2012)上册
一、单选题
1.下列方法可将海水转化为淡水的是( )
A.蒸馏 B.静置 C.过滤 D.消毒
2.2020年,“中国水周”活动的主题为“坚持节水优先,建设幸福河湖”。下列图标是我国“国家节水标志”的是
A. B. C. D.
3.根据现象,推断出B与A的相对分子质量相差( )
A.37.0 B.95.0 C.18.5 D.58.5
4.在一个密闭容器中放入P、Q、R、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识正确的是( )
物质 P Q R W
反应前的质量(g) 5 2 14 18
反应后的质量(g) 20 x 4 13
A.参加化学反应的P和W的质量比为3:2
B.该反应用现象表示为:
C.反应后容器中R与Q的质量比为1:2
D.Q在反应中可能作催化剂
5.石灰氮(化学式为CaCN2)是一种固态肥料,遇水发生反应的现象为CaCN2+3H2O=CaCO3+2X,则x化学式为
A.NO B.N2 C.CO2 D.NH3
6.下图是甲转化为丁的微观过程。下列说法正确的是
A.甲、丁为氧化物 B.丁中碳、氢、氧元素的质量比为2∶6∶1
C.转化①为化合反应 D.转化②中丙和H2O分子个数之比为1∶1
7.一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是
物质 甲 乙 丙 丁
反应前的质量/g 50 0.5 0 0
反应后的质量/g 23 X 24 3
A.X 的值等于 0
B.甲一定是化合物
C.丙和丁的质量变化比为 8:1
D.该反应是分解反应
8.甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如下:
下列说法正确的是
A.甲酸分子中氢、氧原子个数比为1:2
B.乙中碳、氧元素质量比为1:2
C.46g甲酸中氢元素质量为2g
D.生成甲与乙的分子个数比为2:1
9.“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是
A.甲醛(CH2O)
B.甲醇(CH4O)
C.乙醇(C2H6O)
D.乙酸(C2H4O2)
10.下列实验设计能达到目的的是
A.测定空气中氧气含量 B.细铁丝在氧气中燃烧
C.探究温度对分子运动快慢的影响 D.探究质量守恒定律
11.在一密闭容器中加入甲、乙、丙、丁四种物质,在下定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示。下列说法中不正确的是
A.该反应为化合反应
B.丙可能为该反应的催化剂
C.该反应中,乙、丁的质量变化之比为7∶5
D.该反应中,甲、乙的质量变化之比为1∶4
12.把一定质量的甲、乙、丙、丁四种物质放在密闭容器中,在一定条件下反应一段时间后,测得反应前后各物质的质量如下表所示,下列说法正确的是( )
物质 甲 乙 丙 丁
反应前的质量/g 5 9 16 3
反应后的质量/g x 20 1 7
A.反应中的乙和丁的质量比为3:1
B.物质丙可能是单质
C.该反应为化合反应
D.x=5
二、填空题
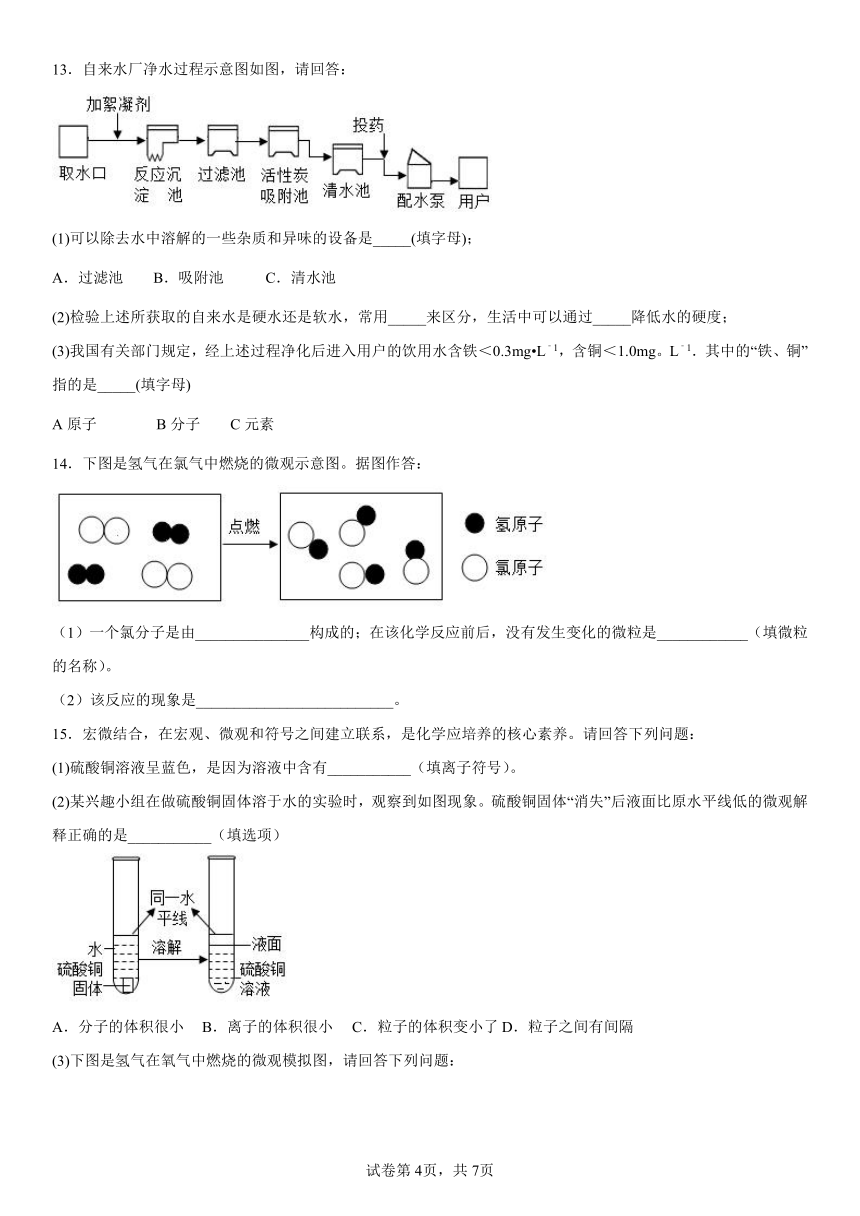
13.自来水厂净水过程示意图如图,请回答:
(1)可以除去水中溶解的一些杂质和异味的设备是_____(填字母);
A.过滤池 B.吸附池 C.清水池
(2)检验上述所获取的自来水是硬水还是软水,常用_____来区分,生活中可以通过_____降低水的硬度;
(3)我国有关部门规定,经上述过程净化后进入用户的饮用水含铁<0.3mg L﹣1,含铜<1.0mg。L﹣1.其中的“铁、铜”指的是_____(填字母)
A原子 B分子 C元素
14.下图是氢气在氯气中燃烧的微观示意图。据图作答:
(1)一个氯分子是由_______________构成的;在该化学反应前后,没有发生变化的微粒是____________(填微粒的名称)。
(2)该反应的现象是__________________________。
15.宏微结合,在宏观、微观和符号之间建立联系,是化学应培养的核心素养。请回答下列问题:
(1)硫酸铜溶液呈蓝色,是因为溶液中含有___________(填离子符号)。
(2)某兴趣小组在做硫酸铜固体溶于水的实验时,观察到如图现象。硫酸铜固体“消失”后液面比原水平线低的微观解释正确的是___________(填选项)
A.分子的体积很小 B.离子的体积很小 C.粒子的体积变小了 D.粒子之间有间隔
(3)下图是氢气在氧气中燃烧的微观模拟图,请回答下列问题:
①在B图中将相关粒子图形补充完整___________。
②此变化中参加反应的氢分子与氧分子的个数比是___________。
16.质量守恒定律的发现对化学的发展作出了巨大贡献。
(1)为验证质量守恒定律,小华设计如图1所示装置进行实验。
实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图1所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到______________,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是____________________________。
(2)某反应的微观示意图如图2所示。
①X的化学式是______________。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是______________________________________________________________________。
三、实验题
17.自然界的水含有各种杂质,可以用不同的方法进行净化。
(1)如图所示是用空塑料饮料瓶、带导管的单孔胶塞、蓬松棉、纱布、活性炭、小卵石、石英砂等材料自制的一个简易净水器。
①根据上述净化材料的特性,B层放置的材料最好是_____;
②该净水器第二层纱布的主要作用是将A层物质与B层物质_____;
③你认为上述简易净水器_____ (填“可以”或“不可以”)将硬水变成软水。
(2)下图为过滤装置,根据实验回答下列问题:
①写出标号仪器的名称:a_____,b_____;
②实验过程中玻璃棒的作用是_____;
③过滤后发现滤液仍然浑浊,可能的原因是(答出一点即可)_____。
18.某科学兴趣小组的同学设计了如下三个实验装置(天平略)来验证质量守恒定律。
(1)A﹣C三个实验装置,只有A装置能直接用于验证质量守恒定律,BC装置则不能,否定B、C装置的理由分别是___________、___________。
(2)小明受到A装置的启发,将c装置进行改进,如图D所示。
①此实验的现象是___________。
②待完全反应后,将装置D置于天平上称量,所得数据比反应前的小。若整个操作过程无差错,则造成上述实验误差的原因是___________。
四、计算题
19.小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表,(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)问:
序号 加入稀盐酸的质量/克 剩余固体质量/克
第一次 10 5.5
第二次 10 3.0
第三次 10 1.2
第四次 10 n
(1)样品中碳酸钙的质量分数是多少?
(2)上表中n的数值为 。
(3)求反应生成的氯化钙的质量。
20.某兴趣小组用73g溶质质量分数为20%的盐酸与足量锌粒反应,可制得氢气的质量是多少?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.A
3.C
4.D
5.D
6.D
7.A
8.C
9.C
10.A
11.D
12.D
13.(1) B 肥皂水 (2) 加热煮沸 C
14. (1) 2个氯原子 (2) 氢原子和氯原子
15.(1)Cu2+
(2)D
(3) 2:1
16. (1) 天平平衡 装置没有密闭,气体逸出 SO2 (2) 化学反应前后,原子质量、数目和种类不变
17. (1) 石英砂 隔离 不可以 (2) 铁架台 漏斗 (3) 引流液体 滤纸破损等
18.(1) B中发生的不是化学反应 C中的实验装置不密闭
(2) 有气泡产生,固体逐渐溶解,气球膨胀 气球膨胀后受到空气的浮力增大
19.(1)样品中碳酸钙的质量分数是85%;(2)1.2;(3) 设完全反应后最终生成氯化钙的质量为x,
x=7.548g;
答:反应生成的氯化钙的质量为7.548g。
20.0.4g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列方法可将海水转化为淡水的是( )
A.蒸馏 B.静置 C.过滤 D.消毒
2.2020年,“中国水周”活动的主题为“坚持节水优先,建设幸福河湖”。下列图标是我国“国家节水标志”的是
A. B. C. D.
3.根据现象,推断出B与A的相对分子质量相差( )
A.37.0 B.95.0 C.18.5 D.58.5
4.在一个密闭容器中放入P、Q、R、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识正确的是( )
物质 P Q R W
反应前的质量(g) 5 2 14 18
反应后的质量(g) 20 x 4 13
A.参加化学反应的P和W的质量比为3:2
B.该反应用现象表示为:
C.反应后容器中R与Q的质量比为1:2
D.Q在反应中可能作催化剂
5.石灰氮(化学式为CaCN2)是一种固态肥料,遇水发生反应的现象为CaCN2+3H2O=CaCO3+2X,则x化学式为
A.NO B.N2 C.CO2 D.NH3
6.下图是甲转化为丁的微观过程。下列说法正确的是
A.甲、丁为氧化物 B.丁中碳、氢、氧元素的质量比为2∶6∶1
C.转化①为化合反应 D.转化②中丙和H2O分子个数之比为1∶1
7.一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是
物质 甲 乙 丙 丁
反应前的质量/g 50 0.5 0 0
反应后的质量/g 23 X 24 3
A.X 的值等于 0
B.甲一定是化合物
C.丙和丁的质量变化比为 8:1
D.该反应是分解反应
8.甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如下:
下列说法正确的是
A.甲酸分子中氢、氧原子个数比为1:2
B.乙中碳、氧元素质量比为1:2
C.46g甲酸中氢元素质量为2g
D.生成甲与乙的分子个数比为2:1
9.“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是
A.甲醛(CH2O)
B.甲醇(CH4O)
C.乙醇(C2H6O)
D.乙酸(C2H4O2)
10.下列实验设计能达到目的的是
A.测定空气中氧气含量 B.细铁丝在氧气中燃烧
C.探究温度对分子运动快慢的影响 D.探究质量守恒定律
11.在一密闭容器中加入甲、乙、丙、丁四种物质,在下定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示。下列说法中不正确的是
A.该反应为化合反应
B.丙可能为该反应的催化剂
C.该反应中,乙、丁的质量变化之比为7∶5
D.该反应中,甲、乙的质量变化之比为1∶4
12.把一定质量的甲、乙、丙、丁四种物质放在密闭容器中,在一定条件下反应一段时间后,测得反应前后各物质的质量如下表所示,下列说法正确的是( )
物质 甲 乙 丙 丁
反应前的质量/g 5 9 16 3
反应后的质量/g x 20 1 7
A.反应中的乙和丁的质量比为3:1
B.物质丙可能是单质
C.该反应为化合反应
D.x=5
二、填空题
13.自来水厂净水过程示意图如图,请回答:
(1)可以除去水中溶解的一些杂质和异味的设备是_____(填字母);
A.过滤池 B.吸附池 C.清水池
(2)检验上述所获取的自来水是硬水还是软水,常用_____来区分,生活中可以通过_____降低水的硬度;
(3)我国有关部门规定,经上述过程净化后进入用户的饮用水含铁<0.3mg L﹣1,含铜<1.0mg。L﹣1.其中的“铁、铜”指的是_____(填字母)
A原子 B分子 C元素
14.下图是氢气在氯气中燃烧的微观示意图。据图作答:
(1)一个氯分子是由_______________构成的;在该化学反应前后,没有发生变化的微粒是____________(填微粒的名称)。
(2)该反应的现象是__________________________。
15.宏微结合,在宏观、微观和符号之间建立联系,是化学应培养的核心素养。请回答下列问题:
(1)硫酸铜溶液呈蓝色,是因为溶液中含有___________(填离子符号)。
(2)某兴趣小组在做硫酸铜固体溶于水的实验时,观察到如图现象。硫酸铜固体“消失”后液面比原水平线低的微观解释正确的是___________(填选项)
A.分子的体积很小 B.离子的体积很小 C.粒子的体积变小了 D.粒子之间有间隔
(3)下图是氢气在氧气中燃烧的微观模拟图,请回答下列问题:
①在B图中将相关粒子图形补充完整___________。
②此变化中参加反应的氢分子与氧分子的个数比是___________。
16.质量守恒定律的发现对化学的发展作出了巨大贡献。
(1)为验证质量守恒定律,小华设计如图1所示装置进行实验。
实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图1所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到______________,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是____________________________。
(2)某反应的微观示意图如图2所示。
①X的化学式是______________。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是______________________________________________________________________。
三、实验题
17.自然界的水含有各种杂质,可以用不同的方法进行净化。
(1)如图所示是用空塑料饮料瓶、带导管的单孔胶塞、蓬松棉、纱布、活性炭、小卵石、石英砂等材料自制的一个简易净水器。
①根据上述净化材料的特性,B层放置的材料最好是_____;
②该净水器第二层纱布的主要作用是将A层物质与B层物质_____;
③你认为上述简易净水器_____ (填“可以”或“不可以”)将硬水变成软水。
(2)下图为过滤装置,根据实验回答下列问题:
①写出标号仪器的名称:a_____,b_____;
②实验过程中玻璃棒的作用是_____;
③过滤后发现滤液仍然浑浊,可能的原因是(答出一点即可)_____。
18.某科学兴趣小组的同学设计了如下三个实验装置(天平略)来验证质量守恒定律。
(1)A﹣C三个实验装置,只有A装置能直接用于验证质量守恒定律,BC装置则不能,否定B、C装置的理由分别是___________、___________。
(2)小明受到A装置的启发,将c装置进行改进,如图D所示。
①此实验的现象是___________。
②待完全反应后,将装置D置于天平上称量,所得数据比反应前的小。若整个操作过程无差错,则造成上述实验误差的原因是___________。
四、计算题
19.小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表,(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)问:
序号 加入稀盐酸的质量/克 剩余固体质量/克
第一次 10 5.5
第二次 10 3.0
第三次 10 1.2
第四次 10 n
(1)样品中碳酸钙的质量分数是多少?
(2)上表中n的数值为 。
(3)求反应生成的氯化钙的质量。
20.某兴趣小组用73g溶质质量分数为20%的盐酸与足量锌粒反应,可制得氢气的质量是多少?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.A
3.C
4.D
5.D
6.D
7.A
8.C
9.C
10.A
11.D
12.D
13.(1) B 肥皂水 (2) 加热煮沸 C
14. (1) 2个氯原子 (2) 氢原子和氯原子
15.(1)Cu2+
(2)D
(3) 2:1
16. (1) 天平平衡 装置没有密闭,气体逸出 SO2 (2) 化学反应前后,原子质量、数目和种类不变
17. (1) 石英砂 隔离 不可以 (2) 铁架台 漏斗 (3) 引流液体 滤纸破损等
18.(1) B中发生的不是化学反应 C中的实验装置不密闭
(2) 有气泡产生,固体逐渐溶解,气球膨胀 气球膨胀后受到空气的浮力增大
19.(1)样品中碳酸钙的质量分数是85%;(2)1.2;(3) 设完全反应后最终生成氯化钙的质量为x,
x=7.548g;
答:反应生成的氯化钙的质量为7.548g。
20.0.4g。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
