氧化还原反应第一课时
图片预览








文档简介
课件24张PPT。第二章 化学物质及其分类第三节 氧化还原反应思考: 在初中阶段我们学习过氧化反应和还原反应,我们是怎样定义的?以氢气还原氧化铜为例:在这个反应中
氢气:得到氧,被氧化,发生氧化反应。
氧化铜:失去氧,被还原,发生还原反应。氢气称为还原剂。氧化铜称为氧化剂结论:在化学变化中
物质得到氧,被氧化,该物质发生的反应为氧化反应。
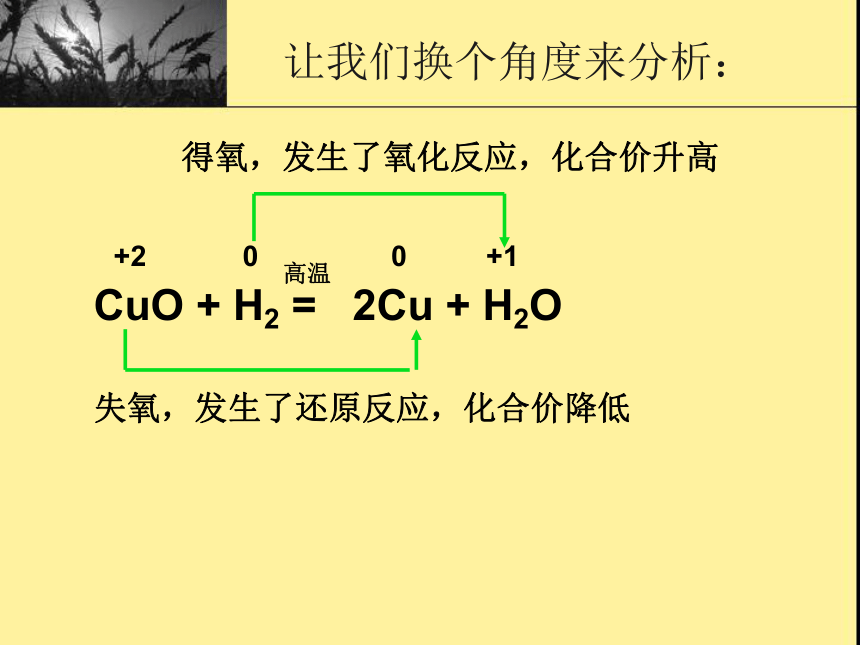
物质失去氧,被还原,该物质发生还原反应。整个反应称为氧化还原反应。练习: 根据结论判断下列反应中那些物质发生氧化反应,那些物质发生还原反应。CuO + H2 = 2Cu + H2O 失氧,发生了还原反应,化合价降低+20+1高温得氧,发生了氧化反应,化合价升高0让我们换个角度来分析:学以致用:00+1-1结论:
物质所含元素化合价升高的化学反应就叫氧化反应
物质所含元素化合价降低的化学反应就叫还原反应
氧化还原反应的特征:物质所含元素的化合价发生了变化。 凡是物质所含元素化合价发生变化的化学反
应就叫氧化还原反应。练习: 根据结论判断下列反应是否属于氧化还原反应:
HCl+AgNO3===AgCl +HNO3
2KI+Cl2====2KCl+I2
NH3+HCl===NH4Cl
Fe+CuSO4===FeSO4+Cu不是是不是是思考: 如何判断反应中氧化剂、还原剂、氧化产物、还原产物是什么呢?例:氧化剂还原剂还原产物氧化产物解答:氧化剂:所含元素化合价降低的反应物
还原剂:所含元素化合价升高的反应物
氧化产物:还原剂被氧化得到的生成物
还原产物:氧化剂被还原得到的生成物练习: 根据结论分析下列反应的氧化还原情况,并指出氧化剂、还原剂,氧化产物、还原产物。
2Fe+3Cl2===2FeCl3
Fe+2HCl===FeCl2+H2点燃
思考 在氧化还原反应中,元素化合价升降的原因是什么呢?结果:电子的得失引起了化合价的升降化合价升降的原因:电子的得失NaNa+ NaCl的形成过程:0 0 +1 -1HCl的形成过程:化合价升降的原因:共用电子对的偏移共用电子对偏向Cl,化合价降低0 0 +1 -1共用电子对偏离H,化合价升高,化合价升降的原因:电子的转移氧化还原
的实质小结:得失和偏移学会比较,学会总结1. 得氧和失氧的反应只是氧化还原反应中的一部份。2. 化合价发生改变是所有氧化还原反应的共同特征3. 电子转移是氧化还原反应的本质失电子(偏离)化合价升高被氧化得电子(偏向)化合价降低被还原(本质) ( 特征)(变化)升 失 氧 ;降 得 还⑴⑵ 0 0 +3 -1 0 +1 +2 0 0 +2 0 +1⑶⑷反应类型化合反应分解反应置换反应复分解反应1. 判断下列反应是否为氧化还原反应?随堂检测NaOH + HCl = NaCl + H2O2KClO3 = 2KCl+3O2 ↑+1+5 -2 +1 -1 0 氧化还原反应与四种基本反应类型的关系1、置换反应一定是氧化还原反应2、复分解反应一定不是氧化还原反应3、有单质参加的化合反应和有单质生产的
分解反应是氧化还原反应氧化还原反应非氧化还原反应概念辨析1.下列反应属于氧化还原反应的是( )
A.CuO+2HCl=CuCl2+H2O
B.2Na2O2+2H2O=4NaOH+O2
C.Zn+CuSO4=ZnSO4+Cu
D.Ca(OH)2+CO2=CaCO3 + H2O BC分层训练1:必做题2、下列四种基本类型的反应中,一定是氧化还原反应的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应C3、下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡是有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的转移(得失或偏移)
BDC1.某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化 B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是分层训练2:2.下列变化属于氧化反应的是( )
A.Fe2O3 Fe B.Zn ZnCl2
C.Na2CO3 CO2 D.Al Al2O3 BD
氢气:得到氧,被氧化,发生氧化反应。
氧化铜:失去氧,被还原,发生还原反应。氢气称为还原剂。氧化铜称为氧化剂结论:在化学变化中
物质得到氧,被氧化,该物质发生的反应为氧化反应。
物质失去氧,被还原,该物质发生还原反应。整个反应称为氧化还原反应。练习: 根据结论判断下列反应中那些物质发生氧化反应,那些物质发生还原反应。CuO + H2 = 2Cu + H2O 失氧,发生了还原反应,化合价降低+20+1高温得氧,发生了氧化反应,化合价升高0让我们换个角度来分析:学以致用:00+1-1结论:
物质所含元素化合价升高的化学反应就叫氧化反应
物质所含元素化合价降低的化学反应就叫还原反应
氧化还原反应的特征:物质所含元素的化合价发生了变化。 凡是物质所含元素化合价发生变化的化学反
应就叫氧化还原反应。练习: 根据结论判断下列反应是否属于氧化还原反应:
HCl+AgNO3===AgCl +HNO3
2KI+Cl2====2KCl+I2
NH3+HCl===NH4Cl
Fe+CuSO4===FeSO4+Cu不是是不是是思考: 如何判断反应中氧化剂、还原剂、氧化产物、还原产物是什么呢?例:氧化剂还原剂还原产物氧化产物解答:氧化剂:所含元素化合价降低的反应物
还原剂:所含元素化合价升高的反应物
氧化产物:还原剂被氧化得到的生成物
还原产物:氧化剂被还原得到的生成物练习: 根据结论分析下列反应的氧化还原情况,并指出氧化剂、还原剂,氧化产物、还原产物。
2Fe+3Cl2===2FeCl3
Fe+2HCl===FeCl2+H2点燃
思考 在氧化还原反应中,元素化合价升降的原因是什么呢?结果:电子的得失引起了化合价的升降化合价升降的原因:电子的得失NaNa+ NaCl的形成过程:0 0 +1 -1HCl的形成过程:化合价升降的原因:共用电子对的偏移共用电子对偏向Cl,化合价降低0 0 +1 -1共用电子对偏离H,化合价升高,化合价升降的原因:电子的转移氧化还原
的实质小结:得失和偏移学会比较,学会总结1. 得氧和失氧的反应只是氧化还原反应中的一部份。2. 化合价发生改变是所有氧化还原反应的共同特征3. 电子转移是氧化还原反应的本质失电子(偏离)化合价升高被氧化得电子(偏向)化合价降低被还原(本质) ( 特征)(变化)升 失 氧 ;降 得 还⑴⑵ 0 0 +3 -1 0 +1 +2 0 0 +2 0 +1⑶⑷反应类型化合反应分解反应置换反应复分解反应1. 判断下列反应是否为氧化还原反应?随堂检测NaOH + HCl = NaCl + H2O2KClO3 = 2KCl+3O2 ↑+1+5 -2 +1 -1 0 氧化还原反应与四种基本反应类型的关系1、置换反应一定是氧化还原反应2、复分解反应一定不是氧化还原反应3、有单质参加的化合反应和有单质生产的
分解反应是氧化还原反应氧化还原反应非氧化还原反应概念辨析1.下列反应属于氧化还原反应的是( )
A.CuO+2HCl=CuCl2+H2O
B.2Na2O2+2H2O=4NaOH+O2
C.Zn+CuSO4=ZnSO4+Cu
D.Ca(OH)2+CO2=CaCO3 + H2O BC分层训练1:必做题2、下列四种基本类型的反应中,一定是氧化还原反应的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应C3、下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡是有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的转移(得失或偏移)
BDC1.某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化 B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是分层训练2:2.下列变化属于氧化反应的是( )
A.Fe2O3 Fe B.Zn ZnCl2
C.Na2CO3 CO2 D.Al Al2O3 BD
