人教版九年级化学 第三单元 物质构成的奥秘 复习课件(共32张PPT)
文档属性
| 名称 | 人教版九年级化学 第三单元 物质构成的奥秘 复习课件(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 789.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-05 06:29:49 | ||
图片预览











文档简介
(共32张PPT)
单元复习
第三单元复习
目录
01
思维导图
03
重点突破
02
易错点透析
思维导图
易错点透析
易错点1
不明确原子结构中各粒子之间的关系
原子是由原子核和核外电子构成的,原子核是由质子和中子构成的(氢原子无中子)。在原子中:核电荷数=质子数=核外电子数。不是所有的原子中都有中子。
【例1】下列关于原子结构的说法,错误的是( )
A. 原子核中一定有质子,不一定有中子
B. 在原子中,核电荷数一定等于质子数或核外电子数
C. 原子的质量约等于原子核内质子与中子的质量之和
D. 任何原子核中的质子数都等于中子数
易错提醒:氢原子无中子;在同一原子中,核电荷数=质子数=核外电子数,但不一定等于中子数。
正解:A. 原子核一般由带正电的质子和不带电的中子构成,但是有一些原子的原子核中只有质子而没有中子,如氢原子核中没有中子,故A正确;B. 原子中,核电荷数=质子数=核外电子数,故B正确;C. 跟质子、中子相比,电子质量很小,所以原子的质量主要集中在原子核上,因此原子的质量约等于原子核内质子与中子的质量之和,故C正确;D. 原子中的质子数不一定等于中子数,例如钠原子核中含有11个质子,12个中子,质子数和中子数不相等,所以并不是所有原子核中的质子数都等于中子数,故D错误。
答案:D
学以致用
1. 下列说法正确的是( )
A. 原子核是实心球体
B. 原子不带电是因为质子数和中子数相等
C. 原子的质量主要集中在原子核上
D. 原子都是由质子和中子构成的
C
易错点2
对分子、原子、离子与元素的有关描述理解不到位
分子是保持物质(由分子构成)化学性质的最小粒子。原子是化学变化中最小的粒子,在化学变化中分子可分而原子不可分。离子是原子得失电子后形成的带电的粒子;而元素是组成物质的基本成分,元素是质子数(或核电荷数)相同的一类原子的总称。
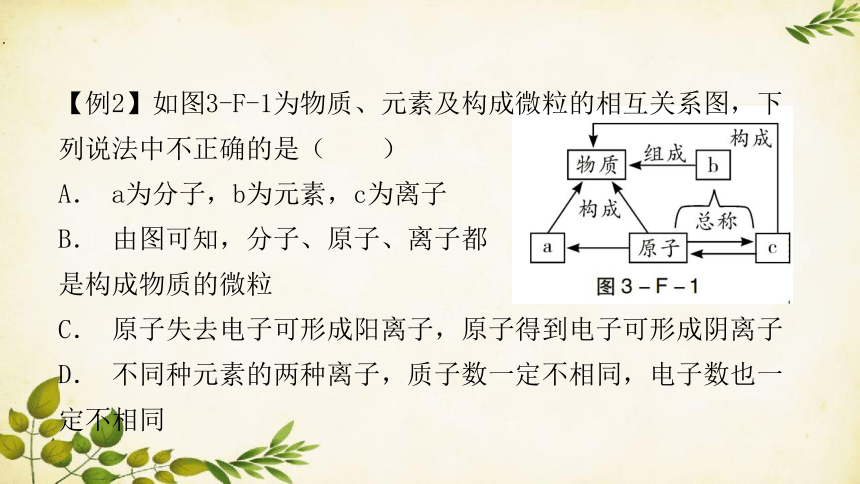
【例2】如图3-F-1为物质、元素及构成微粒的相互关系图,下列说法中不正确的是( )
A. a为分子,b为元素,c为离子
B. 由图可知,分子、原子、离子都
是构成物质的微粒
C. 原子失去电子可形成阳离子,原子得到电子可形成阴离子
D. 不同种元素的两种离子,质子数一定不相同,电子数也一定不相同
易错提醒:元素是质子数(或核电荷数)相同的一类原子的总称,不同元素,质子数一定不同;离子是原子得失电子而形成的,不同元素的离子,其核外电子数也可以相等。
正解:A.分子、原子、离子是构成的物质的三种基本粒子,物质是由元素组成的,分子是由原子构成的,原子得失电子形成离子,离子得失电子可以形成原子,所以a为分子,b为元素,c为离子;B.分子、原子、离子是构成的物质的三种基本粒子;C.原子失去电子可形成阳离子,原子得到电子可形成阴离子;D.不同的离子,其核外电子数可能相同,如钠离子和氟离子核外电子数都是10。
答案:D
学以致用
2. 下列有关分子、原子、离子、元素的说法中,正确的是( )
A. 原子都是由质子、中子、核外电子构成的
B. 同种元素的原子核内质子数和中子数一定相等
C. 同种原子可能构成不同分子
D. 保持过氧化氢的化学性质的最小粒子是氢原子和氧原子
C
易错点3
误认为分子与原子的区别是:分子大,原子小
分子和原子都可以直接构成物质。不同的分子、原子大小不一,不能比较大小。
【例3】分子与原子的本质区别是( )
A. 分子运动速率快,原子运动速率慢
B. 分子体积大,原子体积小
C. 在化学变化中,分子可再分而原子不可再分
D. 分子可以构成物质而原子不可以直接构成物质
易错提醒:分子是由原子构成的,但不能错认为分子大、原子小。
正解:A. 分子和原子的运动速率不能比较;B. 不同的分子、原子大小不一,不同分子原子之间无法比较体积大小,但由原子构成的分子,其体积比构成它的原子大,故B错误;C. 在化学变化中分子分成原子,原子再重新组合成新的分子,故在化学变化中,分子可分,原子不可分,故C正确;D. 物质可以由分子、原子、离子构成,故D错误。
答案:C
学以致用
3. 下列关于分子和原子两种微粒的叙述,不正确的是( )
A. 分子是由原子构成的,所以分子大原子小
B. 分子和原子都在不断地运动
C. 分子的质量不一定大于原子的质量
D. 分子和原子都能构成物质
A
易错点4
不明确离子的写法及含义
离子写法是在元素符号右上角先写电荷数后写电性符号;原子得电子带负电,原子失电子带正电;离子的含义及表示方法是本单元的一大难点,其写法可表示为“Xa+”或“Yb-”;其含义为一个X(或Y)离子带a(或b)个单位正(或负)电荷。
【例4】离子符号写法及意义。
(1)写出化学符号。
碳酸根离子:___________________
氢离子:___________________
2个亚铁离子:___________________
5个钙离子:___________________
(2)下列符号表示的意义。
NO3-:_____ 7Fe3+:_____ 2H+:_____
(3)指出下列符号中数字2的意义。
Fe2+:___________________ nCO2:___________________
2Cl-:___________________ 5SO42-:___________________
易错提醒:亚铁离子是带2个单位正电荷的,铁离子是带3个单位正电荷的。
正解:(1)直接写出化学符号,有多少个微粒就在化学符号前写上数字。(2)化学符号前的数字表示微粒个数。(3)数字在化学符号右上角的表示所带电荷数,右下角的表示原子个数,前面的表示粒子个数。
答案:(1)CO32- H+ 2Fe2+ 5Ca2+(2)硝酸根离子7个铁离子2个氢离子
(3)1个亚铁离子带2个正电荷1个二氧化碳分子中含有2个氧原子氯离子的个数为21个硫酸根离子带2个负电荷
学以致用
4. 请用化学用语或文字填空。
(1)2个氢氧根离子:______________________
(2)铵根离子:______________________
(3)2N2:______________________
(4)FeCl2:______________________
(5)SO2中“2”的含义:________________________________
2OH-
NH4+
2个氮气分子
氯化亚铁
1个二氧化硫分子中含有2个氧原子
重点突破
重点1 用微粒的性质解释常见现象
1. (化学生活)妈妈烘焙蛋糕时散发出阵阵香味,说明分子具有的性质是( )
A. 分子的体积很小 B. 分子的间隔很小
C. 分子在不断地运动 D. 分子可以再分
C
2. 建立宏观与微观的联系是化学独特的思维方式。对于宏观现象的微观解释中错误的是( )
A. 变瘪的乒乓球放入热水中能鼓起来,是因为分子受热膨胀变大
B. 氧气加压后变成液氧,是因为分子间的间隔变小
C. 夏天湿衣服晾干快,温度越高,分子运动速率越快
D. 非吸烟者受到被动吸烟的危害,是因为分子在不断地运动
A
重点2 分子、原子、离子
3. 能保持氧气化学性质的微粒是( )
A. 氧元素 B. 氧原子 C. 氧离子 D. 氧分子
4. 溶液能导电是因为存在大量自由移动的带电荷微粒,这些微粒是( )
A. 原子 B. 离子 C. 分子 D. 中子
D
B
5. 化学变化从微观上讲是原子的重新组合,原子间结合的原子个数比的主要决定因素是( )
A. 质子数 B. 电子数
C. 最外层电子数 D. 原子核
C
重点3 原子的构成及原子核外电子的排布
6. 图3-F-2是两种粒子结构示意图,从图中获得的信息不正确的是( )
A. a和b的核外电子层数不同
B. b易得到6个电子形成稳定结构
C. b表示原子
D. a表示阴离子
B
7. 某粒子的结构示意图为 请回答下列问题。
(1)若m=11,则该粒子所对应元素的符号为__________。
(2)若该粒子带两个单位负电荷,且n=8,则该粒子的符号为__________。
(3)若m=20,n=8,则该粒子的符号为__________。
Na
S2-
Ca2+
重点4 用微粒的观点解释物质的分类及化学变化的本质
8. 如图3-F-3所示,“ ”“ ”和“ ”分别表示不同元素的原子。则图中表示混合物的是__________(填字母,下同),表示纯净物的是__________。
B
AC
9. (模型构建)“宏观——微观——符号”之间建立联系,能帮助我们更好地认识物质的本质。浓度为75%的酒精常用作防疫消毒液,其有效成分是乙醇(C2H5OH),如图3-F-4所示是工业上在一定条件下制取乙醇的微观示意图。
(1)化学变化的实质是_________________________________,该化学反应中,保持不变的是__________(填“分子”或“原子”),该反应属于__________(填基本反应类型)。
分子分为原子,原子组合成新的分子
原子
化合
(2)从图中可以看出,乙醇是由3种元素组成的,一个乙醇分子中含有_______个碳原子,_______个氧原子和_______个氢原子。
2
1
6
10. 图3-F-5中A是钛元素在元素周期表中的信息,B、C分别为两种粒子的结构示意图,D为元素周期表中的部分信息,请根据图中信息回答下列问题。
(1)钛元素的质子数为__________,相对原子质量为__________。
(2)B表示的原子的核外电子数是__________,位于D图中的__________(填序号)处。若C表示K+,则m=__________。
22
47.87
6
②
19
重点5 元素、元素周期表及微粒结构示意图
(3)元素在周期表中的分布是有规律的,同一周期元素的原子_______________相同。D中②的原子序数______(填“大于”或“小于”)③的原子序数。⑤所代表的元素属于___________(填“金属”或“非金属”)元素。
(4)核磁共振(NMR)技术已广泛应用于医学领域。若只有质子数为奇数的原子会产生NMR现象,则D中①~⑥元素的原子能产生NMR现象的有______________(填元素符号)。
核外电子层数
小于
非金属
H、N、P
谢 谢
单元复习
第三单元复习
目录
01
思维导图
03
重点突破
02
易错点透析
思维导图
易错点透析
易错点1
不明确原子结构中各粒子之间的关系
原子是由原子核和核外电子构成的,原子核是由质子和中子构成的(氢原子无中子)。在原子中:核电荷数=质子数=核外电子数。不是所有的原子中都有中子。
【例1】下列关于原子结构的说法,错误的是( )
A. 原子核中一定有质子,不一定有中子
B. 在原子中,核电荷数一定等于质子数或核外电子数
C. 原子的质量约等于原子核内质子与中子的质量之和
D. 任何原子核中的质子数都等于中子数
易错提醒:氢原子无中子;在同一原子中,核电荷数=质子数=核外电子数,但不一定等于中子数。
正解:A. 原子核一般由带正电的质子和不带电的中子构成,但是有一些原子的原子核中只有质子而没有中子,如氢原子核中没有中子,故A正确;B. 原子中,核电荷数=质子数=核外电子数,故B正确;C. 跟质子、中子相比,电子质量很小,所以原子的质量主要集中在原子核上,因此原子的质量约等于原子核内质子与中子的质量之和,故C正确;D. 原子中的质子数不一定等于中子数,例如钠原子核中含有11个质子,12个中子,质子数和中子数不相等,所以并不是所有原子核中的质子数都等于中子数,故D错误。
答案:D
学以致用
1. 下列说法正确的是( )
A. 原子核是实心球体
B. 原子不带电是因为质子数和中子数相等
C. 原子的质量主要集中在原子核上
D. 原子都是由质子和中子构成的
C
易错点2
对分子、原子、离子与元素的有关描述理解不到位
分子是保持物质(由分子构成)化学性质的最小粒子。原子是化学变化中最小的粒子,在化学变化中分子可分而原子不可分。离子是原子得失电子后形成的带电的粒子;而元素是组成物质的基本成分,元素是质子数(或核电荷数)相同的一类原子的总称。
【例2】如图3-F-1为物质、元素及构成微粒的相互关系图,下列说法中不正确的是( )
A. a为分子,b为元素,c为离子
B. 由图可知,分子、原子、离子都
是构成物质的微粒
C. 原子失去电子可形成阳离子,原子得到电子可形成阴离子
D. 不同种元素的两种离子,质子数一定不相同,电子数也一定不相同
易错提醒:元素是质子数(或核电荷数)相同的一类原子的总称,不同元素,质子数一定不同;离子是原子得失电子而形成的,不同元素的离子,其核外电子数也可以相等。
正解:A.分子、原子、离子是构成的物质的三种基本粒子,物质是由元素组成的,分子是由原子构成的,原子得失电子形成离子,离子得失电子可以形成原子,所以a为分子,b为元素,c为离子;B.分子、原子、离子是构成的物质的三种基本粒子;C.原子失去电子可形成阳离子,原子得到电子可形成阴离子;D.不同的离子,其核外电子数可能相同,如钠离子和氟离子核外电子数都是10。
答案:D
学以致用
2. 下列有关分子、原子、离子、元素的说法中,正确的是( )
A. 原子都是由质子、中子、核外电子构成的
B. 同种元素的原子核内质子数和中子数一定相等
C. 同种原子可能构成不同分子
D. 保持过氧化氢的化学性质的最小粒子是氢原子和氧原子
C
易错点3
误认为分子与原子的区别是:分子大,原子小
分子和原子都可以直接构成物质。不同的分子、原子大小不一,不能比较大小。
【例3】分子与原子的本质区别是( )
A. 分子运动速率快,原子运动速率慢
B. 分子体积大,原子体积小
C. 在化学变化中,分子可再分而原子不可再分
D. 分子可以构成物质而原子不可以直接构成物质
易错提醒:分子是由原子构成的,但不能错认为分子大、原子小。
正解:A. 分子和原子的运动速率不能比较;B. 不同的分子、原子大小不一,不同分子原子之间无法比较体积大小,但由原子构成的分子,其体积比构成它的原子大,故B错误;C. 在化学变化中分子分成原子,原子再重新组合成新的分子,故在化学变化中,分子可分,原子不可分,故C正确;D. 物质可以由分子、原子、离子构成,故D错误。
答案:C
学以致用
3. 下列关于分子和原子两种微粒的叙述,不正确的是( )
A. 分子是由原子构成的,所以分子大原子小
B. 分子和原子都在不断地运动
C. 分子的质量不一定大于原子的质量
D. 分子和原子都能构成物质
A
易错点4
不明确离子的写法及含义
离子写法是在元素符号右上角先写电荷数后写电性符号;原子得电子带负电,原子失电子带正电;离子的含义及表示方法是本单元的一大难点,其写法可表示为“Xa+”或“Yb-”;其含义为一个X(或Y)离子带a(或b)个单位正(或负)电荷。
【例4】离子符号写法及意义。
(1)写出化学符号。
碳酸根离子:___________________
氢离子:___________________
2个亚铁离子:___________________
5个钙离子:___________________
(2)下列符号表示的意义。
NO3-:_____ 7Fe3+:_____ 2H+:_____
(3)指出下列符号中数字2的意义。
Fe2+:___________________ nCO2:___________________
2Cl-:___________________ 5SO42-:___________________
易错提醒:亚铁离子是带2个单位正电荷的,铁离子是带3个单位正电荷的。
正解:(1)直接写出化学符号,有多少个微粒就在化学符号前写上数字。(2)化学符号前的数字表示微粒个数。(3)数字在化学符号右上角的表示所带电荷数,右下角的表示原子个数,前面的表示粒子个数。
答案:(1)CO32- H+ 2Fe2+ 5Ca2+(2)硝酸根离子7个铁离子2个氢离子
(3)1个亚铁离子带2个正电荷1个二氧化碳分子中含有2个氧原子氯离子的个数为21个硫酸根离子带2个负电荷
学以致用
4. 请用化学用语或文字填空。
(1)2个氢氧根离子:______________________
(2)铵根离子:______________________
(3)2N2:______________________
(4)FeCl2:______________________
(5)SO2中“2”的含义:________________________________
2OH-
NH4+
2个氮气分子
氯化亚铁
1个二氧化硫分子中含有2个氧原子
重点突破
重点1 用微粒的性质解释常见现象
1. (化学生活)妈妈烘焙蛋糕时散发出阵阵香味,说明分子具有的性质是( )
A. 分子的体积很小 B. 分子的间隔很小
C. 分子在不断地运动 D. 分子可以再分
C
2. 建立宏观与微观的联系是化学独特的思维方式。对于宏观现象的微观解释中错误的是( )
A. 变瘪的乒乓球放入热水中能鼓起来,是因为分子受热膨胀变大
B. 氧气加压后变成液氧,是因为分子间的间隔变小
C. 夏天湿衣服晾干快,温度越高,分子运动速率越快
D. 非吸烟者受到被动吸烟的危害,是因为分子在不断地运动
A
重点2 分子、原子、离子
3. 能保持氧气化学性质的微粒是( )
A. 氧元素 B. 氧原子 C. 氧离子 D. 氧分子
4. 溶液能导电是因为存在大量自由移动的带电荷微粒,这些微粒是( )
A. 原子 B. 离子 C. 分子 D. 中子
D
B
5. 化学变化从微观上讲是原子的重新组合,原子间结合的原子个数比的主要决定因素是( )
A. 质子数 B. 电子数
C. 最外层电子数 D. 原子核
C
重点3 原子的构成及原子核外电子的排布
6. 图3-F-2是两种粒子结构示意图,从图中获得的信息不正确的是( )
A. a和b的核外电子层数不同
B. b易得到6个电子形成稳定结构
C. b表示原子
D. a表示阴离子
B
7. 某粒子的结构示意图为 请回答下列问题。
(1)若m=11,则该粒子所对应元素的符号为__________。
(2)若该粒子带两个单位负电荷,且n=8,则该粒子的符号为__________。
(3)若m=20,n=8,则该粒子的符号为__________。
Na
S2-
Ca2+
重点4 用微粒的观点解释物质的分类及化学变化的本质
8. 如图3-F-3所示,“ ”“ ”和“ ”分别表示不同元素的原子。则图中表示混合物的是__________(填字母,下同),表示纯净物的是__________。
B
AC
9. (模型构建)“宏观——微观——符号”之间建立联系,能帮助我们更好地认识物质的本质。浓度为75%的酒精常用作防疫消毒液,其有效成分是乙醇(C2H5OH),如图3-F-4所示是工业上在一定条件下制取乙醇的微观示意图。
(1)化学变化的实质是_________________________________,该化学反应中,保持不变的是__________(填“分子”或“原子”),该反应属于__________(填基本反应类型)。
分子分为原子,原子组合成新的分子
原子
化合
(2)从图中可以看出,乙醇是由3种元素组成的,一个乙醇分子中含有_______个碳原子,_______个氧原子和_______个氢原子。
2
1
6
10. 图3-F-5中A是钛元素在元素周期表中的信息,B、C分别为两种粒子的结构示意图,D为元素周期表中的部分信息,请根据图中信息回答下列问题。
(1)钛元素的质子数为__________,相对原子质量为__________。
(2)B表示的原子的核外电子数是__________,位于D图中的__________(填序号)处。若C表示K+,则m=__________。
22
47.87
6
②
19
重点5 元素、元素周期表及微粒结构示意图
(3)元素在周期表中的分布是有规律的,同一周期元素的原子_______________相同。D中②的原子序数______(填“大于”或“小于”)③的原子序数。⑤所代表的元素属于___________(填“金属”或“非金属”)元素。
(4)核磁共振(NMR)技术已广泛应用于医学领域。若只有质子数为奇数的原子会产生NMR现象,则D中①~⑥元素的原子能产生NMR现象的有______________(填元素符号)。
核外电子层数
小于
非金属
H、N、P
谢 谢
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
