化学人教版(2019)必修第一册1.3.1 氧化还原反应的特征和本质(共16张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.1 氧化还原反应的特征和本质(共16张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 444.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-05 00:00:00 | ||
图片预览


文档简介
(共16张PPT)
学
习
目
标
重
点
难
点
1.3.1 氧化还原反应的特征和本质
1.通过对氧化还原反应概念的发展史料的了解,从得氧失氧、化合价变化和电子转移等多角度认识并判断氧化还原反应;
2.能从宏观和微观相结合的角度理解氧化还原反应与四种基本反应类型的关系;
氧化还原反应的相关概念及其联系
1、根据法国化学家拉瓦锡的燃烧的氧化学说
氧化反应
还原反应
物质与氧结合的反应
氧化物失去氧的反应
Fe2O3 + 3CO 2Fe + 3CO2
一、氧化还原反应的概念的发展
2CuO + C 2Cu + CO2↑
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
一种物质得氧发生氧化反应,必然有另一种物质失氧发生还原反应。氧化反应和还原反应在一个反应中同时发生,这样的反应称氧化还原反应
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
氧化反应
还原反应
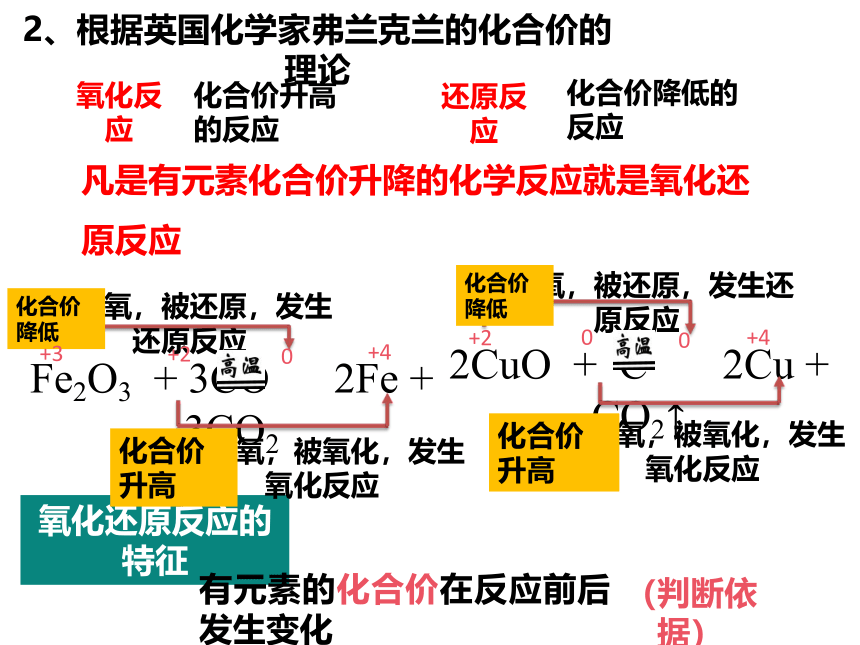
化合价升高的反应
化合价降低的反应
凡是有元素化合价升降的化学反应就是氧化还原反应
氧化还原反应的特征
有元素的化合价在反应前后发生变化
(判断依据)
2、根据英国化学家弗兰克兰的化合价的理论
Fe2O3 + 3CO 2Fe + 3CO2
2CuO + C 2Cu + CO2↑
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
化合价降低
化合价升高
+3
+2
0
+4
+2
0
0
+4
化合价降低
化合价升高
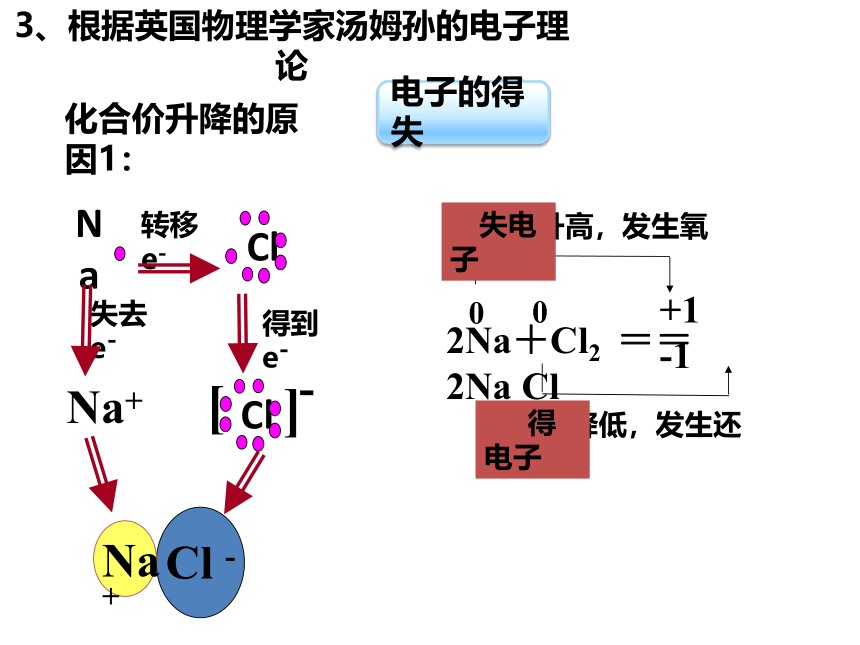
2Na+Cl2 == 2Na Cl
0
+1 -1
化合价升高,发生氧化反应
化合价降低,发生还原反应
Na
转移e-
失去e-
得到e-
Na+
Cl -
Na+
0
化合价升降的原因1:
Cl
]
[
-
Cl
3、根据英国物理学家汤姆孙的电子理论
电子的得失
失电子
得电子
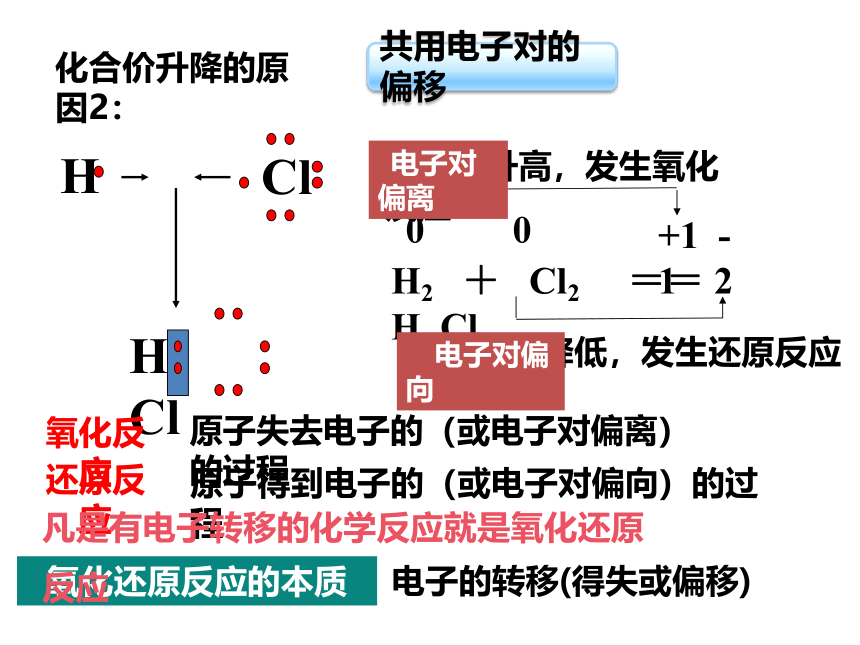
H2 + Cl2 == 2 H Cl
0
0
+1 -1
化合价升高,发生氧化反应
化合价降低,发生还原反应
化合价升降的原因2:
电子的转移(得失或偏移)
氧化还原反应的本质
H
H Cl
Cl
共用电子对的偏移
氧化反应
还原反应
原子失去电子的(或电子对偏离)的过程
原子得到电子的(或电子对偏向)的过程
凡是有电子转移的化学反应就是氧化还原反应
电子对偏向
电子对偏离
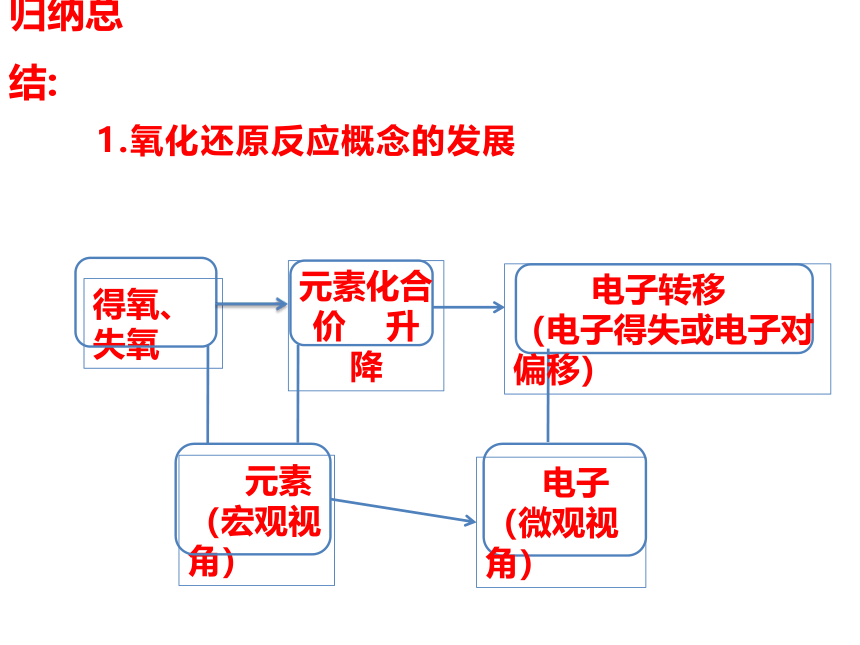
得氧、失氧
元素化合价 升降
电子转移
(电子得失或电子对偏移)
元素
(宏观视角)
电子
(微观视角)
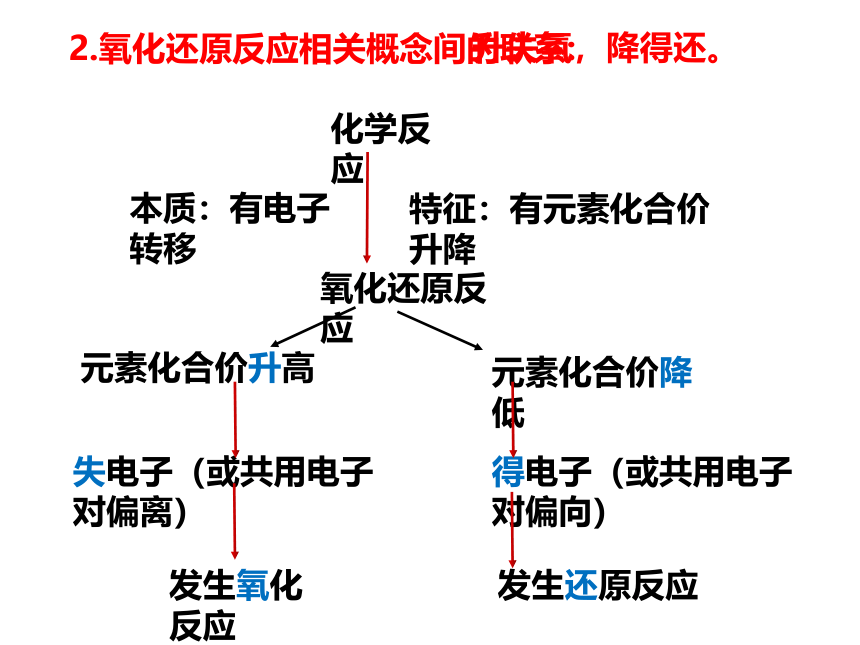
1.氧化还原反应概念的发展
归纳总结:
特征:有元素化合价升降
化学反应
氧化还原反应
本质:有电子转移
元素化合价升高
失电子(或共用电子对偏离)
元素化合价降低
得电子(或共用电子对偏向)
发生氧化反应
发生还原反应
2.氧化还原反应相关概念间的联系:
升失氧,降得还。
CuO、Fe2O3
C、CO
还原反应
氧化反应
2CuO + C = 2 Cu + CO2
高温
Fe2O3 + 3CO = 2Fe + 3CO2
高温
+2
0
0
+4
化合价降低,发生还原反应
化合价升高,发生氧化反应
+3
0
+2
+4
化合价降低,发生还原反应
化合价升高,发生氧化反应
课堂练习1.完成课本P22的[思考与讨论]
一价钾钠氯氢银( K Na Cl H Ag )
二价氧钙钡镁锌 ( O Ca Ba Mg Zn )
三铝四硅五氮磷 ( Al Si N P )
二三铁 二四碳( Fe C)
铜汞二价最常见 ( Cu Hg )
氢氧负一铵正一( OH- NH4+ )
酸根为负要记住
一硝二硫碳三磷 ( NO3- SO42- CO32- PO43- )
①在单质中,元素的化合价为零。
②在化合物中,正负化合价的代数和为零。
③通常H:+1, O:-2,金属元素显正价。
化合价之歌
知识补给站:
(1)H2O 、 H2O2 氧元素化合价分别为_______、_______
(2)NaH、NH3氢元素化合价分别为________、_______
(3)HCl、KClO3、ClO2中氯元素化合价分别为______、____、______
(4)MnO2、KMnO4中锰元素化合价分别为_______、_______
(5)Fe3O4中铁元素化合价为______
-2
-1
-1
+1
-1
+5
+4
+4
+7
+2、+3
课堂练习2.标出下列物质中指定元素的化合价:
注意事项:
(1)氧在过氧化物中(例:H2O2 、Na2O2 )显-1价。
(2)氢在金属氢化物中(例:NaH 、CaH2)显-1价。
(3)像Cl、N、S、Mn等具有可变价态的元素,根据化合物中各元素化合价代数和为0进行求算。
Cu+Cl2 === CuCl2
△
CaO + H2O === Ca(OH) 2
Fe+CuSO4 == Cu+FeSO4
课堂练习3.判断下列哪些是氧化还原反应?属于哪种基本反应类型?
CaCO3===CaO+CO2 ↑
高温
2KClO3===2KCl+3O2 ↑
△
NaOH+HCl==NaCl+H2O
化合反应
分解反应
置换反应
复分解反应
问题探究1:氧化还原反应与四种基本类型反应有什么联系 ?
√
×
×
√
√
×
置换反应
复分解反应
化合反应
分解反应
化学反应
氧化还原反应
非氧化还原反应
有元素化合价变化
无元素化合价变化
注意:
(1)有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
(2)有单质参加或生成的反应不一定是氧化还原反应。例如3O2=2O3
3.氧化还原反应与四种基本类型反应的联系:
问题探究2:请用树状分类法对化学反应分类
化学反应
根据反应物和生成物的类别以及反应前后物质的种类的多少
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
根据化合价升降
非氧化还原反应
1.下列反应属于氧化还原反应的是( ) A.CaCO3+2HCl=CaCl2+H2O+CO2↑
B.CaCO3=CaO+CO2↑
C.Na2O+H2O=2NaOH
D.Mg+2HCl = MgCl2+H2↑
高温
D
【课堂检测】
2.氧化还原反应的实质是( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或共用电子对的偏移
D.氧原子的得失
3.下列四种基本类型的反应中,一定是氧化还原反应的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
C
C
4.在Fe2O3+3CO = 2Fe+3CO2反应中,Fe元素化合价______,_______电子, 被________,发生________。C元素化合价_______,______电子,被________,发生_______。
降低
氧化
还原
升高
得到
失去
还原反应
氧化反应
高温
5、在黑火药的爆炸反应 2KNO3+S+3C==K2S+N2↑+3CO2↑中,
化合价升高的元素是 ,得电子的原子是 ,被还原的元素是 ,发生氧化反应的物质是 。
C
N、S
N、S
C
学
习
目
标
重
点
难
点
1.3.1 氧化还原反应的特征和本质
1.通过对氧化还原反应概念的发展史料的了解,从得氧失氧、化合价变化和电子转移等多角度认识并判断氧化还原反应;
2.能从宏观和微观相结合的角度理解氧化还原反应与四种基本反应类型的关系;
氧化还原反应的相关概念及其联系
1、根据法国化学家拉瓦锡的燃烧的氧化学说
氧化反应
还原反应
物质与氧结合的反应
氧化物失去氧的反应
Fe2O3 + 3CO 2Fe + 3CO2
一、氧化还原反应的概念的发展
2CuO + C 2Cu + CO2↑
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
一种物质得氧发生氧化反应,必然有另一种物质失氧发生还原反应。氧化反应和还原反应在一个反应中同时发生,这样的反应称氧化还原反应
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
氧化反应
还原反应
化合价升高的反应
化合价降低的反应
凡是有元素化合价升降的化学反应就是氧化还原反应
氧化还原反应的特征
有元素的化合价在反应前后发生变化
(判断依据)
2、根据英国化学家弗兰克兰的化合价的理论
Fe2O3 + 3CO 2Fe + 3CO2
2CuO + C 2Cu + CO2↑
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
化合价降低
化合价升高
+3
+2
0
+4
+2
0
0
+4
化合价降低
化合价升高
2Na+Cl2 == 2Na Cl
0
+1 -1
化合价升高,发生氧化反应
化合价降低,发生还原反应
Na
转移e-
失去e-
得到e-
Na+
Cl -
Na+
0
化合价升降的原因1:
Cl
]
[
-
Cl
3、根据英国物理学家汤姆孙的电子理论
电子的得失
失电子
得电子
H2 + Cl2 == 2 H Cl
0
0
+1 -1
化合价升高,发生氧化反应
化合价降低,发生还原反应
化合价升降的原因2:
电子的转移(得失或偏移)
氧化还原反应的本质
H
H Cl
Cl
共用电子对的偏移
氧化反应
还原反应
原子失去电子的(或电子对偏离)的过程
原子得到电子的(或电子对偏向)的过程
凡是有电子转移的化学反应就是氧化还原反应
电子对偏向
电子对偏离
得氧、失氧
元素化合价 升降
电子转移
(电子得失或电子对偏移)
元素
(宏观视角)
电子
(微观视角)
1.氧化还原反应概念的发展
归纳总结:
特征:有元素化合价升降
化学反应
氧化还原反应
本质:有电子转移
元素化合价升高
失电子(或共用电子对偏离)
元素化合价降低
得电子(或共用电子对偏向)
发生氧化反应
发生还原反应
2.氧化还原反应相关概念间的联系:
升失氧,降得还。
CuO、Fe2O3
C、CO
还原反应
氧化反应
2CuO + C = 2 Cu + CO2
高温
Fe2O3 + 3CO = 2Fe + 3CO2
高温
+2
0
0
+4
化合价降低,发生还原反应
化合价升高,发生氧化反应
+3
0
+2
+4
化合价降低,发生还原反应
化合价升高,发生氧化反应
课堂练习1.完成课本P22的[思考与讨论]
一价钾钠氯氢银( K Na Cl H Ag )
二价氧钙钡镁锌 ( O Ca Ba Mg Zn )
三铝四硅五氮磷 ( Al Si N P )
二三铁 二四碳( Fe C)
铜汞二价最常见 ( Cu Hg )
氢氧负一铵正一( OH- NH4+ )
酸根为负要记住
一硝二硫碳三磷 ( NO3- SO42- CO32- PO43- )
①在单质中,元素的化合价为零。
②在化合物中,正负化合价的代数和为零。
③通常H:+1, O:-2,金属元素显正价。
化合价之歌
知识补给站:
(1)H2O 、 H2O2 氧元素化合价分别为_______、_______
(2)NaH、NH3氢元素化合价分别为________、_______
(3)HCl、KClO3、ClO2中氯元素化合价分别为______、____、______
(4)MnO2、KMnO4中锰元素化合价分别为_______、_______
(5)Fe3O4中铁元素化合价为______
-2
-1
-1
+1
-1
+5
+4
+4
+7
+2、+3
课堂练习2.标出下列物质中指定元素的化合价:
注意事项:
(1)氧在过氧化物中(例:H2O2 、Na2O2 )显-1价。
(2)氢在金属氢化物中(例:NaH 、CaH2)显-1价。
(3)像Cl、N、S、Mn等具有可变价态的元素,根据化合物中各元素化合价代数和为0进行求算。
Cu+Cl2 === CuCl2
△
CaO + H2O === Ca(OH) 2
Fe+CuSO4 == Cu+FeSO4
课堂练习3.判断下列哪些是氧化还原反应?属于哪种基本反应类型?
CaCO3===CaO+CO2 ↑
高温
2KClO3===2KCl+3O2 ↑
△
NaOH+HCl==NaCl+H2O
化合反应
分解反应
置换反应
复分解反应
问题探究1:氧化还原反应与四种基本类型反应有什么联系 ?
√
×
×
√
√
×
置换反应
复分解反应
化合反应
分解反应
化学反应
氧化还原反应
非氧化还原反应
有元素化合价变化
无元素化合价变化
注意:
(1)有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
(2)有单质参加或生成的反应不一定是氧化还原反应。例如3O2=2O3
3.氧化还原反应与四种基本类型反应的联系:
问题探究2:请用树状分类法对化学反应分类
化学反应
根据反应物和生成物的类别以及反应前后物质的种类的多少
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
根据化合价升降
非氧化还原反应
1.下列反应属于氧化还原反应的是( ) A.CaCO3+2HCl=CaCl2+H2O+CO2↑
B.CaCO3=CaO+CO2↑
C.Na2O+H2O=2NaOH
D.Mg+2HCl = MgCl2+H2↑
高温
D
【课堂检测】
2.氧化还原反应的实质是( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或共用电子对的偏移
D.氧原子的得失
3.下列四种基本类型的反应中,一定是氧化还原反应的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
C
C
4.在Fe2O3+3CO = 2Fe+3CO2反应中,Fe元素化合价______,_______电子, 被________,发生________。C元素化合价_______,______电子,被________,发生_______。
降低
氧化
还原
升高
得到
失去
还原反应
氧化反应
高温
5、在黑火药的爆炸反应 2KNO3+S+3C==K2S+N2↑+3CO2↑中,
化合价升高的元素是 ,得电子的原子是 ,被还原的元素是 ,发生氧化反应的物质是 。
C
N、S
N、S
C
