化学必修人教版(2019)第一册1.2.3离子反应的应用(共17张ppt)
文档属性
| 名称 | 化学必修人教版(2019)第一册1.2.3离子反应的应用(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 658.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-05 09:06:55 | ||
图片预览





文档简介
(共17张PPT)
学
习
目
标
1.2.3 离子反应的应用
1、从离子方程式书写原则认识离子方程式正误判断方法。
2、理解与“量” 有关的离子方程式书写方法。
3、从离子反应认识离子共存问题。
4、根据离子性质进行物质的鉴别和推断,能设计实验方案进行物质的分离提纯和鉴定。
1. 看离子反应是否符合客观事实
Fe跟稀HCl反应:2Fe+6H+ = 2Fe3++3H2↑
2. 看是否符合拆分原则
CaCO3跟稀 HCl反应: CO32- + 2H+ = CO2+H2O
4. 看是否守恒(原子守恒、电荷守恒)
Cu + Ag+ = Cu2+ + Ag
Na + H2O = Na+ + OH- + H2↑
3. 看是否漏写离子反应
稀CuSO4和Ba(OH)2 溶液反应:SO42- + Ba2+ = BaSO4↓
×
×
×
×
×
5.看是否符合阴、阳离子的个数配比
Ba(OH)2溶液和稀硫酸反应
Ba2++OH-+H++SO42- =BaSO4↓+H2O
×
一、离子方程式的正误判断
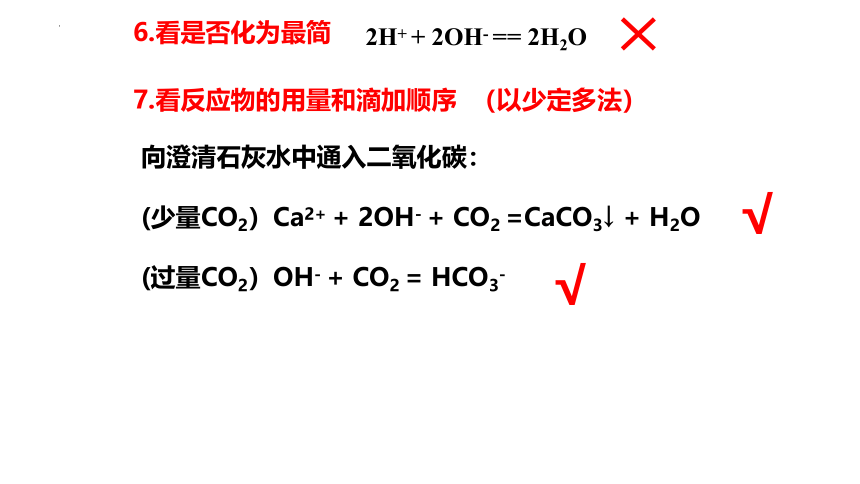
7.看反应物的用量和滴加顺序 (以少定多法)
向澄清石灰水中通入二氧化碳:
(少量CO2)Ca2+ + 2OH- + CO2 =CaCO3↓ + H2O
(过量CO2)OH- + CO2 = HCO3-
6.看是否化为最简
2H+ + 2OH- == 2H2O
√
√
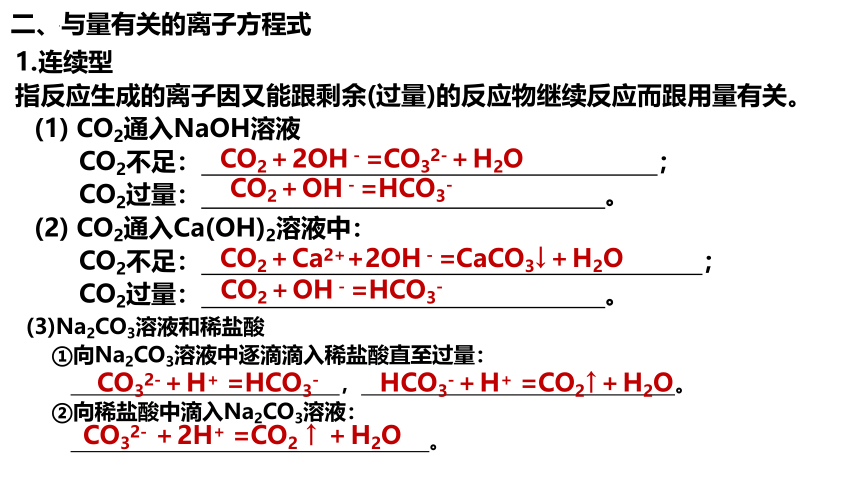
二、与量有关的离子方程式
1.连续型
指反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关。
(1) CO2通入NaOH溶液
CO2不足: ;
CO2过量: 。
(2) CO2通入Ca(OH)2溶液中:
CO2不足: ;
CO2过量: 。
CO2+OH-=HCO3-
CO2+2OH-=CO32-+H2O
CO2+Ca2++2OH-=CaCO3↓+H2O
CO2+OH-=HCO3-
(3)Na2CO3溶液和稀盐酸
①向Na2CO3溶液中逐滴滴入稀盐酸直至过量:
, 。
②向稀盐酸中滴入Na2CO3溶液:
。
CO32-+H+ =HCO3-
HCO3-+H+ =CO2↑+H2O
CO32- +2H+ =CO2 ↑ +H2O
2.先后型
一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离子反应,但因反应次序不同而跟用量有关。
(1)向含有H+、NH4+的溶液中,逐滴加入NaOH溶液至过量,反应的离子方程式依次为_____________________________________________。
(2)向含有OH-、CO32-的溶液中,逐滴加入稀盐酸至过量,反应的离子方程式依次为____________________________________________;
____________________________。
(3)将足量的CO2不断通入NaOH.Ca(OH)2的混合溶液中,反应的离子方程式依次为:______________________________________________;
____________________________________________________________ ______________________________________。
OH-+H+=H2O
CO32-+H+ =HCO3-
HCO3-+H+ =CO2↑+H2O
CO2+Ca2++2OH-=CaCO3↓+H2O
CO2+2OH-=CO32-+H2O
OH-+H+=H2O
OH-+NH4+= NH3·H2O
CO2+H2O +CO32- = 2HCO3-
CO2+H2O +CaCO3 = Ca2++2HCO3-
3.配比型
当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调,当一种组成离子恰好完全反应时,另一种组成离子不能恰好完全反应(有剩余或不足),因而跟用量有关。
(1)Ca(HCO3)2溶液与NaOH溶液反应
NaOH不足: _________________________________________
NaOH过量: _ 。
(2)NaHCO3溶液与Ca(OH)2溶液反应
NaHCO3不足:___ ______________________________________
NaHCO3过量:___ 。
(3) NaHSO4溶液中滴入Ba(OH)2溶液
当SO42-沉淀完全时:_________ ,此时溶液呈 性;滴至溶液呈中性: ;若向该溶液中再加Ba(OH)2溶液,离子方程式为:____________________
Ca2++HCO3-+OH-=CaCO3↓+H2O
Ca2++2 HCO3- +2OH-=CaCO3↓+2H2O+CO32-
Ca2++OH-+HCO3-=CaCO3↓+H2O
Ca2++2OH-+2HCO3- =CaCO3↓+2H2O+CO32-
Ba2++OH-+H++SO42-=BaSO4↓+H2O
碱
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
SO42-+Ba2+=BaSO4↓
1.离子共存
所谓几种离子在同一溶液中能大量共存,就是指离子之间不能发生离子反应;若离子之间能发生离子反应,则不能大量共存。
2.常见的离子不共存归纳:
(1)若阴、阳离子能相互结合生成难溶物或微溶性盐,则不能大量共存。如Ba2+、Ca2+与CO32-、SO42-、SO32-等;Ag+与Cl-、Br-、I-、CO32-等。
(2)弱碱的阳离子不能与OH-大量共存。如Fe3+、Cu2+、NH4+、Ag+、Mg2+、Al3+、Fe2+、Zn2+与OH-不能大量共存。
三、离子共存的判断
(3)弱酸根阴离子不能与H+大量共存。如F-、CO32-、SO32-、S2-、PO43-、CH3COO-等与H+不能大量共存。
(4)弱酸的酸式酸根阴离子与H+和OH-均不能大量共存。如HCO3-、HSO3-、HS-、H2PO4-、HPO42-既不能与H+大量共存,又不能与OH-大量共存。
(5)“透明”溶液,不代表无色,也可以有色,只是无难溶物或微溶物。
练习1.下列各组离子能在溶液中大量共存的是( )
A.OH-、Ca2+、NO3-、SO32- B.Ca2+、HCO3-、Cl-、K+
C.NH4+、Ag+、NO3-、I- D.K+、OH-、Cl-、HCO3-
B
练习2.在某无色透明的酸性溶液中,能共存的离子组是( )
A.Na+、K+、SO42-、HCO3- B.Cu2+、K+、SO42-、NO3-
C.Na+、K+、Cl-、NO3- D.Fe3+、K+、SO42-、Cl-
C
四、常见离子的检验与推断
1.溶液中离子的鉴定
练习3.某溶液中含有较大量的Cl-、SO42-、CO32-三种阴离子,如果只取一次该溶液就能够分别将 三种阴离子依次检验出来,则下列实验操作顺序中正确的是( )
①滴加 HNO3 溶液; ②过滤; ③滴加 AgNO3 溶液;
④滴加 Ba(NO3)2 溶液; ⑤滴加 BaCl2 溶液;
A.①⑤②③② B.④②③②① C.①④②③② D.③②①②④
C
如鉴别失去标签的四瓶溶液
Na2CO3溶液、NaCl溶液、Na2SO4溶液、MgCl2溶液
Ba(OH)2溶液
产生白色沉淀
无明显现象
NaCl溶液
足量稀盐酸
沉淀不溶解
沉淀溶解
Na2SO4溶液
沉淀溶解且有气泡逸出
Na2SO4溶液
MgCl2溶液
2.物质鉴别
练习4.有五瓶失去标签的溶液,已知它们是:①Ba(NO3)2溶液,②KCl溶液,③NaOH溶液,④CuSO4溶液,⑤Na2SO4溶液。若不用其他任何试剂,用最简便的方法就能将它们一一鉴别。下列鉴别顺序中最合理的是( )
A.④③①⑤② B.④⑤①②③ C.①⑤③④② D.③④①⑤②
A
2.常见离子推断的四项原则:
(1)肯定性原则:根据题干或实验现象确定物质。
(2)电中性原则:在溶液中一定为电中性,阴阳离子带的电荷数相等。
(3)进出性原则:根据实验过程中物质的引入对推断物质的干扰。
(4)互斥性原则:根据已确定的物质结合反应排除不存在的物质。
练习5. 有一瓶无色透明溶液,含Cl-、CO32-、SO42-、Na+、K+、Mg2+、Cu2+中的某几种。
①取少量原溶液加入足量的Ba(OH)2溶液产生白色沉淀;
②取少量原溶液加入足量的BaCl2溶液不产生沉淀;
③取少量原溶液加入足量的AgNO3溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解。回答下列问题:
(1)原溶液中一定含有的离子是___________,一定不含有的阴离子是___________,可能含有的离子是______________。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”) ____,说明理由
______________________________________________________。
(3)写出①中反应的离子方程式:_________________________________________。
Mg2+、Cl-
CO32-、SO42-
Na+、 K+
是
根据溶液呈电中性,溶液中一定存在唯一的阴离子Cl-
Mg2++2OH-= Mg(OH)2↓
五、物质的分离与提纯
以分离MgCl2、NaCl为例
Mg2+
Na+
Cl-
过量NaOH溶液
过滤
OH-
Na+、Cl-、OH-
Mg(OH)2
适量盐酸
Na+、Cl-
适量盐酸
Mg2+、Cl-
1.物质的分离:
请同学们根据下列流程图思考粗盐(主要物质为NaCl,还含泥沙和一些可溶性杂质[CaCl2、MgCl2、Na2SO4])的提纯过程涉及到的化学方程式和离子方程式:
2.物质的提纯(除杂)
①原则:不增,不减,易分离
②思路:杂转纯,杂变沉,化为气,生成水。
学
习
目
标
1.2.3 离子反应的应用
1、从离子方程式书写原则认识离子方程式正误判断方法。
2、理解与“量” 有关的离子方程式书写方法。
3、从离子反应认识离子共存问题。
4、根据离子性质进行物质的鉴别和推断,能设计实验方案进行物质的分离提纯和鉴定。
1. 看离子反应是否符合客观事实
Fe跟稀HCl反应:2Fe+6H+ = 2Fe3++3H2↑
2. 看是否符合拆分原则
CaCO3跟稀 HCl反应: CO32- + 2H+ = CO2+H2O
4. 看是否守恒(原子守恒、电荷守恒)
Cu + Ag+ = Cu2+ + Ag
Na + H2O = Na+ + OH- + H2↑
3. 看是否漏写离子反应
稀CuSO4和Ba(OH)2 溶液反应:SO42- + Ba2+ = BaSO4↓
×
×
×
×
×
5.看是否符合阴、阳离子的个数配比
Ba(OH)2溶液和稀硫酸反应
Ba2++OH-+H++SO42- =BaSO4↓+H2O
×
一、离子方程式的正误判断
7.看反应物的用量和滴加顺序 (以少定多法)
向澄清石灰水中通入二氧化碳:
(少量CO2)Ca2+ + 2OH- + CO2 =CaCO3↓ + H2O
(过量CO2)OH- + CO2 = HCO3-
6.看是否化为最简
2H+ + 2OH- == 2H2O
√
√
二、与量有关的离子方程式
1.连续型
指反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关。
(1) CO2通入NaOH溶液
CO2不足: ;
CO2过量: 。
(2) CO2通入Ca(OH)2溶液中:
CO2不足: ;
CO2过量: 。
CO2+OH-=HCO3-
CO2+2OH-=CO32-+H2O
CO2+Ca2++2OH-=CaCO3↓+H2O
CO2+OH-=HCO3-
(3)Na2CO3溶液和稀盐酸
①向Na2CO3溶液中逐滴滴入稀盐酸直至过量:
, 。
②向稀盐酸中滴入Na2CO3溶液:
。
CO32-+H+ =HCO3-
HCO3-+H+ =CO2↑+H2O
CO32- +2H+ =CO2 ↑ +H2O
2.先后型
一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离子反应,但因反应次序不同而跟用量有关。
(1)向含有H+、NH4+的溶液中,逐滴加入NaOH溶液至过量,反应的离子方程式依次为_____________________________________________。
(2)向含有OH-、CO32-的溶液中,逐滴加入稀盐酸至过量,反应的离子方程式依次为____________________________________________;
____________________________。
(3)将足量的CO2不断通入NaOH.Ca(OH)2的混合溶液中,反应的离子方程式依次为:______________________________________________;
____________________________________________________________ ______________________________________。
OH-+H+=H2O
CO32-+H+ =HCO3-
HCO3-+H+ =CO2↑+H2O
CO2+Ca2++2OH-=CaCO3↓+H2O
CO2+2OH-=CO32-+H2O
OH-+H+=H2O
OH-+NH4+= NH3·H2O
CO2+H2O +CO32- = 2HCO3-
CO2+H2O +CaCO3 = Ca2++2HCO3-
3.配比型
当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调,当一种组成离子恰好完全反应时,另一种组成离子不能恰好完全反应(有剩余或不足),因而跟用量有关。
(1)Ca(HCO3)2溶液与NaOH溶液反应
NaOH不足: _________________________________________
NaOH过量: _ 。
(2)NaHCO3溶液与Ca(OH)2溶液反应
NaHCO3不足:___ ______________________________________
NaHCO3过量:___ 。
(3) NaHSO4溶液中滴入Ba(OH)2溶液
当SO42-沉淀完全时:_________ ,此时溶液呈 性;滴至溶液呈中性: ;若向该溶液中再加Ba(OH)2溶液,离子方程式为:____________________
Ca2++HCO3-+OH-=CaCO3↓+H2O
Ca2++2 HCO3- +2OH-=CaCO3↓+2H2O+CO32-
Ca2++OH-+HCO3-=CaCO3↓+H2O
Ca2++2OH-+2HCO3- =CaCO3↓+2H2O+CO32-
Ba2++OH-+H++SO42-=BaSO4↓+H2O
碱
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
SO42-+Ba2+=BaSO4↓
1.离子共存
所谓几种离子在同一溶液中能大量共存,就是指离子之间不能发生离子反应;若离子之间能发生离子反应,则不能大量共存。
2.常见的离子不共存归纳:
(1)若阴、阳离子能相互结合生成难溶物或微溶性盐,则不能大量共存。如Ba2+、Ca2+与CO32-、SO42-、SO32-等;Ag+与Cl-、Br-、I-、CO32-等。
(2)弱碱的阳离子不能与OH-大量共存。如Fe3+、Cu2+、NH4+、Ag+、Mg2+、Al3+、Fe2+、Zn2+与OH-不能大量共存。
三、离子共存的判断
(3)弱酸根阴离子不能与H+大量共存。如F-、CO32-、SO32-、S2-、PO43-、CH3COO-等与H+不能大量共存。
(4)弱酸的酸式酸根阴离子与H+和OH-均不能大量共存。如HCO3-、HSO3-、HS-、H2PO4-、HPO42-既不能与H+大量共存,又不能与OH-大量共存。
(5)“透明”溶液,不代表无色,也可以有色,只是无难溶物或微溶物。
练习1.下列各组离子能在溶液中大量共存的是( )
A.OH-、Ca2+、NO3-、SO32- B.Ca2+、HCO3-、Cl-、K+
C.NH4+、Ag+、NO3-、I- D.K+、OH-、Cl-、HCO3-
B
练习2.在某无色透明的酸性溶液中,能共存的离子组是( )
A.Na+、K+、SO42-、HCO3- B.Cu2+、K+、SO42-、NO3-
C.Na+、K+、Cl-、NO3- D.Fe3+、K+、SO42-、Cl-
C
四、常见离子的检验与推断
1.溶液中离子的鉴定
练习3.某溶液中含有较大量的Cl-、SO42-、CO32-三种阴离子,如果只取一次该溶液就能够分别将 三种阴离子依次检验出来,则下列实验操作顺序中正确的是( )
①滴加 HNO3 溶液; ②过滤; ③滴加 AgNO3 溶液;
④滴加 Ba(NO3)2 溶液; ⑤滴加 BaCl2 溶液;
A.①⑤②③② B.④②③②① C.①④②③② D.③②①②④
C
如鉴别失去标签的四瓶溶液
Na2CO3溶液、NaCl溶液、Na2SO4溶液、MgCl2溶液
Ba(OH)2溶液
产生白色沉淀
无明显现象
NaCl溶液
足量稀盐酸
沉淀不溶解
沉淀溶解
Na2SO4溶液
沉淀溶解且有气泡逸出
Na2SO4溶液
MgCl2溶液
2.物质鉴别
练习4.有五瓶失去标签的溶液,已知它们是:①Ba(NO3)2溶液,②KCl溶液,③NaOH溶液,④CuSO4溶液,⑤Na2SO4溶液。若不用其他任何试剂,用最简便的方法就能将它们一一鉴别。下列鉴别顺序中最合理的是( )
A.④③①⑤② B.④⑤①②③ C.①⑤③④② D.③④①⑤②
A
2.常见离子推断的四项原则:
(1)肯定性原则:根据题干或实验现象确定物质。
(2)电中性原则:在溶液中一定为电中性,阴阳离子带的电荷数相等。
(3)进出性原则:根据实验过程中物质的引入对推断物质的干扰。
(4)互斥性原则:根据已确定的物质结合反应排除不存在的物质。
练习5. 有一瓶无色透明溶液,含Cl-、CO32-、SO42-、Na+、K+、Mg2+、Cu2+中的某几种。
①取少量原溶液加入足量的Ba(OH)2溶液产生白色沉淀;
②取少量原溶液加入足量的BaCl2溶液不产生沉淀;
③取少量原溶液加入足量的AgNO3溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解。回答下列问题:
(1)原溶液中一定含有的离子是___________,一定不含有的阴离子是___________,可能含有的离子是______________。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”) ____,说明理由
______________________________________________________。
(3)写出①中反应的离子方程式:_________________________________________。
Mg2+、Cl-
CO32-、SO42-
Na+、 K+
是
根据溶液呈电中性,溶液中一定存在唯一的阴离子Cl-
Mg2++2OH-= Mg(OH)2↓
五、物质的分离与提纯
以分离MgCl2、NaCl为例
Mg2+
Na+
Cl-
过量NaOH溶液
过滤
OH-
Na+、Cl-、OH-
Mg(OH)2
适量盐酸
Na+、Cl-
适量盐酸
Mg2+、Cl-
1.物质的分离:
请同学们根据下列流程图思考粗盐(主要物质为NaCl,还含泥沙和一些可溶性杂质[CaCl2、MgCl2、Na2SO4])的提纯过程涉及到的化学方程式和离子方程式:
2.物质的提纯(除杂)
①原则:不增,不减,易分离
②思路:杂转纯,杂变沉,化为气,生成水。
