第四单元课题4化学式与化合价 课件 -2022-2023学年九年级化学人教版上册(共36张PPT)
文档属性
| 名称 | 第四单元课题4化学式与化合价 课件 -2022-2023学年九年级化学人教版上册(共36张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 294.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-05 16:39:06 | ||
图片预览










文档简介
(共36张PPT)
课题4 化学式与化合价
第1课时 化学式
第四单元 自然界的水
头脑风暴:试着用不同的形式表示“水”
H2O
water
水
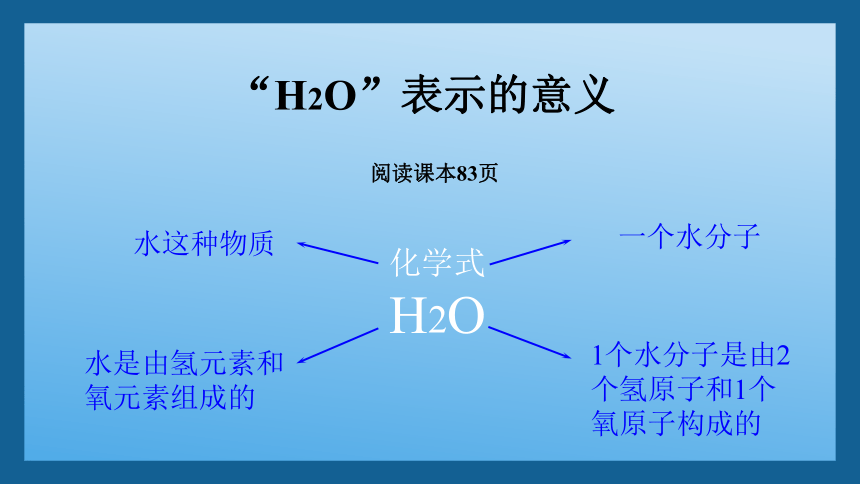
“H2O”表示的意义
水是由氢元素和氧元素组成的
一个水分子
水这种物质
化学式
H2O
1个水分子是由2个氢原子和1个氧原子构成的
阅读课本83页
什么叫做化学式?
1.概念:
【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个。
如:水 H2O
氧气 O2
二氧化碳 CO2
用元素符号和数字的组合表示物质组成的式子叫化学式。
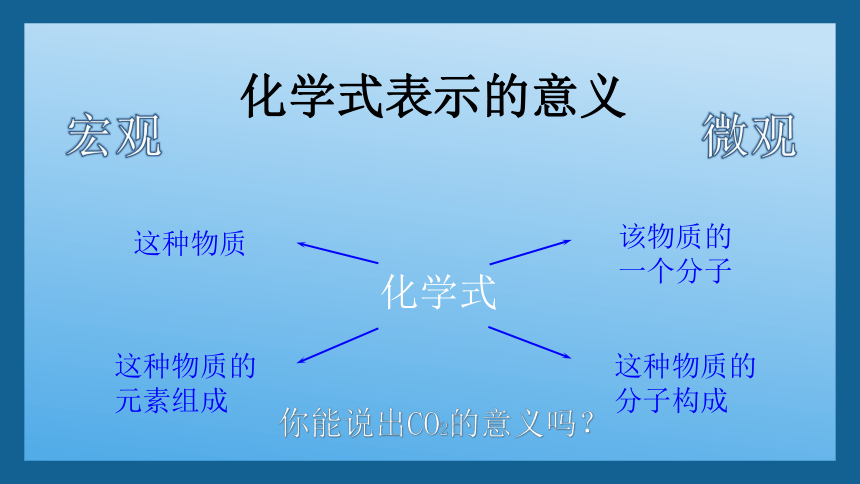
化学式表示的意义
这种物质的元素组成
该物质的一个分子
这种物质
化学式
这种物质的分子构成
宏观
微观
你能说出CO2的意义吗?
① H
③ H2
④ 2H2
符号H、2H、H2、2H2各具有什么意义?
② 2H
表示氢元素或一个氢原子
表示2个氢原子
表示氢气这种物质;氢气是由氢元 素组成;一个氢分子;每个氢分子由2个氢原子构成。
表示两个氢分子
如何书写化学式?
(1)化学式的写法
金属单质: 铁(Fe) 铝(Al)
固态非金属单质:硫(S) 磷(P)
稀有气体: 氖气(Ne) 氦气(He)
①单质
用元素符号直接
表示化学式
氧气(O2) 氢气(H2)
氮气(N2) 氯气(Cl2)
气体非金属单质
在元素符号右下角加2表示化学式
②化合物
氧化物:氧在后,其他元素在前。
例如:CO2、SO2、H2O等。
其他两种元素形成的化合物:金属在前,非金属在后。
例如:NaCl、FeCl3等。
通常正价元素在前,负价元素在后。
FeCl3
P2O5
H2O
如何确定化学式中的数字?
物质的名称 所含原子或离子的个数比 化学式
氯化氢 H:Cl= HCl
氯化钙 := CaCl2
氧化铜 Cu:O= CuO
碳酸钙 := CaCO3
氯化铁 := FeCl3
你有什么发现?
元素的化合价是元素的原子之间形成化合物时表现出来的一种性质,用来表示原子间化合的数目。
什么是化合价?
什么是化合价?
化合价与物质的组成有怎样的联系?
离子符号和化合价的表示方法不同:
离子:数字在前,“+”“-”号在后;写在右上角。1省略不写
化合价:数字在后,“+”“-”号在前;写在正上方。1不省略
化合价与离子所带电荷的联系:数字相同,正负号相同。
离子符号与化合价的比较:
离子符号 Na+ Mg2+ Al3+ F- O2-
化合价 Na Mg Al F O
+1
+2
+3
+1
-2
原子团:作为一个整体参加反应的原子集团(就好像一个原子一样),原子团也叫作根。
注意:①原子团不能单独存在;
②带电荷的原子团也是离子。
NaOH、 Ca(OH)2 、Cu(NO3)2、NH4NO3、BaSO4、CaCO3、 H3PO4
根:
离子:
OH-:
NH4+:
NO3-:
CO32-:
SO42-:
PO43-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
磷酸根离子
化合价的有关规律:
规定:
(1)H元素的化合价为+1价;
(2)O元素的化合价为-2价;
(3)在化合物中,元素的正负化合价代数和为0。
物质 CO2 P2O5 HCl Fe2O3
原子 个数比 1:2 2:5 1:1 2:3
根据以上的规定,你能推算出上述几种物质中其他元素的化合价吗?
化合价的应用
练一练:
(1)NO
(2)NO2
(3)NH3
(4)N2
+2
+4
-3
0
同种元素在不同物质中可显不同的化合价。
单质里元素的化合价为零。
1.根据化学式求某一元素化合价
化合价的应用
例1:试确定氯酸钾(KClO3)中氯元素的化合价
解:设氯元素的化合价为x,则
(+1)+ x +(-2)×3=0
x = +5
所以,在氯酸钾中,氯元素的化合价为+5价
2.根据化合价求化学式
步骤:(数字交叉法)
① 写符号
② 标化合价
③ 化合价绝对值交叉放置在元素符号右下角
④ 约简
⑤ 检查
例2 已知磷元素有两种氧化物,其中磷的化合价分别为+3和+5,写出这两种磷的氧化物的化学式
步骤:(数字交叉法)
① 写符号
② 标化合价
③ 化合价绝对值交叉放置在元素符号右下角
④ 约简
⑤ 检查
例3 已知硫元素有两种氧化物,其中硫的化合价分别为+4和+6,写出这两种硫的氧化物的化学式
1.化合价的表示方法
在元素符号头顶上,符号在前,数值在后
2.常见元素及原子团的化合价
3.化合价的一般规律
单质中元素化合价为零,化合物中元素化合价代数和为零
4.化合价的应用
①计算化合物中某一元素的化合价
依据:化合物中元素化合价代数和为零
②判断化合物的化学式是否正确
③依据化合价书写化学式
课堂小结
1.冲洗照片时,需将底片浸泡在大苏打(Na2S2O3)溶液中,使影像固定下来,这一过程叫“定影”。大苏打中硫元素的化合价为( )
A.0 B.+2
C.+4 D.+6
B
2.手机中使用的锂(Li)电池是新型的高能电池,某种锂电池的总反应可表示为Li + MnO2 LiMnO2 ,此反应中锂元素的化合价变化为0→+1,下列对锰元素的化合价变化判断正确的是( )
A.+4→+3 B. +2→+3 C. 0→+2 D.-4→-2
A
课题4 化学式与化合价
第2课时 有关相对分子质量的计算
第四单元 自然界的水
有关相对分子质量的计算
1.相对分子质量
H2O的意义:1个水分子是由2个氢原子和1个氧原子构成的。
真实质量:1个水分子的质量=2个氢原子的质量+1个氧原子
的质量。
相对分子质量:1个水分子的相对分子质量=2个氢原子的
相对原子质量+1个氧原子的相对原子质量
所以H2O的相对分子质量=1×2+16×1=18
定义:化学式中各原子的相对原子质量的总和,就是相对分子质量。
例:计算 (NH4)2SO4的相对分子质量
解:(NH4)2SO4的相对分子质量
=(14+1×4)×2+32+16×4=132
练1:N2 的相对分子质量=
H2SO4的相对分子质量=
2N2 的相对分子质量如何计算?
14× 2 = 28
1× 2 + 32 + 16 × 4= 98
2.计算物质组成元素的质量比
各元素之间的质量比=各原子的相对原子质量总和之比
例:求Fe2O3中铁元素和氧元素的质量比。
解:Fe2O3中铁元素和氧元素的质量比
m(Fe)∶m(O)=(56×2)∶(16×3)=112∶ 48=7∶ 3
例题2:计算硝酸铵中各元素的质量比
m(N) : m(H) : m( O ) = 14×2 : 1×4 : 16×3
在NH4NO3中
= 28 : 4 : 48
= 7 : 1 : 12
解:
3.计算物质中某元素的质量分数
某元素的质量分数=
该元素相对原子质量×原子个数
化合物的相对分子质量
× 100﹪
注意事项:
①质量分数——用百分数来表示
每100克该物质中含有某元素的质量
②意义:
例:(1)计算二氧化硫中硫元素的质量分数
(2)计算64t二氧化硫中硫元素的质量。
解:(1)SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数=
S的相对原子质量×1
SO2的相对分子质量
×100%
=
32
64
=50%
×100%
(2)64t二氧化硫中硫元素的质量=64t×50%=32t
1.计算相对分子质量
2.计算化学式中各元素的质量比和原子个数比
3.计算化学式中某元素的质量分数
4. 计算一定量的物质中含有的某元素的质量
课堂小结
1.维生素是人体必备的营养物质,维生素D2的化学式C28H44O。
试计算:
(1)维生素D2的相对分子质量 。
(2)维生素D2中的碳、氢、氧三种元素的比 。
(3)198g维生素D2中含碳元素的质量为 g。
396
84∶11∶4
168
2.5月~7月是手足口病高发期,手足口病是由肠道病毒引起的传染病,多发生于5岁以下儿童,可引起手、足、口腔等部位的疱疹。治疗手足口病的常用药物是阿昔洛韦(化学式为:C8H11N5O3)。下列有关阿昔洛韦的说法不正确的是( )
A.阿昔洛韦属于有机化合物
B.阿昔洛韦中C、H、N、O三种元素的质量比为8∶11∶5∶3
C.阿昔洛韦的相对分子质量为225
D.该物质的一个分子中含有27个原子
B
3.碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3)。下图是超市销售的一种加碘盐标签上的部分文字说明。
请回答下列问题:
(1)碘酸钾中钾、碘、氧三种元
素质量比为_____________。
(2)每袋该食盐中碘元素的质量为 mg。
(3)中国营养学会推荐:一个18岁的青年每天摄入碘元素的
质量为0.15 mg。假设碘的来源仅靠这种加碘食盐,该青年
每天摄入这种食盐应为 g。
食 盐
成分:NaCl KIO3
含碘:20 mg/kg
重量: 500g
食用注意:勿长时间加热
保存:防潮、放阴凉处
39∶127∶48
10
7.5
中档题挑战
1、已知化合物R2O3 的相对分子质量是160,求 R的相对原子质量。
2. 质量相等的SO2和SO3这两种物质中所含的分子个数比是多少?所含O原子的个数比是多少?
3、已知某氮氧元素组成的氧化物中,氮与氧的质量比是 7 :16,该化合物的化学式为 。
课题4 化学式与化合价
第1课时 化学式
第四单元 自然界的水
头脑风暴:试着用不同的形式表示“水”
H2O
water
水
“H2O”表示的意义
水是由氢元素和氧元素组成的
一个水分子
水这种物质
化学式
H2O
1个水分子是由2个氢原子和1个氧原子构成的
阅读课本83页
什么叫做化学式?
1.概念:
【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个。
如:水 H2O
氧气 O2
二氧化碳 CO2
用元素符号和数字的组合表示物质组成的式子叫化学式。
化学式表示的意义
这种物质的元素组成
该物质的一个分子
这种物质
化学式
这种物质的分子构成
宏观
微观
你能说出CO2的意义吗?
① H
③ H2
④ 2H2
符号H、2H、H2、2H2各具有什么意义?
② 2H
表示氢元素或一个氢原子
表示2个氢原子
表示氢气这种物质;氢气是由氢元 素组成;一个氢分子;每个氢分子由2个氢原子构成。
表示两个氢分子
如何书写化学式?
(1)化学式的写法
金属单质: 铁(Fe) 铝(Al)
固态非金属单质:硫(S) 磷(P)
稀有气体: 氖气(Ne) 氦气(He)
①单质
用元素符号直接
表示化学式
氧气(O2) 氢气(H2)
氮气(N2) 氯气(Cl2)
气体非金属单质
在元素符号右下角加2表示化学式
②化合物
氧化物:氧在后,其他元素在前。
例如:CO2、SO2、H2O等。
其他两种元素形成的化合物:金属在前,非金属在后。
例如:NaCl、FeCl3等。
通常正价元素在前,负价元素在后。
FeCl3
P2O5
H2O
如何确定化学式中的数字?
物质的名称 所含原子或离子的个数比 化学式
氯化氢 H:Cl= HCl
氯化钙 := CaCl2
氧化铜 Cu:O= CuO
碳酸钙 := CaCO3
氯化铁 := FeCl3
你有什么发现?
元素的化合价是元素的原子之间形成化合物时表现出来的一种性质,用来表示原子间化合的数目。
什么是化合价?
什么是化合价?
化合价与物质的组成有怎样的联系?
离子符号和化合价的表示方法不同:
离子:数字在前,“+”“-”号在后;写在右上角。1省略不写
化合价:数字在后,“+”“-”号在前;写在正上方。1不省略
化合价与离子所带电荷的联系:数字相同,正负号相同。
离子符号与化合价的比较:
离子符号 Na+ Mg2+ Al3+ F- O2-
化合价 Na Mg Al F O
+1
+2
+3
+1
-2
原子团:作为一个整体参加反应的原子集团(就好像一个原子一样),原子团也叫作根。
注意:①原子团不能单独存在;
②带电荷的原子团也是离子。
NaOH、 Ca(OH)2 、Cu(NO3)2、NH4NO3、BaSO4、CaCO3、 H3PO4
根:
离子:
OH-:
NH4+:
NO3-:
CO32-:
SO42-:
PO43-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
磷酸根离子
化合价的有关规律:
规定:
(1)H元素的化合价为+1价;
(2)O元素的化合价为-2价;
(3)在化合物中,元素的正负化合价代数和为0。
物质 CO2 P2O5 HCl Fe2O3
原子 个数比 1:2 2:5 1:1 2:3
根据以上的规定,你能推算出上述几种物质中其他元素的化合价吗?
化合价的应用
练一练:
(1)NO
(2)NO2
(3)NH3
(4)N2
+2
+4
-3
0
同种元素在不同物质中可显不同的化合价。
单质里元素的化合价为零。
1.根据化学式求某一元素化合价
化合价的应用
例1:试确定氯酸钾(KClO3)中氯元素的化合价
解:设氯元素的化合价为x,则
(+1)+ x +(-2)×3=0
x = +5
所以,在氯酸钾中,氯元素的化合价为+5价
2.根据化合价求化学式
步骤:(数字交叉法)
① 写符号
② 标化合价
③ 化合价绝对值交叉放置在元素符号右下角
④ 约简
⑤ 检查
例2 已知磷元素有两种氧化物,其中磷的化合价分别为+3和+5,写出这两种磷的氧化物的化学式
步骤:(数字交叉法)
① 写符号
② 标化合价
③ 化合价绝对值交叉放置在元素符号右下角
④ 约简
⑤ 检查
例3 已知硫元素有两种氧化物,其中硫的化合价分别为+4和+6,写出这两种硫的氧化物的化学式
1.化合价的表示方法
在元素符号头顶上,符号在前,数值在后
2.常见元素及原子团的化合价
3.化合价的一般规律
单质中元素化合价为零,化合物中元素化合价代数和为零
4.化合价的应用
①计算化合物中某一元素的化合价
依据:化合物中元素化合价代数和为零
②判断化合物的化学式是否正确
③依据化合价书写化学式
课堂小结
1.冲洗照片时,需将底片浸泡在大苏打(Na2S2O3)溶液中,使影像固定下来,这一过程叫“定影”。大苏打中硫元素的化合价为( )
A.0 B.+2
C.+4 D.+6
B
2.手机中使用的锂(Li)电池是新型的高能电池,某种锂电池的总反应可表示为Li + MnO2 LiMnO2 ,此反应中锂元素的化合价变化为0→+1,下列对锰元素的化合价变化判断正确的是( )
A.+4→+3 B. +2→+3 C. 0→+2 D.-4→-2
A
课题4 化学式与化合价
第2课时 有关相对分子质量的计算
第四单元 自然界的水
有关相对分子质量的计算
1.相对分子质量
H2O的意义:1个水分子是由2个氢原子和1个氧原子构成的。
真实质量:1个水分子的质量=2个氢原子的质量+1个氧原子
的质量。
相对分子质量:1个水分子的相对分子质量=2个氢原子的
相对原子质量+1个氧原子的相对原子质量
所以H2O的相对分子质量=1×2+16×1=18
定义:化学式中各原子的相对原子质量的总和,就是相对分子质量。
例:计算 (NH4)2SO4的相对分子质量
解:(NH4)2SO4的相对分子质量
=(14+1×4)×2+32+16×4=132
练1:N2 的相对分子质量=
H2SO4的相对分子质量=
2N2 的相对分子质量如何计算?
14× 2 = 28
1× 2 + 32 + 16 × 4= 98
2.计算物质组成元素的质量比
各元素之间的质量比=各原子的相对原子质量总和之比
例:求Fe2O3中铁元素和氧元素的质量比。
解:Fe2O3中铁元素和氧元素的质量比
m(Fe)∶m(O)=(56×2)∶(16×3)=112∶ 48=7∶ 3
例题2:计算硝酸铵中各元素的质量比
m(N) : m(H) : m( O ) = 14×2 : 1×4 : 16×3
在NH4NO3中
= 28 : 4 : 48
= 7 : 1 : 12
解:
3.计算物质中某元素的质量分数
某元素的质量分数=
该元素相对原子质量×原子个数
化合物的相对分子质量
× 100﹪
注意事项:
①质量分数——用百分数来表示
每100克该物质中含有某元素的质量
②意义:
例:(1)计算二氧化硫中硫元素的质量分数
(2)计算64t二氧化硫中硫元素的质量。
解:(1)SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数=
S的相对原子质量×1
SO2的相对分子质量
×100%
=
32
64
=50%
×100%
(2)64t二氧化硫中硫元素的质量=64t×50%=32t
1.计算相对分子质量
2.计算化学式中各元素的质量比和原子个数比
3.计算化学式中某元素的质量分数
4. 计算一定量的物质中含有的某元素的质量
课堂小结
1.维生素是人体必备的营养物质,维生素D2的化学式C28H44O。
试计算:
(1)维生素D2的相对分子质量 。
(2)维生素D2中的碳、氢、氧三种元素的比 。
(3)198g维生素D2中含碳元素的质量为 g。
396
84∶11∶4
168
2.5月~7月是手足口病高发期,手足口病是由肠道病毒引起的传染病,多发生于5岁以下儿童,可引起手、足、口腔等部位的疱疹。治疗手足口病的常用药物是阿昔洛韦(化学式为:C8H11N5O3)。下列有关阿昔洛韦的说法不正确的是( )
A.阿昔洛韦属于有机化合物
B.阿昔洛韦中C、H、N、O三种元素的质量比为8∶11∶5∶3
C.阿昔洛韦的相对分子质量为225
D.该物质的一个分子中含有27个原子
B
3.碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3)。下图是超市销售的一种加碘盐标签上的部分文字说明。
请回答下列问题:
(1)碘酸钾中钾、碘、氧三种元
素质量比为_____________。
(2)每袋该食盐中碘元素的质量为 mg。
(3)中国营养学会推荐:一个18岁的青年每天摄入碘元素的
质量为0.15 mg。假设碘的来源仅靠这种加碘食盐,该青年
每天摄入这种食盐应为 g。
食 盐
成分:NaCl KIO3
含碘:20 mg/kg
重量: 500g
食用注意:勿长时间加热
保存:防潮、放阴凉处
39∶127∶48
10
7.5
中档题挑战
1、已知化合物R2O3 的相对分子质量是160,求 R的相对原子质量。
2. 质量相等的SO2和SO3这两种物质中所含的分子个数比是多少?所含O原子的个数比是多少?
3、已知某氮氧元素组成的氧化物中,氮与氧的质量比是 7 :16,该化合物的化学式为 。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
