人教版九年级化学上册第三单元 构成物质的奥秘 (复习课件30页)
文档属性
| 名称 | 人教版九年级化学上册第三单元 构成物质的奥秘 (复习课件30页) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-08 10:30:40 | ||
图片预览










文档简介
(共30张PPT)
第一部分 教材同步复习
第三单元 物质构成的奥秘
单元综合复习
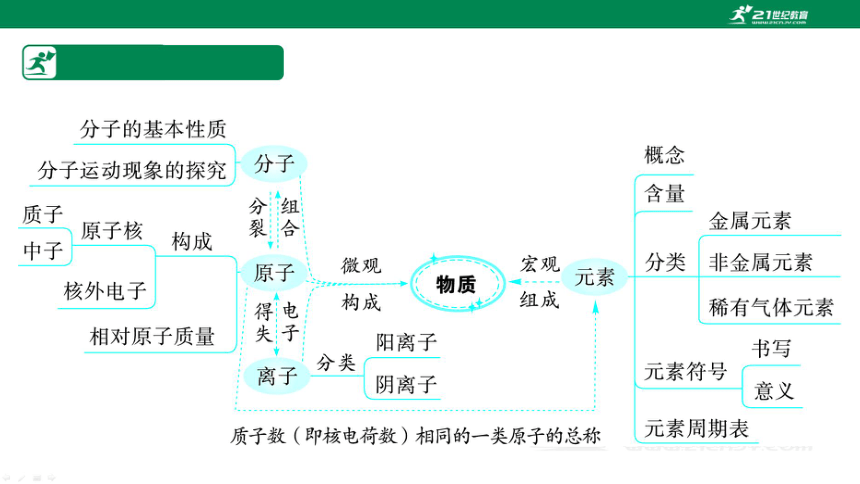
要点1 构成物质的微粒(近5年必考)
1.分子
(1)概念:由分子构成的物质,分子是保持其化学性质的最小粒子。
(2)分子的性质(近5年必考)
①小:分子的质量和体积都很小。如1个水分子的质量约为3×10-26kg,1滴水中大约有1.67×1021个水分子。
②动:分子总是在不断运动着,且温度越高,运动速率越快。如闻到花香、湿衣服在阳光下比在阴凉处干得快。
③间:分子之间有间隔。如气体受压液化,分子间的间隔变小。
④同:由同种分子构成的物质,化学性质相同;由不同种分子构成的物质,化学性质不同。
1.分子的性质同样适用于原子。
2.气体液化、物质的热胀冷缩过程中微粒的大小没有改变,改变的只是微粒间的间隔。
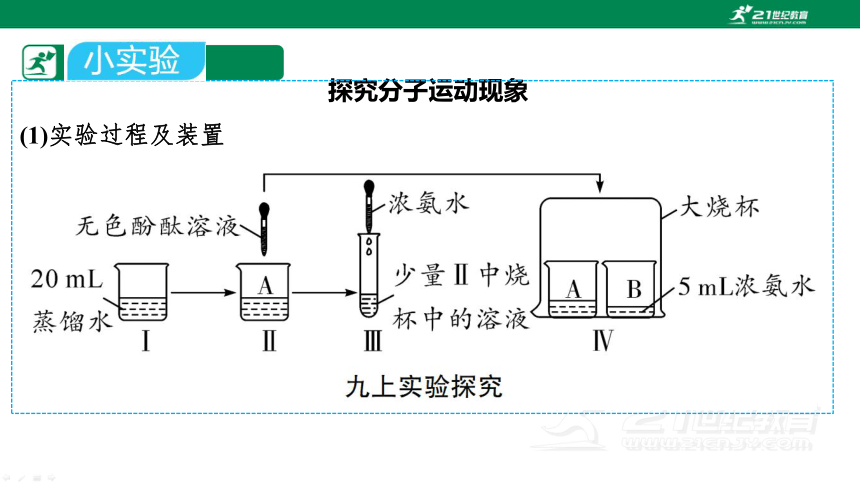
探究分子运动现象
(1)实验过程及装置
(2)现象:过程Ⅲ中试管内的溶液变为__色。一段时间后过程Ⅳ中A烧杯内溶液由__色变为__色。
(3)分析:浓氨水具有挥发性,氨分子由B烧杯运动到A烧杯中,与水反应生成氨水,氨水显碱性,使A烧杯溶液变红。
(4)结论:分子是在不断运动的。
红
无
红
2.原子
(1)概念:化学变化中的最小粒子。
(2)构成
(3)原子中的等量关系:核电荷数=______=__________。
(4)电性:原子核内质子所带电荷与核外电子所带电荷数目____,____相反,故原子不显电性。
质子
中子
质子数
核外电子数
相等
电性
并非所有的原子都是由质子、中子和电子构成的,如某些氢原子中不含
中子。
(5)相对原子质量
①公式:相对原子质量=
②近似计算:相对原子质量≈质子数+中子数
相对原子质量是一个比值,单位为“1”,常省略不写。
3.离子
(1)概念:带电的原子或原子团。
(2)分类
(3)表示:a.在元素或原子团右上角标明离子所带电荷;b.数字在前,正负号在后;c.离子带1个单位的电荷时,“1”省略不写。
(4)意义(以镁离子为例)
1个镁离子带2个单位的正电荷
2个镁离子
带电的粒子不一定是离子,也可能是质子、电子等。
要点2 微粒结构示意图(近5年必考)
(1)判断微粒种类
①质子数>核外电子数(即x>2+8+m) 阳离子
②质子数<核外电子数(即x<2+8+m) 阴离子
③质子数=核外电子数(即x=2+8+m) 原子
(2)原子最外层电子数的应用
①相对稳定结构的判断:主要看最外层电子数,等于8(只有1个电子层时为2)的结构相对稳定。
②判断是否具有相似的化学性质:最外层电子数相同的原子对应的元素化学性质相似(H、He、B除外)。
③判断得失电子能力:最外层电子数<4(He、B除外),易____(填“得”或“失”,下同)电子;最外层电子数>4,易__电子。
失
得
要点3 元素(近5年2考)
概念:元素是______(即核电荷数)相同的一类原子的总称。
2.分类
质子数
3.含量
(1)地壳中含量排在前四位的元素由多到少的顺序为________________ (写名称,后同),其中含量最多的金属元素为__。
(2)空气中含量最多的元素是__,其次是氧。
(3)人体中含量最多的元素是氧,含量最多的金属元素是__。
(4)海水中含量最多的元素是氧。
氧、硅、铝、铁
铝
氮
钙
4.元素符号表示的意义
(1)宏观:表示一种元素,若物质的化学式可用元素符号表示,则还表示某物质。如Fe表示__________________。
微观:表示这种元素的1个原子。如Fe表示__________。
(2)若元素符号前面加上数字,该符号只能表示微观含义。如2Fe表示__________。
铁元素及铁这种物质
1个铁原子
2个铁原子
1.元素属于宏观概念,只讲种类,不讲个数。
2.不同种元素的本质区别是质子数不同。
3.“增铁酱油”“高钙牛奶”中的“铁”“钙”指的是元素。(2022.7,2018.4)
要点4 元素周期表(近5年必考)
1. 横行(周期):每一个横行叫做一个周期,共有7个周期。
2.纵列(族):每一个纵列叫做一个族,共有18个纵列,16个族,其中8、9、10三个纵列共同组成一个族。
3.每一格包含的信息(以碳元素为例)(近5年必考)
原子序数
相对原子质量
元素符号
元素名称
原子序数=核电荷数=核外电子数。
1.下列有关微粒的说法,正确的是( )
A.分子可分原子不可分
B.化学变化中,元素可能发生变化
C.分子、原子都可以构成物质
D .分子由原子构成,所以分子一定比原子大
C
2.(2022 昆明五华区一模)下列宏观事实的微观解释正确的是( )
A.篮球久置会变瘪——分子体积变小
B.水在0 ℃时结冰——分子不再运动
C.氧气易被压缩——分子之间有间隔
D.蔗糖放入水中溶解——蔗糖分子分解了
C
3.(九上习题改编)如图为某原子的结构示意图,下列说法正确的是( )
A .该原子的核电荷数为16
B.该原子核外有6个电子
C.在化学反应中该原子容易失去电子
D.该原子的元素符号为O
A
命题点1 构成物质的微粒
1.(2022 云南4题2分)下列关于“端午时节粽飘香”这一宏观现象的微观解释正确的是( )
A.分子之间有间隔 B.分子的质量很小
C.分子在不断运动 D.分子的体积很小
C
2.(2021 云南9题2分)“嫦娥五号”完成我国首次月球采样任务,带回1 731 g月壤,月壤中含有丰富的氦3。已知氦3的质子数为2,中子数为1。氦3的核外电子数为( )
A.1 B.2
C.3 D.4
B
命题点2 微粒结构示意图
3.(2022 云南13题2分)浩瀚的大海美丽而富饶,钠元素是其中含量较高的元素。如图为钠的原子结构示意图,有关钠原子的说法不正确的是( )
A. 核外有3个电子层
B.质子数为11
C.易失电子形成阳离子
D.“+”表示钠原子带正电
D
4.(2019 云南14题2分)下列粒子结构示意图,表示阴离子的是( )
C
命题点3 元素
5.(2022 云南7题2分)幼儿及青少年缺钙会患佝偻病。因此,每日必须摄入足够量的钙。这里的“钙”指的是( )
A.原子 B.分子
C.元素 D.单质
6.(2017 云南6题2分)地壳中含量最多的金属元素是( )
A.硅 B.氧
C.铝 D.硫
C
C
命题点4 元素周期表
7.(2022 云南14题2分)铑被用于汽车催化转化器,使氮氧化物转化成无害气体。铑元素在元素周期表中的相关信息如图所示,下列说法不正确的是
( )
A.铑的原子序数为45
B.铑的元素符号为Rh
C.铑是一种金属元素
D.一个铑原子的质量为102.9 g
D
第一部分 教材同步复习
第三单元 物质构成的奥秘
单元综合复习
要点1 构成物质的微粒(近5年必考)
1.分子
(1)概念:由分子构成的物质,分子是保持其化学性质的最小粒子。
(2)分子的性质(近5年必考)
①小:分子的质量和体积都很小。如1个水分子的质量约为3×10-26kg,1滴水中大约有1.67×1021个水分子。
②动:分子总是在不断运动着,且温度越高,运动速率越快。如闻到花香、湿衣服在阳光下比在阴凉处干得快。
③间:分子之间有间隔。如气体受压液化,分子间的间隔变小。
④同:由同种分子构成的物质,化学性质相同;由不同种分子构成的物质,化学性质不同。
1.分子的性质同样适用于原子。
2.气体液化、物质的热胀冷缩过程中微粒的大小没有改变,改变的只是微粒间的间隔。
探究分子运动现象
(1)实验过程及装置
(2)现象:过程Ⅲ中试管内的溶液变为__色。一段时间后过程Ⅳ中A烧杯内溶液由__色变为__色。
(3)分析:浓氨水具有挥发性,氨分子由B烧杯运动到A烧杯中,与水反应生成氨水,氨水显碱性,使A烧杯溶液变红。
(4)结论:分子是在不断运动的。
红
无
红
2.原子
(1)概念:化学变化中的最小粒子。
(2)构成
(3)原子中的等量关系:核电荷数=______=__________。
(4)电性:原子核内质子所带电荷与核外电子所带电荷数目____,____相反,故原子不显电性。
质子
中子
质子数
核外电子数
相等
电性
并非所有的原子都是由质子、中子和电子构成的,如某些氢原子中不含
中子。
(5)相对原子质量
①公式:相对原子质量=
②近似计算:相对原子质量≈质子数+中子数
相对原子质量是一个比值,单位为“1”,常省略不写。
3.离子
(1)概念:带电的原子或原子团。
(2)分类
(3)表示:a.在元素或原子团右上角标明离子所带电荷;b.数字在前,正负号在后;c.离子带1个单位的电荷时,“1”省略不写。
(4)意义(以镁离子为例)
1个镁离子带2个单位的正电荷
2个镁离子
带电的粒子不一定是离子,也可能是质子、电子等。
要点2 微粒结构示意图(近5年必考)
(1)判断微粒种类
①质子数>核外电子数(即x>2+8+m) 阳离子
②质子数<核外电子数(即x<2+8+m) 阴离子
③质子数=核外电子数(即x=2+8+m) 原子
(2)原子最外层电子数的应用
①相对稳定结构的判断:主要看最外层电子数,等于8(只有1个电子层时为2)的结构相对稳定。
②判断是否具有相似的化学性质:最外层电子数相同的原子对应的元素化学性质相似(H、He、B除外)。
③判断得失电子能力:最外层电子数<4(He、B除外),易____(填“得”或“失”,下同)电子;最外层电子数>4,易__电子。
失
得
要点3 元素(近5年2考)
概念:元素是______(即核电荷数)相同的一类原子的总称。
2.分类
质子数
3.含量
(1)地壳中含量排在前四位的元素由多到少的顺序为________________ (写名称,后同),其中含量最多的金属元素为__。
(2)空气中含量最多的元素是__,其次是氧。
(3)人体中含量最多的元素是氧,含量最多的金属元素是__。
(4)海水中含量最多的元素是氧。
氧、硅、铝、铁
铝
氮
钙
4.元素符号表示的意义
(1)宏观:表示一种元素,若物质的化学式可用元素符号表示,则还表示某物质。如Fe表示__________________。
微观:表示这种元素的1个原子。如Fe表示__________。
(2)若元素符号前面加上数字,该符号只能表示微观含义。如2Fe表示__________。
铁元素及铁这种物质
1个铁原子
2个铁原子
1.元素属于宏观概念,只讲种类,不讲个数。
2.不同种元素的本质区别是质子数不同。
3.“增铁酱油”“高钙牛奶”中的“铁”“钙”指的是元素。(2022.7,2018.4)
要点4 元素周期表(近5年必考)
1. 横行(周期):每一个横行叫做一个周期,共有7个周期。
2.纵列(族):每一个纵列叫做一个族,共有18个纵列,16个族,其中8、9、10三个纵列共同组成一个族。
3.每一格包含的信息(以碳元素为例)(近5年必考)
原子序数
相对原子质量
元素符号
元素名称
原子序数=核电荷数=核外电子数。
1.下列有关微粒的说法,正确的是( )
A.分子可分原子不可分
B.化学变化中,元素可能发生变化
C.分子、原子都可以构成物质
D .分子由原子构成,所以分子一定比原子大
C
2.(2022 昆明五华区一模)下列宏观事实的微观解释正确的是( )
A.篮球久置会变瘪——分子体积变小
B.水在0 ℃时结冰——分子不再运动
C.氧气易被压缩——分子之间有间隔
D.蔗糖放入水中溶解——蔗糖分子分解了
C
3.(九上习题改编)如图为某原子的结构示意图,下列说法正确的是( )
A .该原子的核电荷数为16
B.该原子核外有6个电子
C.在化学反应中该原子容易失去电子
D.该原子的元素符号为O
A
命题点1 构成物质的微粒
1.(2022 云南4题2分)下列关于“端午时节粽飘香”这一宏观现象的微观解释正确的是( )
A.分子之间有间隔 B.分子的质量很小
C.分子在不断运动 D.分子的体积很小
C
2.(2021 云南9题2分)“嫦娥五号”完成我国首次月球采样任务,带回1 731 g月壤,月壤中含有丰富的氦3。已知氦3的质子数为2,中子数为1。氦3的核外电子数为( )
A.1 B.2
C.3 D.4
B
命题点2 微粒结构示意图
3.(2022 云南13题2分)浩瀚的大海美丽而富饶,钠元素是其中含量较高的元素。如图为钠的原子结构示意图,有关钠原子的说法不正确的是( )
A. 核外有3个电子层
B.质子数为11
C.易失电子形成阳离子
D.“+”表示钠原子带正电
D
4.(2019 云南14题2分)下列粒子结构示意图,表示阴离子的是( )
C
命题点3 元素
5.(2022 云南7题2分)幼儿及青少年缺钙会患佝偻病。因此,每日必须摄入足够量的钙。这里的“钙”指的是( )
A.原子 B.分子
C.元素 D.单质
6.(2017 云南6题2分)地壳中含量最多的金属元素是( )
A.硅 B.氧
C.铝 D.硫
C
C
命题点4 元素周期表
7.(2022 云南14题2分)铑被用于汽车催化转化器,使氮氧化物转化成无害气体。铑元素在元素周期表中的相关信息如图所示,下列说法不正确的是
( )
A.铑的原子序数为45
B.铑的元素符号为Rh
C.铑是一种金属元素
D.一个铑原子的质量为102.9 g
D
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
