化学人教版(2019)必修第一册1.2.2离子反应(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.2离子反应(共39张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-06 15:51:32 | ||
图片预览








文档简介
(共39张PPT)
离子反应
人教版高中化学必修1
第二节 离子反应(第二课时)
温故而知新:如何判断某物质是否是电解质
1.宏观事实
——在水溶液或者熔融状态下能导电的化合物
2.微观粒子构成
——由离子构成的化合物
3.物质类别的角度
——酸、碱、盐及金属氧化物
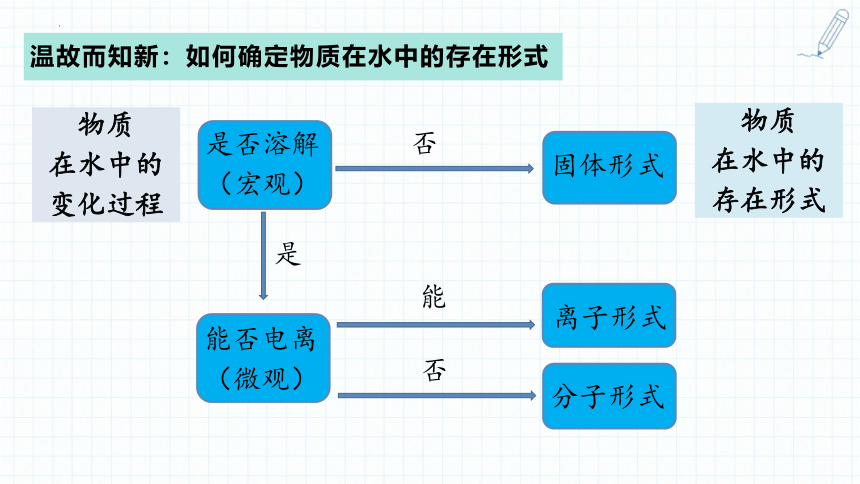
温故而知新:如何确定物质在水中的存在形式
物质
在水中的
变化过程
是否溶解
(宏观)
否
固体形式
是
能否电离
(微观)
能
离子形式
否
分子形式
物质
在水中的
存在形式
Na2SO4溶液
任务一:从微观角度认识溶液中的化学反应
——Na2SO4溶液与BaCl2溶液混合为例
BaCl2溶液
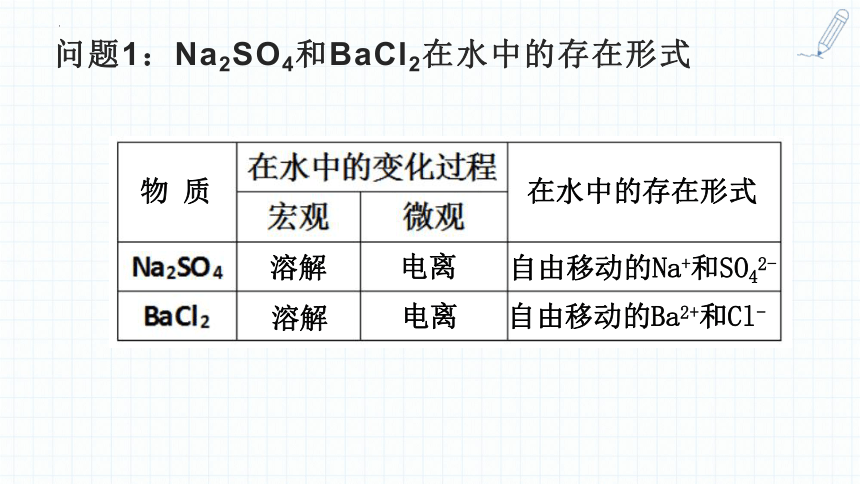
问题1:Na2SO4和BaCl2在水中的存在形式
在水中的存在形式
物 质
溶解
电离
自由移动的Na+和SO42-
溶解
电离
自由移动的Ba2+和Cl-
问题2:Na2SO4和BaCl2溶液混合有什么变化?
问题2:Na2SO4和BaCl2溶液混合有什么变化?
宏观现象
无色溶液
白色沉淀
无色溶液
无色溶液
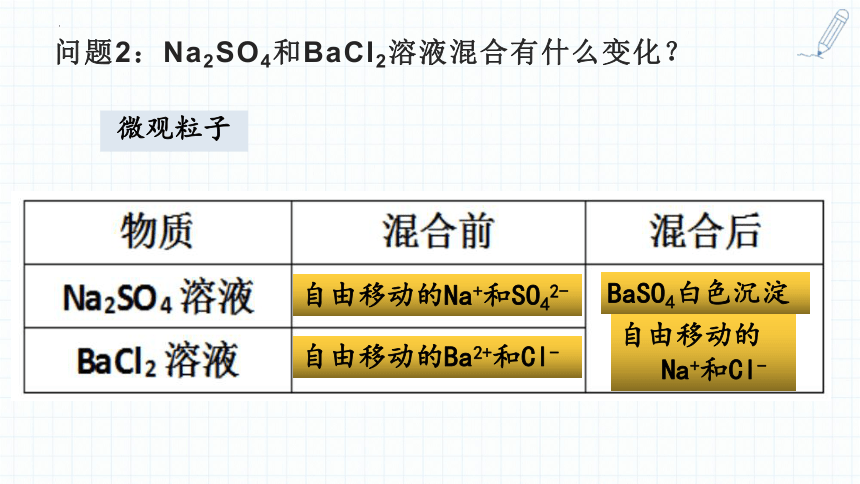
问题2:Na2SO4和BaCl2溶液混合有什么变化?
微观粒子
自由移动的Na+和SO42-
自由移动的Ba2+和Cl-
BaSO4白色沉淀
自由移动的
Na+和Cl-
Na2SO4溶液
BaCl2溶液
反应前
反应后
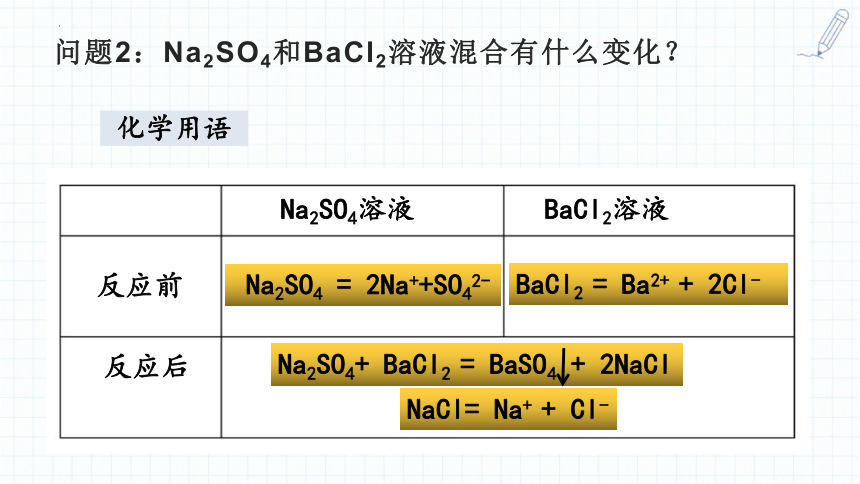
问题2:Na2SO4和BaCl2溶液混合有什么变化?
化学用语
Na2SO4 = 2Na++SO42-
BaCl2 = Ba2+ + 2Cl-
NaCl= Na+ + Cl-
Na2SO4+ BaCl2 = BaSO4 + 2NaCl
问题3:Na2SO4和BaCl2溶液反应的实质是什么?
2Na+
SO42-
Ba2+
2Cl-
Na+
Cl-
离子方程式
Na2SO4+ BaCl2 = BaSO4 + 2NaCl
2Na+ + SO42- + Ba2+ +2Cl- = 2Na+ + 2Cl- + BaSO4
宏观反应
微观离子
离子反应
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
任务一:从微观角度认识溶液中的化学反应
任务一:从微观角度认识溶液中的化学反应
——Na2SO4溶液与BaCl2溶液混合为例
Na2SO4+ BaCl2 = 2NaCl + BaSO4
宏观反应
2Na+ + SO42- + Ba2+ +2Cl- = 2Na+ + 2Cl- + BaSO4
微观离子
离子方程式
SO42- + Ba2+ = BaSO4
2Na+ + SO42- + Ba2+ +2Cl- = 2Na+ + 2Cl- + BaSO4
书写离子方程式的一般步骤
写
拆
删
查
任务二:下列物质混合能否发生反应,能够发生的,
写出离子方程式。
1.将Na2CO3与稀盐酸溶液混合
2.将KCl与NaOH溶液混合
3.稀盐酸与NaOH溶液混合
4.稀盐酸与KOH溶液混合
5.稀硫酸与NaOH溶液混合
6.稀硫酸与KOH溶液混合
复分解反应
酸、碱、盐
沉淀、气体、水
1.将Na2CO3与稀盐酸溶液混合
宏观物质
Na2CO3+2HCl = CaCl2+H2O+CO2
微观粒子
2Na+ + CO32- + 2H++ 2Cl- = 2Na++2Cl- + H2O + CO2
离子方程式
CO32- + 2H+ = H2O + CO2
宏观物质
HCl + NaOH = NaCl + H2O
微观粒子
H++ Cl- + Na+ + OH-= Na+ + Cl- + H2O
离子方程式
H+ + OH- = H2O
3.将稀盐酸与NaOH溶液混合
宏观物质
HCl + KOH = KCl + H2O
微观粒子
H++ Cl- + K+ + OH-= K+ + Cl- + H2O
离子方程式
H+ + OH- = H2O
4.将稀盐酸与KOH溶液混合
宏观物质
H2SO4 + 2NaOH = Na2SO4 + 2H2O
微观粒子
2H++ SO42- + 2Na+ + 2OH-= 2Na+ + SO42- + 2H2O
离子方程式
2H+ + 2OH- = 2H2O
5.将稀硫酸与NaOH溶液混合
H+ + OH- = H2O
宏观物质
H2SO4 + 2KOH = K2SO4 + 2H2O
微观粒子
2H++ SO42- + 2K+ + 2OH-= 2K+ + SO42- + 2H2O
离子方程式
2H+ + 2OH- = 2H2O
6.将稀硫酸与KOH溶液混合
H+ + OH- = H2O
不反应
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
SO42- + Ba2+ = BaSO4
离子反应条件
酸、碱、盐
沉淀、气体、水
H+ + OH- = H2O
离子反应条件
CO32- + 2H+ = H2O + CO2
注意:离子共存问题
(1)发生复分解反应的离子不能大量共存
①生成沉淀:例如Ag+与Cl-,Ba2+和SO42-不能共存;
②生成气体:例如CO32-、HCO3-等酸根离子不能跟H+大量共存;
③生成H2O:如H+和OH-生成H2O而不能共存。
(2)审题时应注意题中给出的附加条件
①无色溶液中不存在有色离子:如Cu2+、Fe3+、Fe2+、MnO4-等都有颜色。
②注意挖掘某些隐含离子:酸性溶液(或pH﹤7)中隐含有H+,碱性溶
液(或pH﹥7)中隐含有OH-。
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
SO42- + Ba2+ = BaSO4
不反应
可以表示某个具体的化学反应
也可以表示同一类型的离子反应
离子反应的意义
CO32- + 2H+ = H2O + CO2
分析Zn与稀硫酸反应的实质
思考:
Zn + H2SO4 = ZnSO4 + H2
化学方程式
微观粒子
离子方程式
Zn + 2H+ + SO42- = Zn2++SO42- + H2
Zn + 2H+ = Zn2+ + H2
离子反应
注意:书写离子方程式常见的错误
1.不符合客观事实
2.化学式拆分不正确
3.不符合三个守恒(质量、得失电子、电荷)
4.漏掉部分参加反应的离子
5.忽视反应物的阴阳离子配比
沉淀、气体、水、弱酸、弱碱、HCO3-等不能拆分
如:铁与稀盐酸反应
2Fe+6H+ ==2Fe3++3H2↑
1.离子方程式正误判断依据
(1)以客观事实为依据
(2)以质量守恒为依据
如:铝与稀盐酸反应
Al+3H+ == Al3++H2↑
【学与用】
(3)以电荷守恒为依据
如:氯化铁溶液与铁反应:2Fe3++Fe == 3Fe2+
Fe3++Fe ==2Fe2+
(4)以物质的实际状态为依据
如:碳酸钡和稀硝酸反应
CO32-+2H+ == H2O+CO2↑
BaCO3+2H+ == Ba2++H2O+CO2↑
(5)以物质的组成为依据
如:氢氧化钡溶液和稀硫酸反应
Ba2++SO42-==BaSO4↓
Ba2++OH-+H++SO42-==BaSO4↓+H2O
Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O
任务三:探究稀硫酸与Ba(OH)2溶液的反应
活动1:理论分析稀硫酸与Ba(OH)2反应的实质
宏观物质
微观粒子
离子方程式
H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
2H++SO42- + Ba2++2OH- = BaSO4 + 2H2O
2H++SO42- + Ba2++2OH- = BaSO4 + 2H2O
活动2:设计实验,证明稀硫酸与Ba(OH)2溶液混合前后
溶液中的离子变化
离子方程式
2H++SO42- + Ba2++2OH- = BaSO4 + 2H2O
方案1:向Ba(OH)2溶液中滴入几滴酚酞溶液,然后向滴有酚酞
的Ba(OH)2溶液中滴加稀硫酸溶液,然后观察现象。
H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
化学方程式
方案2:测试稀硫酸与Ba(OH)2混合溶液的导电能力。
H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
反应方程式
H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
反应方程式
活动3:解释稀硫酸与Ba(OH)2反应的现象
化学方程式
H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
溶液中的离子数目不断减少
H+ + OH- = H2O
1.红色消失
2.出现白色沉淀
3.电流计指针归零
宏观现象
微观解释
SO42- + Ba2+ = BaSO4
CaCO3 + 2H+ = Ca2+ + H2O + CO2
CaCO3 + 2HCl = CaCl2 + H2O + CO2
1.加盐酸或硫酸
2.加MgCl2
H+ + OH- = H2O
Mg2+ + 2OH- = Mg(OH)2
1.下列离子反应不能发生的是( )
A.HCl+NaOH==NaCl+H2O
B.AgNO3+NaCl==AgCl↓+NaNO3
C.KHCO3+HCl==KCl+CO2↑+H2O
D.2HCl+Na2SO4==2NaCl+H2SO4
D
2.下列反应的离子方程式书写正确的是( )
A.铜片插入硝酸银溶液中:Cu+Ag+==Cu2++Ag
B.大理石溶于盐酸的反应:CO32-+2H+==CO2↑+H2O
C.钠与水反应:Na+2H2O==Na++2OH-+H2↑
D.硝酸银溶液中滴入食盐水:Cl-+Ag+==AgCl↓
D
3.下列反应中可用离子方程式H++OH-=H2O表示的是 ( )
A.NH4Cl+NaOH==NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl==MgCl2+2H2O
C.NaOH+NaHCO3==Na2CO3+H2O
D.NaOH+HNO3==NaNO3+H2O
D
△
4.下列各组中的离子,能在溶液中大量共存的是 ( )
A. K+ H+ SO42- OH-
B. Na+ Ca2+ CO32- NO3-
C. Na+ H+ Cl- CO32-
D. Na+ Cu2+ Cl- SO42-
D
离子反应
人教版高中化学必修1
第二节 离子反应(第二课时)
温故而知新:如何判断某物质是否是电解质
1.宏观事实
——在水溶液或者熔融状态下能导电的化合物
2.微观粒子构成
——由离子构成的化合物
3.物质类别的角度
——酸、碱、盐及金属氧化物
温故而知新:如何确定物质在水中的存在形式
物质
在水中的
变化过程
是否溶解
(宏观)
否
固体形式
是
能否电离
(微观)
能
离子形式
否
分子形式
物质
在水中的
存在形式
Na2SO4溶液
任务一:从微观角度认识溶液中的化学反应
——Na2SO4溶液与BaCl2溶液混合为例
BaCl2溶液
问题1:Na2SO4和BaCl2在水中的存在形式
在水中的存在形式
物 质
溶解
电离
自由移动的Na+和SO42-
溶解
电离
自由移动的Ba2+和Cl-
问题2:Na2SO4和BaCl2溶液混合有什么变化?
问题2:Na2SO4和BaCl2溶液混合有什么变化?
宏观现象
无色溶液
白色沉淀
无色溶液
无色溶液
问题2:Na2SO4和BaCl2溶液混合有什么变化?
微观粒子
自由移动的Na+和SO42-
自由移动的Ba2+和Cl-
BaSO4白色沉淀
自由移动的
Na+和Cl-
Na2SO4溶液
BaCl2溶液
反应前
反应后
问题2:Na2SO4和BaCl2溶液混合有什么变化?
化学用语
Na2SO4 = 2Na++SO42-
BaCl2 = Ba2+ + 2Cl-
NaCl= Na+ + Cl-
Na2SO4+ BaCl2 = BaSO4 + 2NaCl
问题3:Na2SO4和BaCl2溶液反应的实质是什么?
2Na+
SO42-
Ba2+
2Cl-
Na+
Cl-
离子方程式
Na2SO4+ BaCl2 = BaSO4 + 2NaCl
2Na+ + SO42- + Ba2+ +2Cl- = 2Na+ + 2Cl- + BaSO4
宏观反应
微观离子
离子反应
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
任务一:从微观角度认识溶液中的化学反应
任务一:从微观角度认识溶液中的化学反应
——Na2SO4溶液与BaCl2溶液混合为例
Na2SO4+ BaCl2 = 2NaCl + BaSO4
宏观反应
2Na+ + SO42- + Ba2+ +2Cl- = 2Na+ + 2Cl- + BaSO4
微观离子
离子方程式
SO42- + Ba2+ = BaSO4
2Na+ + SO42- + Ba2+ +2Cl- = 2Na+ + 2Cl- + BaSO4
书写离子方程式的一般步骤
写
拆
删
查
任务二:下列物质混合能否发生反应,能够发生的,
写出离子方程式。
1.将Na2CO3与稀盐酸溶液混合
2.将KCl与NaOH溶液混合
3.稀盐酸与NaOH溶液混合
4.稀盐酸与KOH溶液混合
5.稀硫酸与NaOH溶液混合
6.稀硫酸与KOH溶液混合
复分解反应
酸、碱、盐
沉淀、气体、水
1.将Na2CO3与稀盐酸溶液混合
宏观物质
Na2CO3+2HCl = CaCl2+H2O+CO2
微观粒子
2Na+ + CO32- + 2H++ 2Cl- = 2Na++2Cl- + H2O + CO2
离子方程式
CO32- + 2H+ = H2O + CO2
宏观物质
HCl + NaOH = NaCl + H2O
微观粒子
H++ Cl- + Na+ + OH-= Na+ + Cl- + H2O
离子方程式
H+ + OH- = H2O
3.将稀盐酸与NaOH溶液混合
宏观物质
HCl + KOH = KCl + H2O
微观粒子
H++ Cl- + K+ + OH-= K+ + Cl- + H2O
离子方程式
H+ + OH- = H2O
4.将稀盐酸与KOH溶液混合
宏观物质
H2SO4 + 2NaOH = Na2SO4 + 2H2O
微观粒子
2H++ SO42- + 2Na+ + 2OH-= 2Na+ + SO42- + 2H2O
离子方程式
2H+ + 2OH- = 2H2O
5.将稀硫酸与NaOH溶液混合
H+ + OH- = H2O
宏观物质
H2SO4 + 2KOH = K2SO4 + 2H2O
微观粒子
2H++ SO42- + 2K+ + 2OH-= 2K+ + SO42- + 2H2O
离子方程式
2H+ + 2OH- = 2H2O
6.将稀硫酸与KOH溶液混合
H+ + OH- = H2O
不反应
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
SO42- + Ba2+ = BaSO4
离子反应条件
酸、碱、盐
沉淀、气体、水
H+ + OH- = H2O
离子反应条件
CO32- + 2H+ = H2O + CO2
注意:离子共存问题
(1)发生复分解反应的离子不能大量共存
①生成沉淀:例如Ag+与Cl-,Ba2+和SO42-不能共存;
②生成气体:例如CO32-、HCO3-等酸根离子不能跟H+大量共存;
③生成H2O:如H+和OH-生成H2O而不能共存。
(2)审题时应注意题中给出的附加条件
①无色溶液中不存在有色离子:如Cu2+、Fe3+、Fe2+、MnO4-等都有颜色。
②注意挖掘某些隐含离子:酸性溶液(或pH﹤7)中隐含有H+,碱性溶
液(或pH﹥7)中隐含有OH-。
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
SO42- + Ba2+ = BaSO4
不反应
可以表示某个具体的化学反应
也可以表示同一类型的离子反应
离子反应的意义
CO32- + 2H+ = H2O + CO2
分析Zn与稀硫酸反应的实质
思考:
Zn + H2SO4 = ZnSO4 + H2
化学方程式
微观粒子
离子方程式
Zn + 2H+ + SO42- = Zn2++SO42- + H2
Zn + 2H+ = Zn2+ + H2
离子反应
注意:书写离子方程式常见的错误
1.不符合客观事实
2.化学式拆分不正确
3.不符合三个守恒(质量、得失电子、电荷)
4.漏掉部分参加反应的离子
5.忽视反应物的阴阳离子配比
沉淀、气体、水、弱酸、弱碱、HCO3-等不能拆分
如:铁与稀盐酸反应
2Fe+6H+ ==2Fe3++3H2↑
1.离子方程式正误判断依据
(1)以客观事实为依据
(2)以质量守恒为依据
如:铝与稀盐酸反应
Al+3H+ == Al3++H2↑
【学与用】
(3)以电荷守恒为依据
如:氯化铁溶液与铁反应:2Fe3++Fe == 3Fe2+
Fe3++Fe ==2Fe2+
(4)以物质的实际状态为依据
如:碳酸钡和稀硝酸反应
CO32-+2H+ == H2O+CO2↑
BaCO3+2H+ == Ba2++H2O+CO2↑
(5)以物质的组成为依据
如:氢氧化钡溶液和稀硫酸反应
Ba2++SO42-==BaSO4↓
Ba2++OH-+H++SO42-==BaSO4↓+H2O
Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O
任务三:探究稀硫酸与Ba(OH)2溶液的反应
活动1:理论分析稀硫酸与Ba(OH)2反应的实质
宏观物质
微观粒子
离子方程式
H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
2H++SO42- + Ba2++2OH- = BaSO4 + 2H2O
2H++SO42- + Ba2++2OH- = BaSO4 + 2H2O
活动2:设计实验,证明稀硫酸与Ba(OH)2溶液混合前后
溶液中的离子变化
离子方程式
2H++SO42- + Ba2++2OH- = BaSO4 + 2H2O
方案1:向Ba(OH)2溶液中滴入几滴酚酞溶液,然后向滴有酚酞
的Ba(OH)2溶液中滴加稀硫酸溶液,然后观察现象。
H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
化学方程式
方案2:测试稀硫酸与Ba(OH)2混合溶液的导电能力。
H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
反应方程式
H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
反应方程式
活动3:解释稀硫酸与Ba(OH)2反应的现象
化学方程式
H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
溶液中的离子数目不断减少
H+ + OH- = H2O
1.红色消失
2.出现白色沉淀
3.电流计指针归零
宏观现象
微观解释
SO42- + Ba2+ = BaSO4
CaCO3 + 2H+ = Ca2+ + H2O + CO2
CaCO3 + 2HCl = CaCl2 + H2O + CO2
1.加盐酸或硫酸
2.加MgCl2
H+ + OH- = H2O
Mg2+ + 2OH- = Mg(OH)2
1.下列离子反应不能发生的是( )
A.HCl+NaOH==NaCl+H2O
B.AgNO3+NaCl==AgCl↓+NaNO3
C.KHCO3+HCl==KCl+CO2↑+H2O
D.2HCl+Na2SO4==2NaCl+H2SO4
D
2.下列反应的离子方程式书写正确的是( )
A.铜片插入硝酸银溶液中:Cu+Ag+==Cu2++Ag
B.大理石溶于盐酸的反应:CO32-+2H+==CO2↑+H2O
C.钠与水反应:Na+2H2O==Na++2OH-+H2↑
D.硝酸银溶液中滴入食盐水:Cl-+Ag+==AgCl↓
D
3.下列反应中可用离子方程式H++OH-=H2O表示的是 ( )
A.NH4Cl+NaOH==NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl==MgCl2+2H2O
C.NaOH+NaHCO3==Na2CO3+H2O
D.NaOH+HNO3==NaNO3+H2O
D
△
4.下列各组中的离子,能在溶液中大量共存的是 ( )
A. K+ H+ SO42- OH-
B. Na+ Ca2+ CO32- NO3-
C. Na+ H+ Cl- CO32-
D. Na+ Cu2+ Cl- SO42-
D
