第一单元金属和金属材料单元测试题-2022-2023学年九年级化学人教版(五四学制)全一册(有答案)
文档属性
| 名称 | 第一单元金属和金属材料单元测试题-2022-2023学年九年级化学人教版(五四学制)全一册(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 165.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-07 06:11:51 | ||
图片预览


文档简介
第一单元金属和金属材料单元测试题
一、单选题
1.北斗系统的全面建成彰显了中国航天的力量,在航天科技中会用到大量金属材料。下列有关金属材科的说法正确的是( )
A.合金中一定只含金属元素
B.纯铜比黄铜的硬度更大
C.生锈的钢铁制品没有回收价值
D.钛和钛合金被广泛用于火箭、导弹等
2.下列变化不属于化学变化的是( )
A.铁生锈 B.铜器产生铜绿
C.湿法炼铜 D.铁被磁化
3.现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,仅X溶解并产生氢气;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上事实,对X、Y、Z三种金属活动性顺序判断正确的是
A.X >Y>(H)>Z B.X>(H)>Y>Z C.Y>(H)>X>Z D.Y>X> (H)>Z
4.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是
A.MgCl2溶液、Cu、Sn
B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸
D.MgCl2溶液、Sn、CuCl2溶液
5.明代宋应星著的《天工开物》中有关于“火法”冶炼金属锌的工艺记载:“炉甘石(注:主要成分是碳酸锌)十斤,装载入一泥罐内,然后逐层用煤炭饼(注:反应后生成一氧化碳)垫盛,其底铺薪,发火煅红,冷淀,毁罐取出,即倭铅也”。下列说法错误的是
A.煤炭中起作用的主要成分是C
B.冶炼Zn的现象为:
C.该冶炼锌的反应属于置换反应
D.倭铅是指金属锌和铅的混合物
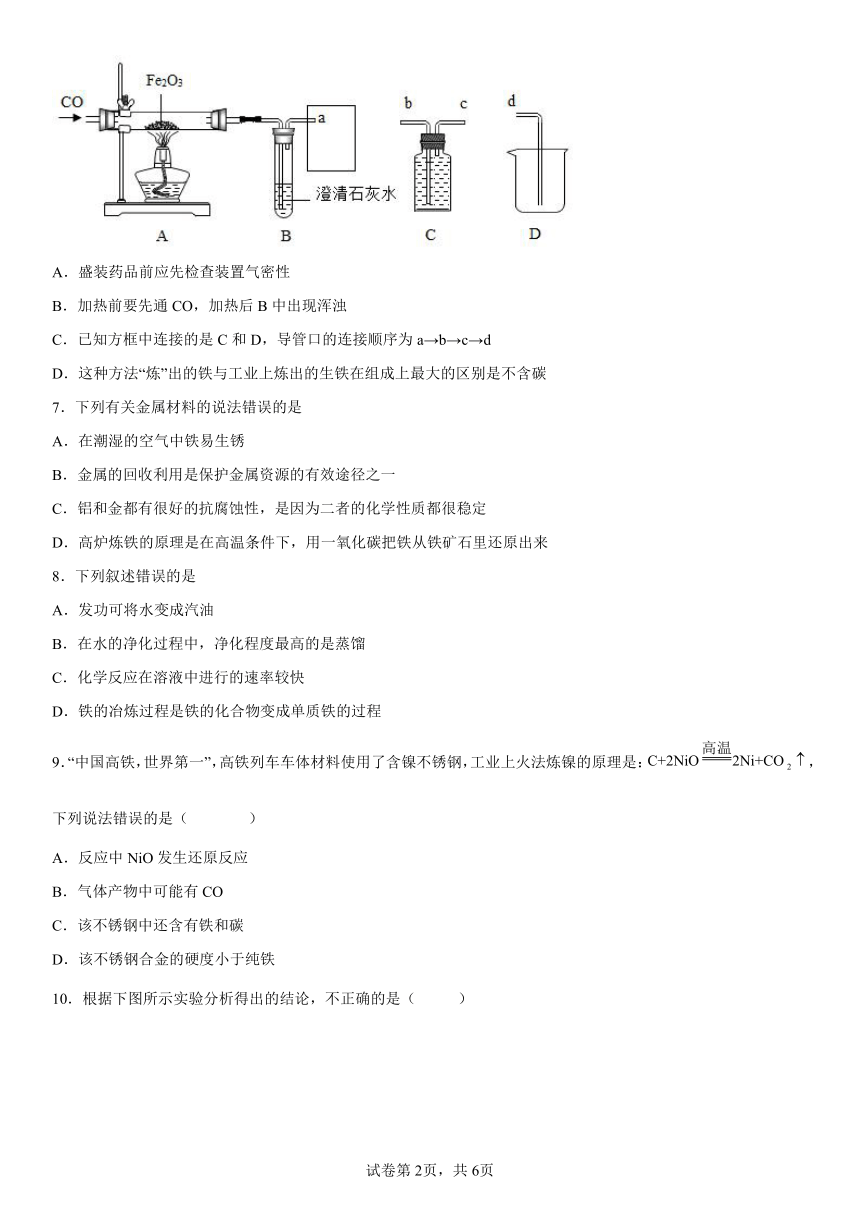
6.某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A.盛装药品前应先检查装置气密性
B.加热前要先通CO,加热后B中出现浑浊
C.已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D.这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
7.下列有关金属材料的说法错误的是
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
8.下列叙述错误的是
A.发功可将水变成汽油
B.在水的净化过程中,净化程度最高的是蒸馏
C.化学反应在溶液中进行的速率较快
D.铁的冶炼过程是铁的化合物变成单质铁的过程
9.“中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:,下列说法错误的是( )
A.反应中NiO发生还原反应
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
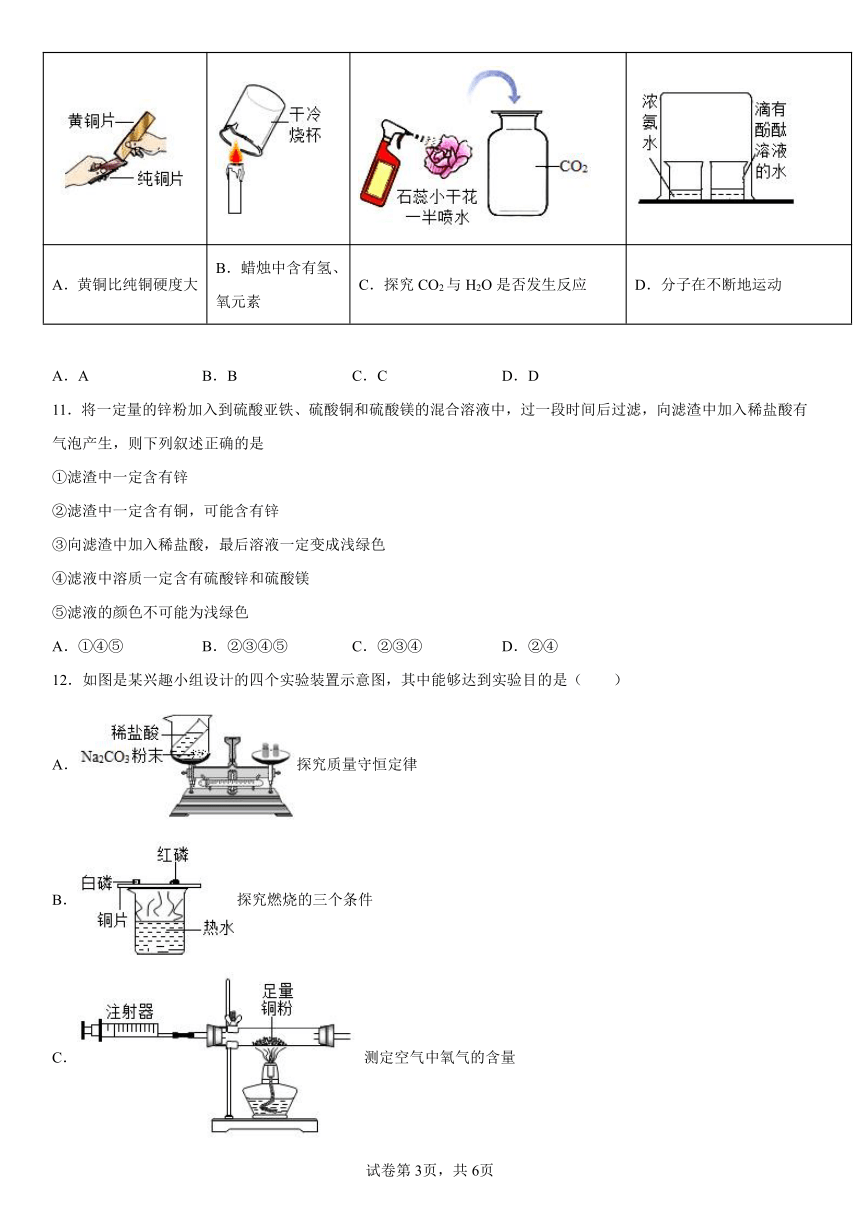
10.根据下图所示实验分析得出的结论,不正确的是( )
A.黄铜比纯铜硬度大 B.蜡烛中含有氢、氧元素 C.探究CO2与H2O是否发生反应 D.分子在不断地运动
A.A B.B C.C D.D
11.将一定量的锌粉加入到硫酸亚铁、硫酸铜和硫酸镁的混合溶液中,过一段时间后过滤,向滤渣中加入稀盐酸有气泡产生,则下列叙述正确的是
①滤渣中一定含有锌
②滤渣中一定含有铜,可能含有锌
③向滤渣中加入稀盐酸,最后溶液一定变成浅绿色
④滤液中溶质一定含有硫酸锌和硫酸镁
⑤滤液的颜色不可能为浅绿色
A.①④⑤ B.②③④⑤ C.②③④ D.②④
12.如图是某兴趣小组设计的四个实验装置示意图,其中能够达到实验目的是( )
A.探究质量守恒定律
B.探究燃烧的三个条件
C. 测定空气中氧气的含量
D.探究铁生锈的条件
二、填空题
13.2018年8月9日,一车600公斤,厚度仅为0.02毫米的不锈钢从我国运往德国,这是目前中国制造的最薄的不锈钢,厚度仅有A4纸四分之一,也叫“手撕钢”(见图),它可以轻而易举地被撕碎,主要应用于航空航天、石油化工、计算机等领域。
(1)普通钢材可以加工成“手撕钢”这种极薄的金属片,是因为金属具有_____性。
(2)“手撕钢”是一种铁合金,下列说法不正确的是_____(填序号)。
①“手撕钢”的性能比生铁优越
②“手撕钢”能完全溶解在盐酸中
③“手撕钢”的含碳量比生铁高
14.小聪总喜欢动手做实验,在学完金属材料内容后,小聪同学参照教材中的家庭小实验,做了如下探究:
①取两根铁丝用砂纸擦净.用镊子夹住放在火焰上烧至红热后,立即放入冷水中.冷却后取出其中一根.用手试验能否将其弯曲.
②用镊子夹住另一根铁丝,放在火焰上微热片刻(不烧红),然后放在空气中自然冷却,再试验其能否弯曲.
根据以上探究回答:
(1)步骤①的金属热处理方法叫________,处理后的铁丝能否被弯曲?________(填“能”或“不能”);步骤②的金属热处理方法叫________,处理后的铁丝能否被弯曲?________(填“能”或“不能”).
(2)试比较两根经不同热处理的铁丝的硬度:________________.
(3)若要使一根硬的铁丝恢复韧性,工业上一般采取的热处理方法是________.
15.金属在生产、生活和社会发展中的应用较为广泛。
(1)铜丝,铝丝常用作导线,是因为它们具有良好的______性。
(2)早在明代宋应星所著的《天工开物》里就对铁器的生产和使用有所记载,到了现代,炼铁技术得到进一步发展。炼铁的原理是利用一氧化碳与氧化铁的反应,请写出该反应的现象_______,该反应_______(填“属于”或“不属于”)置换反应。
(3)钢窗表面喷漆不仅美观,而且可有效防止铁与空气中的_____触而生锈。
(4)某同学对含X、Y、铜、银四种金属的混合物进行如下探究,根据实验流程回答下列问题:
①四种金属的活动性由强到弱的顺序是 _______。
②滤液C中所含溶质的成分可能有______种情况。
16.金属钯是稀有的贵重金属之一,金属钯制成的首饰不仅有迷人的光彩,而且经得住岁月的磨砺。现有银(Ag)、铂(Pt)、钯(Pd)三种金属制成的戒指,某实验小组利用它们来探究三种金属的活动性。
(1)把钯戒指放入稀硫酸溶液中,戒指完好无损,可推测钯在金属活动性顺序表中位于铁之_____(填“前”或“后”)。
(2)如果将钯粉置于盐酸溶液中,边通入氧气边搅拌,钯粉溶解得到二氯化钯(PdCl2)溶液,该反应的现象为 _____________________________。
(3)如上图所示,将银、铂戒指分别放入甲、乙两烧杯中,一段时间后取出,发现只有银戒指表面有明显变化,推测甲烧杯中还可能出现的现象是________________________ ,通过该实验判断,银、铂、钯的金属活动性由强到弱顺序为 __________。
三、实验题
17.下图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:
(1)描述A中的实验现象________。
(2)写出C中反应的现象__________。
(3)要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是___________(填序号)。
(4)开始反应后D中溶液逐渐变为黄色,原因是__________。
18.铁矿石是怎样炼成铁的呢?某活动小组在实验室模拟了铁矿石炼铁化学原理,如图所示。
(1)该活动小组将实验装置组装好后,设计了下列实验操作步骤:①给玻璃管加热;②停止加热;③通入一氧化碳气体;④停止通入一氧化碳气体。正确的操作步骤是____________(填序号);
(2)实验过程中,玻璃管中固体由________色变成________色,玻璃管中反应的现象是____________________________________,试管中出现的现象是______________;
(3)图中有一处明显错误,请说明改进方法______________________________。
四、计算题
19.镁铜合金常用于制飞机天线,为测定某镁铜合金中镁的质量分数,某小组取6g镁铜合金粉末,向其中缓慢加入稀硫酸,加入稀硫酸的质量与产生氢气的质量关系如图所示。请回答下列问题:
(1)镁铜合金粉末与稀硫酸充分反应产生氢气的质量为 g。
(2)计算镁铜合金粉末中镁的质量分数;
(3)加入50g稀硫酸,理论上充分反应后溶液中镁元素的质量为多少?
20.某化工厂产生的废液中含有硫酸亚铁和硫酸铜(不考虑其它物质),为回收铜和硫酸亚铁,研究人员设计出“用铁处理”的方案,取100g上述废液,向其中加入2.8g铁粉,恰好完全反应,测得反应后溶液中溶质的质量分数为15%,求:
⑴回收得到铜的质量为多少_______?
⑵回收得到硫酸亚铁的质量是_____g(计算结果保留两位小数)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.B
4.A
5.D
6.C
7.C
8.A
9.D
10.B
11.D
12.C
13. (1) 延展 (2) ②
14. (1) 淬火 不能 (2) 回火 能 (3)淬火后的硬度大 回火
15. (1) 导电 不属于 (2) 氧气和水 (3)Y>X>铜>银 3
16.(1) 后 有白色沉淀 (2) 银 钯 铂
17. (1) 铜丝表面附着一层银白色固体,溶液变为蓝色 (2) A、B (3) 铁钉未打磨有铁锈或溶液中有Fe2(SO4)3生成
18. (1) ③①②④ 红棕 黑 (2) 澄清石灰水变浑浊 (3) 尾气点燃或收集
19.(1)0.4
(2)解:设镁铜合金粉末中镁的质量为x
x=4.8g
答:镁铜合金粉末中镁的质量分数为80%
(3)有图像可知6g镁铜合金粉末(其中含有4.8g镁)与100g稀硫酸恰好反应,如果加入50g稀硫酸,理论上反应的镁元素的质量为2.4g;根据质量守恒定律反应前后元素质量、种类不发生改变,那么理论上充分反应后溶液中镁元素的质量为2.4g
20.(1)3.2g,(2)14.94g
答案第1页,共2页
答案第1页,共2页
一、单选题
1.北斗系统的全面建成彰显了中国航天的力量,在航天科技中会用到大量金属材料。下列有关金属材科的说法正确的是( )
A.合金中一定只含金属元素
B.纯铜比黄铜的硬度更大
C.生锈的钢铁制品没有回收价值
D.钛和钛合金被广泛用于火箭、导弹等
2.下列变化不属于化学变化的是( )
A.铁生锈 B.铜器产生铜绿
C.湿法炼铜 D.铁被磁化
3.现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,仅X溶解并产生氢气;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上事实,对X、Y、Z三种金属活动性顺序判断正确的是
A.X >Y>(H)>Z B.X>(H)>Y>Z C.Y>(H)>X>Z D.Y>X> (H)>Z
4.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是
A.MgCl2溶液、Cu、Sn
B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸
D.MgCl2溶液、Sn、CuCl2溶液
5.明代宋应星著的《天工开物》中有关于“火法”冶炼金属锌的工艺记载:“炉甘石(注:主要成分是碳酸锌)十斤,装载入一泥罐内,然后逐层用煤炭饼(注:反应后生成一氧化碳)垫盛,其底铺薪,发火煅红,冷淀,毁罐取出,即倭铅也”。下列说法错误的是
A.煤炭中起作用的主要成分是C
B.冶炼Zn的现象为:
C.该冶炼锌的反应属于置换反应
D.倭铅是指金属锌和铅的混合物
6.某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A.盛装药品前应先检查装置气密性
B.加热前要先通CO,加热后B中出现浑浊
C.已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D.这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
7.下列有关金属材料的说法错误的是
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
8.下列叙述错误的是
A.发功可将水变成汽油
B.在水的净化过程中,净化程度最高的是蒸馏
C.化学反应在溶液中进行的速率较快
D.铁的冶炼过程是铁的化合物变成单质铁的过程
9.“中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:,下列说法错误的是( )
A.反应中NiO发生还原反应
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
10.根据下图所示实验分析得出的结论,不正确的是( )
A.黄铜比纯铜硬度大 B.蜡烛中含有氢、氧元素 C.探究CO2与H2O是否发生反应 D.分子在不断地运动
A.A B.B C.C D.D
11.将一定量的锌粉加入到硫酸亚铁、硫酸铜和硫酸镁的混合溶液中,过一段时间后过滤,向滤渣中加入稀盐酸有气泡产生,则下列叙述正确的是
①滤渣中一定含有锌
②滤渣中一定含有铜,可能含有锌
③向滤渣中加入稀盐酸,最后溶液一定变成浅绿色
④滤液中溶质一定含有硫酸锌和硫酸镁
⑤滤液的颜色不可能为浅绿色
A.①④⑤ B.②③④⑤ C.②③④ D.②④
12.如图是某兴趣小组设计的四个实验装置示意图,其中能够达到实验目的是( )
A.探究质量守恒定律
B.探究燃烧的三个条件
C. 测定空气中氧气的含量
D.探究铁生锈的条件
二、填空题
13.2018年8月9日,一车600公斤,厚度仅为0.02毫米的不锈钢从我国运往德国,这是目前中国制造的最薄的不锈钢,厚度仅有A4纸四分之一,也叫“手撕钢”(见图),它可以轻而易举地被撕碎,主要应用于航空航天、石油化工、计算机等领域。
(1)普通钢材可以加工成“手撕钢”这种极薄的金属片,是因为金属具有_____性。
(2)“手撕钢”是一种铁合金,下列说法不正确的是_____(填序号)。
①“手撕钢”的性能比生铁优越
②“手撕钢”能完全溶解在盐酸中
③“手撕钢”的含碳量比生铁高
14.小聪总喜欢动手做实验,在学完金属材料内容后,小聪同学参照教材中的家庭小实验,做了如下探究:
①取两根铁丝用砂纸擦净.用镊子夹住放在火焰上烧至红热后,立即放入冷水中.冷却后取出其中一根.用手试验能否将其弯曲.
②用镊子夹住另一根铁丝,放在火焰上微热片刻(不烧红),然后放在空气中自然冷却,再试验其能否弯曲.
根据以上探究回答:
(1)步骤①的金属热处理方法叫________,处理后的铁丝能否被弯曲?________(填“能”或“不能”);步骤②的金属热处理方法叫________,处理后的铁丝能否被弯曲?________(填“能”或“不能”).
(2)试比较两根经不同热处理的铁丝的硬度:________________.
(3)若要使一根硬的铁丝恢复韧性,工业上一般采取的热处理方法是________.
15.金属在生产、生活和社会发展中的应用较为广泛。
(1)铜丝,铝丝常用作导线,是因为它们具有良好的______性。
(2)早在明代宋应星所著的《天工开物》里就对铁器的生产和使用有所记载,到了现代,炼铁技术得到进一步发展。炼铁的原理是利用一氧化碳与氧化铁的反应,请写出该反应的现象_______,该反应_______(填“属于”或“不属于”)置换反应。
(3)钢窗表面喷漆不仅美观,而且可有效防止铁与空气中的_____触而生锈。
(4)某同学对含X、Y、铜、银四种金属的混合物进行如下探究,根据实验流程回答下列问题:
①四种金属的活动性由强到弱的顺序是 _______。
②滤液C中所含溶质的成分可能有______种情况。
16.金属钯是稀有的贵重金属之一,金属钯制成的首饰不仅有迷人的光彩,而且经得住岁月的磨砺。现有银(Ag)、铂(Pt)、钯(Pd)三种金属制成的戒指,某实验小组利用它们来探究三种金属的活动性。
(1)把钯戒指放入稀硫酸溶液中,戒指完好无损,可推测钯在金属活动性顺序表中位于铁之_____(填“前”或“后”)。
(2)如果将钯粉置于盐酸溶液中,边通入氧气边搅拌,钯粉溶解得到二氯化钯(PdCl2)溶液,该反应的现象为 _____________________________。
(3)如上图所示,将银、铂戒指分别放入甲、乙两烧杯中,一段时间后取出,发现只有银戒指表面有明显变化,推测甲烧杯中还可能出现的现象是________________________ ,通过该实验判断,银、铂、钯的金属活动性由强到弱顺序为 __________。
三、实验题
17.下图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:
(1)描述A中的实验现象________。
(2)写出C中反应的现象__________。
(3)要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是___________(填序号)。
(4)开始反应后D中溶液逐渐变为黄色,原因是__________。
18.铁矿石是怎样炼成铁的呢?某活动小组在实验室模拟了铁矿石炼铁化学原理,如图所示。
(1)该活动小组将实验装置组装好后,设计了下列实验操作步骤:①给玻璃管加热;②停止加热;③通入一氧化碳气体;④停止通入一氧化碳气体。正确的操作步骤是____________(填序号);
(2)实验过程中,玻璃管中固体由________色变成________色,玻璃管中反应的现象是____________________________________,试管中出现的现象是______________;
(3)图中有一处明显错误,请说明改进方法______________________________。
四、计算题
19.镁铜合金常用于制飞机天线,为测定某镁铜合金中镁的质量分数,某小组取6g镁铜合金粉末,向其中缓慢加入稀硫酸,加入稀硫酸的质量与产生氢气的质量关系如图所示。请回答下列问题:
(1)镁铜合金粉末与稀硫酸充分反应产生氢气的质量为 g。
(2)计算镁铜合金粉末中镁的质量分数;
(3)加入50g稀硫酸,理论上充分反应后溶液中镁元素的质量为多少?
20.某化工厂产生的废液中含有硫酸亚铁和硫酸铜(不考虑其它物质),为回收铜和硫酸亚铁,研究人员设计出“用铁处理”的方案,取100g上述废液,向其中加入2.8g铁粉,恰好完全反应,测得反应后溶液中溶质的质量分数为15%,求:
⑴回收得到铜的质量为多少_______?
⑵回收得到硫酸亚铁的质量是_____g(计算结果保留两位小数)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.B
4.A
5.D
6.C
7.C
8.A
9.D
10.B
11.D
12.C
13. (1) 延展 (2) ②
14. (1) 淬火 不能 (2) 回火 能 (3)淬火后的硬度大 回火
15. (1) 导电 不属于 (2) 氧气和水 (3)Y>X>铜>银 3
16.(1) 后 有白色沉淀 (2) 银 钯 铂
17. (1) 铜丝表面附着一层银白色固体,溶液变为蓝色 (2) A、B (3) 铁钉未打磨有铁锈或溶液中有Fe2(SO4)3生成
18. (1) ③①②④ 红棕 黑 (2) 澄清石灰水变浑浊 (3) 尾气点燃或收集
19.(1)0.4
(2)解:设镁铜合金粉末中镁的质量为x
x=4.8g
答:镁铜合金粉末中镁的质量分数为80%
(3)有图像可知6g镁铜合金粉末(其中含有4.8g镁)与100g稀硫酸恰好反应,如果加入50g稀硫酸,理论上反应的镁元素的质量为2.4g;根据质量守恒定律反应前后元素质量、种类不发生改变,那么理论上充分反应后溶液中镁元素的质量为2.4g
20.(1)3.2g,(2)14.94g
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
