人教版九年级化学上册课件 6.3.2 一氧化碳(课件27页)
文档属性
| 名称 | 人教版九年级化学上册课件 6.3.2 一氧化碳(课件27页) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-08 17:17:38 | ||
图片预览


文档简介
(共27张PPT)
课题3 二氧化碳和一氧化碳
第2课时 一氧化碳
第六单元 碳和碳的氧化物
情景导入
在农村常见一种取暖炉,通过燃烧炉中的木柴或者木炭来使室内升温。取暖炉一般都有一根长长的排烟管通向室外,如果没有排烟管会有什么隐患?
合作探究
探究点1
一氧化碳的物理性质
提出问题
我们经常能听到煤气中毒的事例,煤气中毒实际就是指一氧化碳中毒。那么一氧化碳有没有颜色?有没有气味?能否溶于水呢?
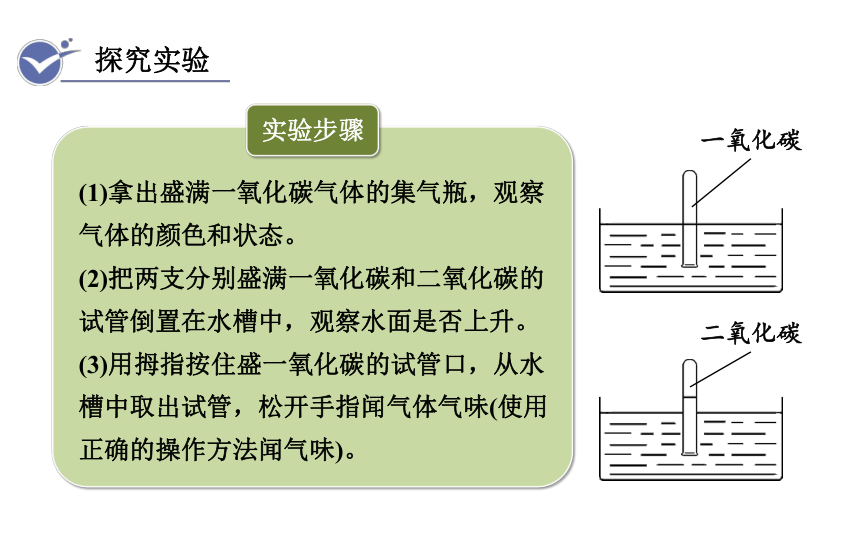
探究实验
实验步骤
(1)拿出盛满一氧化碳气体的集气瓶,观察气体的颜色和状态。
(2)把两支分别盛满一氧化碳和二氧化碳的试管倒置在水槽中,观察水面是否上升。
(3)用拇指按住盛一氧化碳的试管口,从水槽中取出试管,松开手指闻气体气味(使用正确的操作方法闻气味)。
一氧化碳
二氧化碳
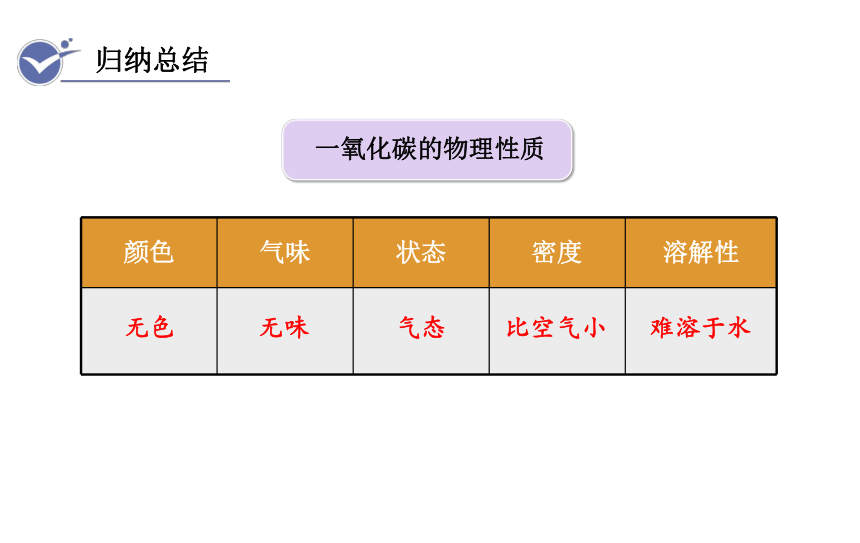
归纳总结
颜色 气味 状态 密度 溶解性
无色
无味
气态
比空气小
难溶于水
一氧化碳的物理性质
探究点2
一氧化碳的化学性质
(一) 可燃性
提出问题
碳的氧化物除了二氧化碳外还有一氧化碳,从物质的组成和构成的角度分析,它们有什么异同?它们的性质是否相同?
归纳总结
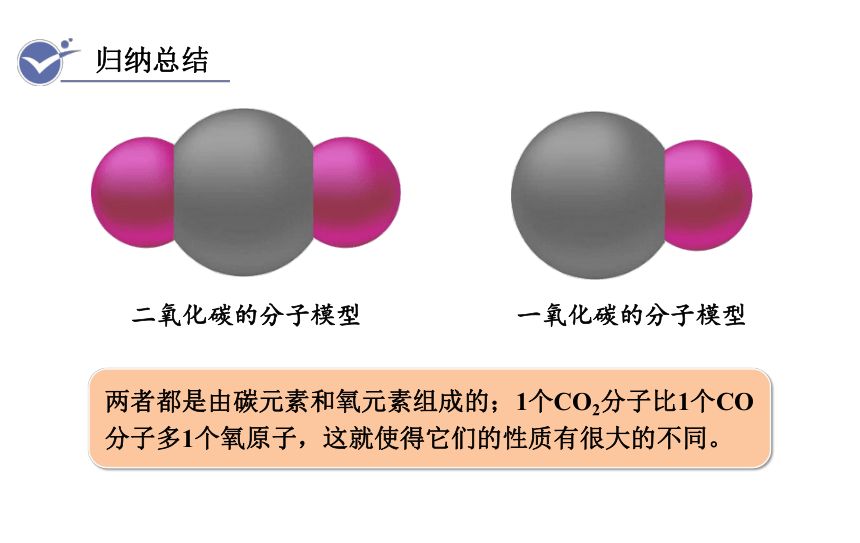
二氧化碳的分子模型
一氧化碳的分子模型
两者都是由碳元素和氧元素组成的;1个CO2分子比1个CO分子多1个氧原子,这就使得它们的性质有很大的不同。
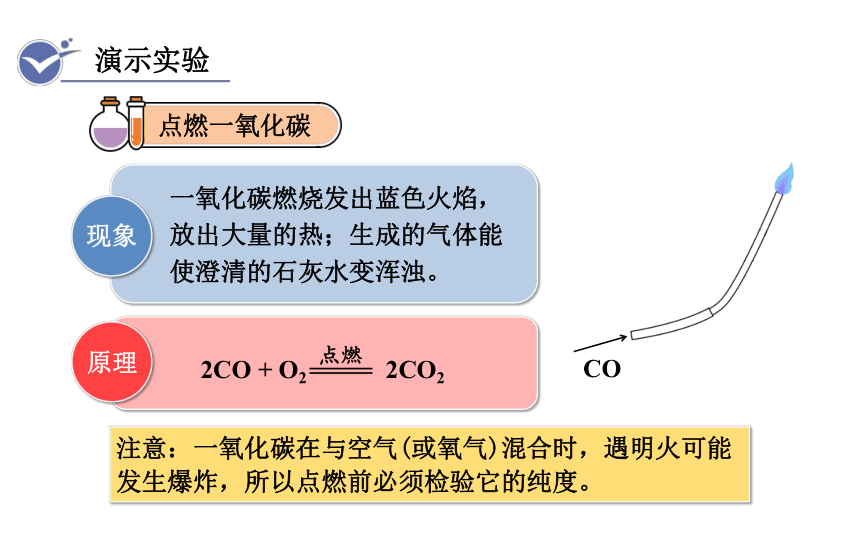
现象
原理
一氧化碳燃烧发出蓝色火焰,放出大量的热;生成的气体能使澄清的石灰水变浑浊。
2CO + O2 2CO2
点燃
CO
注意:一氧化碳在与空气(或氧气)混合时,遇明火可能发生爆炸,所以点燃前必须检验它的纯度。
演示实验
点燃一氧化碳
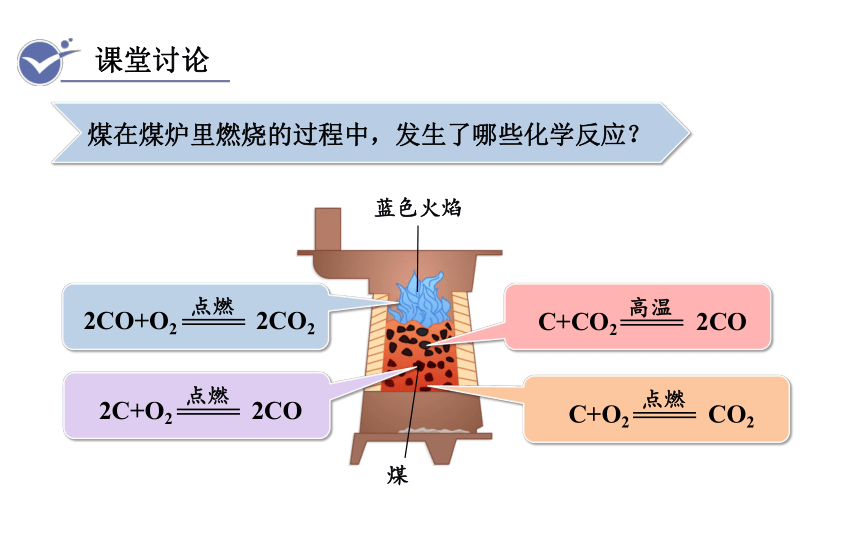
煤在煤炉里燃烧的过程中,发生了哪些化学反应?
蓝色火焰
煤
C+O2 CO2
点燃
2C+O2 2CO
点燃
C+CO2 2CO
高温
2CO+O2 2CO2
点燃
课堂讨论
中毒原因
防治措施
一氧化碳跟血液中的血红蛋白的结合能力比氧气强,使人体缺少氧气而窒息,甚至死亡。
用煤炉取暖时,注意通风。发生一氧化碳中毒时,轻者呼吸大量空气,重者送往医院治疗。
一氧化碳
血红蛋白
氧气
(二) 毒性
为了让人们易于察觉一氧化碳泄漏,以免一氧化碳中毒。
不对,因为一氧化碳既不溶于水,也不与水反应。
迅速关上煤气总开关,打开门窗,并且不要使用家里的任何电器。
课堂讨论
1.煤气厂为什么常在家用煤气(含CO)中掺入微量难闻气味的气体?
2.只要在煤炉边放一盆水,就可以预防煤气中毒了,这种说法对吗?
3.如果发生煤气泄露,我们该怎么办?
澄清石灰水
CuO
CO
(三) 还原性
演示实验
一氧化碳还原氧化铜
实验步骤
在玻璃管中放入CuO,先通入纯净的CO排净玻璃管中的空气,加热。实验完后先停止加热,继续通CO至冷却。
演示实验
现象
原理
黑色粉末变红,澄清的石灰水变浑浊。
CO + CuO Cu + CO2
△
一氧化碳还原氧化铜
澄清石灰水
CuO
CO
实验分析
一氧化碳在反应中夺取了氧化铜中的氧,使氧化铜还原成铜,同时生成二氧化碳。说明一氧化碳具有还原性,是这个反应的还原剂。这与碳单质的化学性质相似。从得氧、失氧的角度分析:氧化铜失氧,被还原(成铜),发生还原反应;氧化铜是氧化剂——具有氧化性。CO得到氧,被氧化(成CO2),发生氧化反应;CO是还原剂——具有还原性。
演示实验
先通入CO,目的是排尽装置内的空气,防止加热时发生爆炸。
防止生成的Cu再次被氧化;防止澄清石灰水倒流使试管炸裂。
课堂讨论
1. 实验前是先通入CO还是先加热CuO?为什么?
2.实验结束后,为什么要先停止加热,继续通入CO直至固体冷却?
口诀:气体早出晚归,酒精灯迟到早退。
在做CO还原CuO的实验中:
尾气含有有毒的CO。
可以用气球收集或直接点燃尾气,使其燃烧。
课堂讨论
3. 实验中的尾气为什么不能直接排入空气?
4.应该怎样处理尾气中的一氧化碳,防止对空气的污染?
(1)作气体燃料(可燃性)。
2CO + O2 2CO2
点燃
(2)冶炼金属(还原性)。
3CO + Fe2O3 2Fe + 3CO2
高温
探究点3
一氧化碳的用途
一氧化碳 二氧化碳
颜色、状态、气味
密度
溶解性
无色、无味、气体
无色、无味、气体
比空气略小
比空气大
难溶于水
能溶于水
CO和CO2的物理性质的比较
一氧化碳 二氧化碳
可燃性
与水反应
与石灰水 反应
氧化性或 还原性
有可燃性
一般不能跟水反应
不能跟石灰水反应
不能燃烧 ,一般也不能支持燃烧 ,也不能供给呼吸
在一定条件下具有氧化性
C+CO2 2CO
高温
有还原性
CO+CuO Cu+CO2
△
CO2 + H2O H2CO3
CO2+Ca(OH)2 CaCO3↓+H2O
CO和CO2的化学性质的比较
1.鉴别CO和CO2的方法有哪些?
①气体分别通入紫色石蕊溶液,试液变红的是CO2,不变的是CO。
②气体分别通入澄清石灰水,石灰水变浑浊的是CO2,不变的是CO。
③在尖嘴玻璃管口点火,气体被点燃的是CO,不能被点燃的是CO2。
课堂讨论
④分别通过灼热的氧化铜,氧化铜变红的是CO,不变的是CO2。
2.怎样除去CO混有的少量CO2?
3.怎样除去CO2混有的少量CO?
将混合气体通过足量的澄清石灰水。
CO2 + Ca(OH)2 CaCO3 ↓+ H2O
将混合气体通过足量灼热的氧化铜。
CO + CuO Cu + CO2
△
CO
CuO
CO、CO2
CO
澄清的石灰水
课堂讨论
随堂练习
1.关于一氧化碳的说法正确的是 ( )
A.一氧化碳易溶于水
B.一氧化碳分子中含有1个氧原子
C.一氧化碳中碳元素的化合价是+4价
D.一氧化碳中碳元素与氧元素的质量比为 3∶4
D
2.下列一氧化碳的性质中,属于化学性质的是( )
A.常温下为无色气体 B.难溶于水
C.没有气味 D.可以燃烧
D
随堂练习
3.导致人“煤气中毒”的物质是( )
A.氮气 B.氧气
C.一氧化碳 D.二氧化碳
C
4.下列有关CO与CO2的叙述正确的是 ( )
A.CO与CO2都会污染环境
B.CO与CO2中碳元素的化合价相同
C.在一定条件下,CO与CO2可以互相转化
D.CO2气体中混有少量的CO气体,可用点燃的方
法除去CO
C
随堂练习
5.下列符合如图所示装置设计意图的是 ( )
①说明CO具有还原性;②既说明CO具有可燃性又充分利用了能源;③说明CO得氧后的产物是CO2;④有效地防止了有剧毒的CO对空气的污染。
A.仅①② B.仅②④
C.仅②③④ D.①②③④
D
随堂练习
6.在CO、O2和CO2这些气体中,选择合适的气体填空。
(1)通入蒸馏水里,再滴加石蕊溶液,溶液呈红色,这种
气体是______。
(2)具有可燃性和还原性的气体是______。
(3)具有毒性的气体是______,原因是它易____________
________________________________________________
______________________。
CO2
CO
CO
与血液中的
随堂练习
血红蛋白结合,使血红蛋白不能再与氧气结合,造成生物体内缺氧而中毒
课堂小结
一氧化碳的性质
物理性质
无色、无味的气体,密度比空气小,难溶于水
化学性质
可燃性
毒性
还原性
用途
课题3 二氧化碳和一氧化碳
第2课时 一氧化碳
第六单元 碳和碳的氧化物
情景导入
在农村常见一种取暖炉,通过燃烧炉中的木柴或者木炭来使室内升温。取暖炉一般都有一根长长的排烟管通向室外,如果没有排烟管会有什么隐患?
合作探究
探究点1
一氧化碳的物理性质
提出问题
我们经常能听到煤气中毒的事例,煤气中毒实际就是指一氧化碳中毒。那么一氧化碳有没有颜色?有没有气味?能否溶于水呢?
探究实验
实验步骤
(1)拿出盛满一氧化碳气体的集气瓶,观察气体的颜色和状态。
(2)把两支分别盛满一氧化碳和二氧化碳的试管倒置在水槽中,观察水面是否上升。
(3)用拇指按住盛一氧化碳的试管口,从水槽中取出试管,松开手指闻气体气味(使用正确的操作方法闻气味)。
一氧化碳
二氧化碳
归纳总结
颜色 气味 状态 密度 溶解性
无色
无味
气态
比空气小
难溶于水
一氧化碳的物理性质
探究点2
一氧化碳的化学性质
(一) 可燃性
提出问题
碳的氧化物除了二氧化碳外还有一氧化碳,从物质的组成和构成的角度分析,它们有什么异同?它们的性质是否相同?
归纳总结
二氧化碳的分子模型
一氧化碳的分子模型
两者都是由碳元素和氧元素组成的;1个CO2分子比1个CO分子多1个氧原子,这就使得它们的性质有很大的不同。
现象
原理
一氧化碳燃烧发出蓝色火焰,放出大量的热;生成的气体能使澄清的石灰水变浑浊。
2CO + O2 2CO2
点燃
CO
注意:一氧化碳在与空气(或氧气)混合时,遇明火可能发生爆炸,所以点燃前必须检验它的纯度。
演示实验
点燃一氧化碳
煤在煤炉里燃烧的过程中,发生了哪些化学反应?
蓝色火焰
煤
C+O2 CO2
点燃
2C+O2 2CO
点燃
C+CO2 2CO
高温
2CO+O2 2CO2
点燃
课堂讨论
中毒原因
防治措施
一氧化碳跟血液中的血红蛋白的结合能力比氧气强,使人体缺少氧气而窒息,甚至死亡。
用煤炉取暖时,注意通风。发生一氧化碳中毒时,轻者呼吸大量空气,重者送往医院治疗。
一氧化碳
血红蛋白
氧气
(二) 毒性
为了让人们易于察觉一氧化碳泄漏,以免一氧化碳中毒。
不对,因为一氧化碳既不溶于水,也不与水反应。
迅速关上煤气总开关,打开门窗,并且不要使用家里的任何电器。
课堂讨论
1.煤气厂为什么常在家用煤气(含CO)中掺入微量难闻气味的气体?
2.只要在煤炉边放一盆水,就可以预防煤气中毒了,这种说法对吗?
3.如果发生煤气泄露,我们该怎么办?
澄清石灰水
CuO
CO
(三) 还原性
演示实验
一氧化碳还原氧化铜
实验步骤
在玻璃管中放入CuO,先通入纯净的CO排净玻璃管中的空气,加热。实验完后先停止加热,继续通CO至冷却。
演示实验
现象
原理
黑色粉末变红,澄清的石灰水变浑浊。
CO + CuO Cu + CO2
△
一氧化碳还原氧化铜
澄清石灰水
CuO
CO
实验分析
一氧化碳在反应中夺取了氧化铜中的氧,使氧化铜还原成铜,同时生成二氧化碳。说明一氧化碳具有还原性,是这个反应的还原剂。这与碳单质的化学性质相似。从得氧、失氧的角度分析:氧化铜失氧,被还原(成铜),发生还原反应;氧化铜是氧化剂——具有氧化性。CO得到氧,被氧化(成CO2),发生氧化反应;CO是还原剂——具有还原性。
演示实验
先通入CO,目的是排尽装置内的空气,防止加热时发生爆炸。
防止生成的Cu再次被氧化;防止澄清石灰水倒流使试管炸裂。
课堂讨论
1. 实验前是先通入CO还是先加热CuO?为什么?
2.实验结束后,为什么要先停止加热,继续通入CO直至固体冷却?
口诀:气体早出晚归,酒精灯迟到早退。
在做CO还原CuO的实验中:
尾气含有有毒的CO。
可以用气球收集或直接点燃尾气,使其燃烧。
课堂讨论
3. 实验中的尾气为什么不能直接排入空气?
4.应该怎样处理尾气中的一氧化碳,防止对空气的污染?
(1)作气体燃料(可燃性)。
2CO + O2 2CO2
点燃
(2)冶炼金属(还原性)。
3CO + Fe2O3 2Fe + 3CO2
高温
探究点3
一氧化碳的用途
一氧化碳 二氧化碳
颜色、状态、气味
密度
溶解性
无色、无味、气体
无色、无味、气体
比空气略小
比空气大
难溶于水
能溶于水
CO和CO2的物理性质的比较
一氧化碳 二氧化碳
可燃性
与水反应
与石灰水 反应
氧化性或 还原性
有可燃性
一般不能跟水反应
不能跟石灰水反应
不能燃烧 ,一般也不能支持燃烧 ,也不能供给呼吸
在一定条件下具有氧化性
C+CO2 2CO
高温
有还原性
CO+CuO Cu+CO2
△
CO2 + H2O H2CO3
CO2+Ca(OH)2 CaCO3↓+H2O
CO和CO2的化学性质的比较
1.鉴别CO和CO2的方法有哪些?
①气体分别通入紫色石蕊溶液,试液变红的是CO2,不变的是CO。
②气体分别通入澄清石灰水,石灰水变浑浊的是CO2,不变的是CO。
③在尖嘴玻璃管口点火,气体被点燃的是CO,不能被点燃的是CO2。
课堂讨论
④分别通过灼热的氧化铜,氧化铜变红的是CO,不变的是CO2。
2.怎样除去CO混有的少量CO2?
3.怎样除去CO2混有的少量CO?
将混合气体通过足量的澄清石灰水。
CO2 + Ca(OH)2 CaCO3 ↓+ H2O
将混合气体通过足量灼热的氧化铜。
CO + CuO Cu + CO2
△
CO
CuO
CO、CO2
CO
澄清的石灰水
课堂讨论
随堂练习
1.关于一氧化碳的说法正确的是 ( )
A.一氧化碳易溶于水
B.一氧化碳分子中含有1个氧原子
C.一氧化碳中碳元素的化合价是+4价
D.一氧化碳中碳元素与氧元素的质量比为 3∶4
D
2.下列一氧化碳的性质中,属于化学性质的是( )
A.常温下为无色气体 B.难溶于水
C.没有气味 D.可以燃烧
D
随堂练习
3.导致人“煤气中毒”的物质是( )
A.氮气 B.氧气
C.一氧化碳 D.二氧化碳
C
4.下列有关CO与CO2的叙述正确的是 ( )
A.CO与CO2都会污染环境
B.CO与CO2中碳元素的化合价相同
C.在一定条件下,CO与CO2可以互相转化
D.CO2气体中混有少量的CO气体,可用点燃的方
法除去CO
C
随堂练习
5.下列符合如图所示装置设计意图的是 ( )
①说明CO具有还原性;②既说明CO具有可燃性又充分利用了能源;③说明CO得氧后的产物是CO2;④有效地防止了有剧毒的CO对空气的污染。
A.仅①② B.仅②④
C.仅②③④ D.①②③④
D
随堂练习
6.在CO、O2和CO2这些气体中,选择合适的气体填空。
(1)通入蒸馏水里,再滴加石蕊溶液,溶液呈红色,这种
气体是______。
(2)具有可燃性和还原性的气体是______。
(3)具有毒性的气体是______,原因是它易____________
________________________________________________
______________________。
CO2
CO
CO
与血液中的
随堂练习
血红蛋白结合,使血红蛋白不能再与氧气结合,造成生物体内缺氧而中毒
课堂小结
一氧化碳的性质
物理性质
无色、无味的气体,密度比空气小,难溶于水
化学性质
可燃性
毒性
还原性
用途
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
