化学人教版(2019)选择性必修1 3.3盐类水解的应用(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3盐类水解的应用(共18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 216.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-07 15:48:19 | ||
图片预览





文档简介
(共18张PPT)
第3课时
DIERKESHI
盐类水解的应用
第三章
学习目标
了解盐类水解在生产生活、化学实验、科学研究中的应用。
学会设计探究方案,进行实验探究。
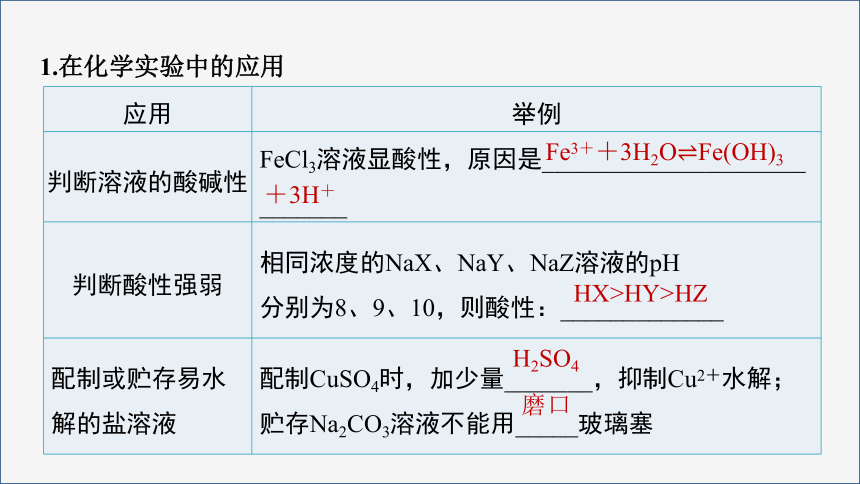
1.在化学实验中的应用
应用 举例
判断溶液的酸碱性 FeCl3溶液显酸性,原因是_____________________
_______
判断酸性强弱 相同浓度的NaX、NaY、NaZ溶液的pH
分别为8、9、10,则酸性:_____________
配制或贮存易水解的盐溶液 配制CuSO4时,加少量_______,抑制Cu2+水解;贮存Na2CO3溶液不能用_____玻璃塞
Fe3++3H2OFe(OH)3
+3H+
HX>HY>HZ
H2SO4
磨口
胶体的制取 制取Fe(OH)3胶体的离子方程式:______________
__________________________
制备无水盐 将挥发性酸的弱碱盐如AlCl3、FeCl3溶液蒸干时,在通HCl的气流中加热蒸干
判断离子是否共存
Fe3++3H2O
Fe(OH)3(胶体)+3H+
判断中和反应至中性的试剂用量 如NH3·H2O与HCl反应至中性时_________过量,CH3COOH与NaOH反应至中性时__________过量
制备无机化合物 如用TiCl4制备TiO2,其反应的化学方程式为______
_______________________________,加入大量的水,同时加热,促使水解趋于完全,所得TiO2·xH2O经焙烧得到TiO2
NH3·H2O
CH3COOH
TiCl4+
(x+2)H2O===TiO2·xH2O↓+4HCl
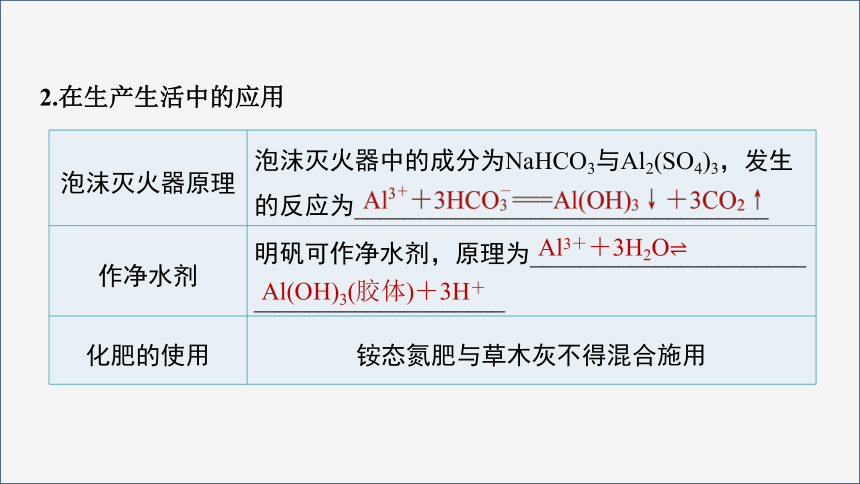
2.在生产生活中的应用
泡沫灭火器原理 泡沫灭火器中的成分为NaHCO3与Al2(SO4)3,发生的反应为_________________________________
作净水剂 明矾可作净水剂,原理为______________________
____________________
化肥的使用 铵态氮肥与草木灰不得混合施用
Al3++3H2O
Al(OH)3(胶体)+3H+
(1)盐溶液都可用磨口玻璃塞的试剂瓶( )
(2)由于CH3COO-和 相互促进水解,所以没有CH3COONH4溶液( )
(3)等浓度等体积的CH3COOH与NaOH溶液混合,恰好呈中性( )
正误判断
×
×
×
1.实验室中如何用FeCl3晶体配制FeCl3溶液?为什么?
提示 将氯化铁晶体溶于较浓盐酸中,然后加水稀释到所需的浓度;抑制FeCl3水解。
深度思考
2.实验室中如何用固体FeSO4配制FeSO4溶液?为什么?
提示 FeSO4溶液配制加少量稀硫酸和Fe粉;抑制FeSO4水解,防止FeSO4氧化。
深度思考
3.NH4F溶液能否保存在玻璃试剂瓶中?为什么?
提示 不能;NH4F水解生成的氢氟酸腐蚀玻璃。
深度思考
4.工业上通常在干燥的HCl气流中加热MgCl2· 6H2O获得无水MgCl2,干燥的HCl气流的作用是什么?
提示 ①干燥的HCl气流带走水蒸气,
②HCl抑制MgCl2水解。
深度思考
5.利用水解反应来制备纳米材料,如用TiCl4制备TiO2:TiCl4+(x+2)H2O===TiO2·xH2O↓+4HCl。制备时加入大量的水,同时加热。试利用平衡移动原理说明这两项操作的作用。
提示 加水是增加反应物,与加热两项操作的作用都是使化学平衡向水解反应的方向移动。
深度思考
应用体验
1.下列事实,其中与盐类的水解有关的是__________(填序号)。
①NaHSO4溶液呈酸性;
②长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结;
③配制CuCl2溶液,用稀盐酸溶解CuCl2固体;
④实验室盛放纯碱溶液的试剂瓶不能用磨口玻璃塞;
⑤加热FeCl3·6H2O晶体,往往得不到FeCl3固体。
②③④⑤
盐溶液蒸干灼烧后所得产物的判断
大多数盐溶液蒸干灼烧后可以得到相应的盐,以下三种特殊情况
(1)盐溶液水解生成易挥发性酸时,蒸干后一般得到对应的弱碱,
如AlCl3、FeCl3溶液蒸干后一般得到Al(OH)3、Fe(OH)3,
若灼烧则会生成Al2O3、Fe2O3。
(2)考虑盐受热时是否分解。
因为Ca(HCO3)2、NaHCO3、NH4Cl固体受热易分解,
因此蒸干灼烧后分别为Ca(HCO3)2→CaO;NaHCO3→Na2CO3;
NH4Cl→NH3+HCl。
(3)还原性盐在蒸干时会被O2氧化,
如Na2SO3溶液蒸干得到Na2SO4;FeSO4溶液蒸干得到Fe2(SO4)3。
1.将下列固体物质溶于水,再将其溶液加热、蒸发结晶,再灼烧,
得到化学组成与原固体物质相同的是______(填序号)。
①胆矾 ②氯化铝 ③硫酸铝 ④氯化铜 ⑤硫酸亚铁 ⑥碳酸钠
③⑥
检
2.常温下,三种酸的电离常数如下表所示。
酸 HX HY HZ
Ka 9×10-7 9×10-6 1×10-2
回答下列问题:
(1)三种酸的强弱关系是_____________。
(2)反应HZ+Y-===HY+Z-能否发生?_____。
(3)同浓度的NaX、NaY、NaZ溶液,pH最大的是______。
HZ>HY>HX
能
NaX
检
(4)同pH的NaX、NaY、NaZ溶液,浓度最大的是______。
NaZ
第三章
下节提示
限时练讲评
第3课时
DIERKESHI
盐类水解的应用
第三章
学习目标
了解盐类水解在生产生活、化学实验、科学研究中的应用。
学会设计探究方案,进行实验探究。
1.在化学实验中的应用
应用 举例
判断溶液的酸碱性 FeCl3溶液显酸性,原因是_____________________
_______
判断酸性强弱 相同浓度的NaX、NaY、NaZ溶液的pH
分别为8、9、10,则酸性:_____________
配制或贮存易水解的盐溶液 配制CuSO4时,加少量_______,抑制Cu2+水解;贮存Na2CO3溶液不能用_____玻璃塞
Fe3++3H2OFe(OH)3
+3H+
HX>HY>HZ
H2SO4
磨口
胶体的制取 制取Fe(OH)3胶体的离子方程式:______________
__________________________
制备无水盐 将挥发性酸的弱碱盐如AlCl3、FeCl3溶液蒸干时,在通HCl的气流中加热蒸干
判断离子是否共存
Fe3++3H2O
Fe(OH)3(胶体)+3H+
判断中和反应至中性的试剂用量 如NH3·H2O与HCl反应至中性时_________过量,CH3COOH与NaOH反应至中性时__________过量
制备无机化合物 如用TiCl4制备TiO2,其反应的化学方程式为______
_______________________________,加入大量的水,同时加热,促使水解趋于完全,所得TiO2·xH2O经焙烧得到TiO2
NH3·H2O
CH3COOH
TiCl4+
(x+2)H2O===TiO2·xH2O↓+4HCl
2.在生产生活中的应用
泡沫灭火器原理 泡沫灭火器中的成分为NaHCO3与Al2(SO4)3,发生的反应为_________________________________
作净水剂 明矾可作净水剂,原理为______________________
____________________
化肥的使用 铵态氮肥与草木灰不得混合施用
Al3++3H2O
Al(OH)3(胶体)+3H+
(1)盐溶液都可用磨口玻璃塞的试剂瓶( )
(2)由于CH3COO-和 相互促进水解,所以没有CH3COONH4溶液( )
(3)等浓度等体积的CH3COOH与NaOH溶液混合,恰好呈中性( )
正误判断
×
×
×
1.实验室中如何用FeCl3晶体配制FeCl3溶液?为什么?
提示 将氯化铁晶体溶于较浓盐酸中,然后加水稀释到所需的浓度;抑制FeCl3水解。
深度思考
2.实验室中如何用固体FeSO4配制FeSO4溶液?为什么?
提示 FeSO4溶液配制加少量稀硫酸和Fe粉;抑制FeSO4水解,防止FeSO4氧化。
深度思考
3.NH4F溶液能否保存在玻璃试剂瓶中?为什么?
提示 不能;NH4F水解生成的氢氟酸腐蚀玻璃。
深度思考
4.工业上通常在干燥的HCl气流中加热MgCl2· 6H2O获得无水MgCl2,干燥的HCl气流的作用是什么?
提示 ①干燥的HCl气流带走水蒸气,
②HCl抑制MgCl2水解。
深度思考
5.利用水解反应来制备纳米材料,如用TiCl4制备TiO2:TiCl4+(x+2)H2O===TiO2·xH2O↓+4HCl。制备时加入大量的水,同时加热。试利用平衡移动原理说明这两项操作的作用。
提示 加水是增加反应物,与加热两项操作的作用都是使化学平衡向水解反应的方向移动。
深度思考
应用体验
1.下列事实,其中与盐类的水解有关的是__________(填序号)。
①NaHSO4溶液呈酸性;
②长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结;
③配制CuCl2溶液,用稀盐酸溶解CuCl2固体;
④实验室盛放纯碱溶液的试剂瓶不能用磨口玻璃塞;
⑤加热FeCl3·6H2O晶体,往往得不到FeCl3固体。
②③④⑤
盐溶液蒸干灼烧后所得产物的判断
大多数盐溶液蒸干灼烧后可以得到相应的盐,以下三种特殊情况
(1)盐溶液水解生成易挥发性酸时,蒸干后一般得到对应的弱碱,
如AlCl3、FeCl3溶液蒸干后一般得到Al(OH)3、Fe(OH)3,
若灼烧则会生成Al2O3、Fe2O3。
(2)考虑盐受热时是否分解。
因为Ca(HCO3)2、NaHCO3、NH4Cl固体受热易分解,
因此蒸干灼烧后分别为Ca(HCO3)2→CaO;NaHCO3→Na2CO3;
NH4Cl→NH3+HCl。
(3)还原性盐在蒸干时会被O2氧化,
如Na2SO3溶液蒸干得到Na2SO4;FeSO4溶液蒸干得到Fe2(SO4)3。
1.将下列固体物质溶于水,再将其溶液加热、蒸发结晶,再灼烧,
得到化学组成与原固体物质相同的是______(填序号)。
①胆矾 ②氯化铝 ③硫酸铝 ④氯化铜 ⑤硫酸亚铁 ⑥碳酸钠
③⑥
检
2.常温下,三种酸的电离常数如下表所示。
酸 HX HY HZ
Ka 9×10-7 9×10-6 1×10-2
回答下列问题:
(1)三种酸的强弱关系是_____________。
(2)反应HZ+Y-===HY+Z-能否发生?_____。
(3)同浓度的NaX、NaY、NaZ溶液,pH最大的是______。
HZ>HY>HX
能
NaX
检
(4)同pH的NaX、NaY、NaZ溶液,浓度最大的是______。
NaZ
第三章
下节提示
限时练讲评
