第二单元常见的酸和碱单元测试题-2022-2023学年九年级化学鲁教版(五四学制)全一册(有答案)
文档属性
| 名称 | 第二单元常见的酸和碱单元测试题-2022-2023学年九年级化学鲁教版(五四学制)全一册(有答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 117.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-07 21:38:53 | ||
图片预览



文档简介
第二单元常见的酸和碱单元测试题-2022-2023学年九年级化学鲁教版(五四学制)全一册
一、单选题
1.已知生活中厕所清洁剂的pH=1,厨房的清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高 B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果 D.厕所清洁剂可能使铁制下水道腐蚀
2.下列关于盐酸用途的叙述中错误的是
A.用于金属表面除锈
B.在实验室用作干燥剂
C.人体胃液中含有盐酸,可帮助消化
D.实验室用稀盐酸与石灰石反应来制取二氧化碳
3.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
4.现有5种物质:①浓盐酸②烧碱③食盐④浓硫酸⑤铁把它们长期露置在空气中,其中发生化学变化且质量增加的是( )
A.①② B.②⑤ C.③④ D.③⑤
5.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
6.下列过程或物质的使用中一定涉及化学反应的是( )
A.用活性炭除去冰箱中的异味 B.用浓硫酸干燥二氧化碳气体
C.二氧化锰作某反应的催化剂 D.工业上常用液氨作制冷剂
7.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的 pH 随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液中,含有的溶质是NaCl和NaOH
B.由a点到b点的pH变化过程证明酸和碱发生了中和反应
C.向图中c点所示溶液中滴加无色酚酞,溶液不变色
D.该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中
8.推理是化学学习中常用的思维方法。下列推理正确的是
A.酸能使紫色石蕊试液变红。通入CO2后的紫色石蕊试液变红,所以CO2是酸
B.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
C.酸与碱作用生成盐和水是中和反应,所以生成盐和水的反应一定是中和反应
D.酸性溶液的pH小于7。食醋是酸性溶液,所以食醋的pH小于7
9.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
10.如图,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是
①试管内液面上升
②试管内溶液变红
③试管内液面不上升
④试管内溶液变蓝
⑤试管内溶液不变色
A.①② B.①④ C.②③ D.③⑤
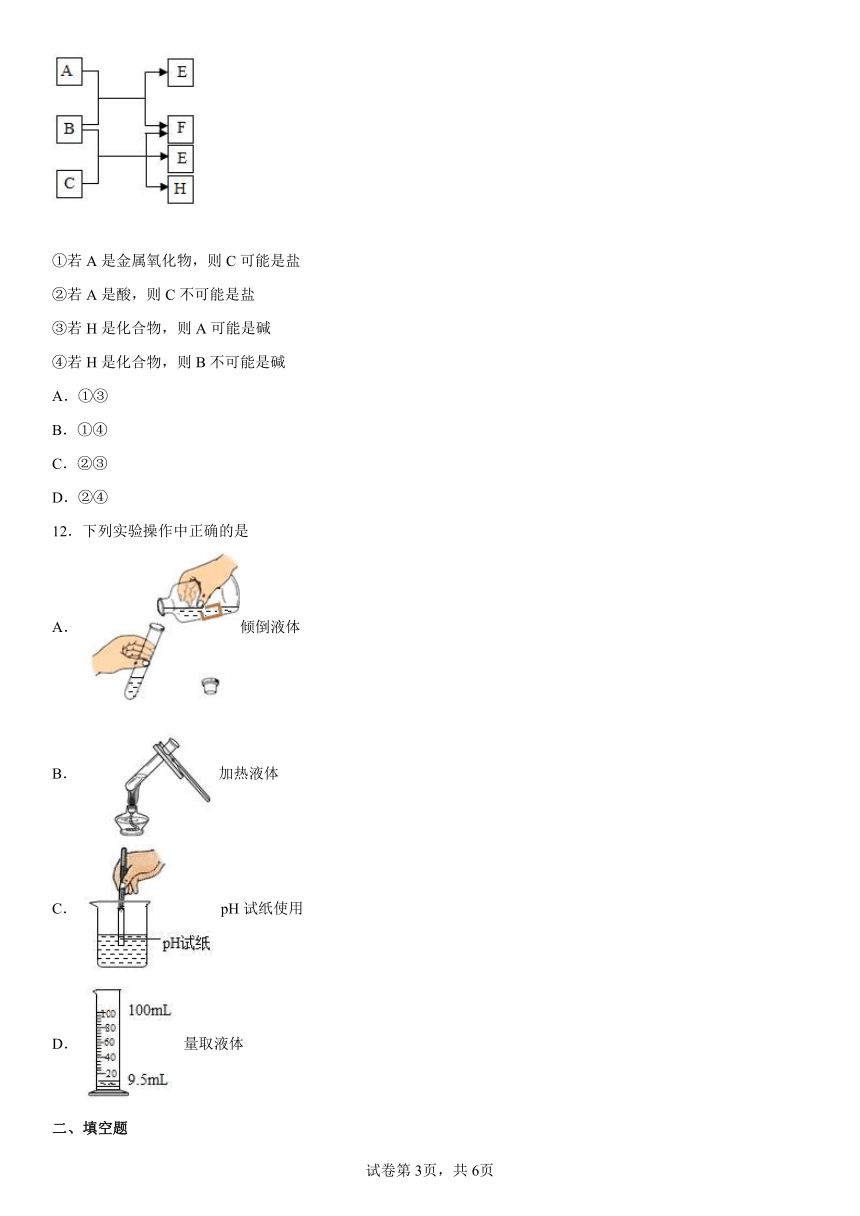
11.如图是A~H六种物质的相互转化关系,每个反应涉及的所有物质都已给出。下列说法错误的是( )
①若A是金属氧化物,则C可能是盐
②若A是酸,则C不可能是盐
③若H是化合物,则A可能是碱
④若H是化合物,则B不可能是碱
A.①③
B.①④
C.②③
D.②④
12.下列实验操作中正确的是
A. 倾倒液体
B. 加热液体
C. pH试纸使用
D. 量取液体
二、填空题
13.下面观点都是错误的,请用化学式或现象写出相应的否定例证。
错误观点 否定例证
① 含有氧元素的化合物一定是氧化物
② 生成盐和水的反应一定是中和反应
14.酸、碱、盐是我们身边重要的化合物。请根据所学知识回答相关问题:
(1)随着新能源汽车的发展,动力电池领域对氢氧化锂的需求量越来越大。氢氧化锂(LiOH)与氢氧化钠化学性质相似,其原因是溶液中都有______(填离子符号)。
(2)盐酸可用于金属表面除锈,请写出盐酸除铁锈的现象_______。
(3)波尔多液是由硫酸铜和石灰乳等配成的杀菌剂。喷洒波尔多液后,果蔬表面有一些蓝色斑点(一种难溶性碱),蓝色斑点的成分是_____(填化学式)。
(4)下列试剂能将稀盐酸、氯化钠溶液、澄清石灰水三种溶液一次鉴别出来的是_____(填序号)
A 稀硫酸 B 酚酞溶液 C 碳酸钠溶液
15.综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六只试管中进行实验(如图所示),请回答下列问题:
(1)上述六只试管中有气泡产生的是______(填序号),相关反应的现象为_______(只写出一个)。
(2)能证明“C试管中发生了化学反应”的现象是____________。
(3)有一只试管中的物质不与稀盐酸反应,原因是________。
16.氢氧化钠是化学实验室中常用的试剂。
(1)氢氧化钠必须密封保存的原因是它既易______,又易与空气中的______反应而变质,该反应的现象为______;氢氧化钠能吸收尾气中的二氧化硫,该反应的现象为______。
(2)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞黏合在一起,反应的现象为,试推断X的化学式为______。
三、实验题
17.请将下列实验报告补充完整。
实验内容 现象 说明、解释或结论
(1)用高锰酸钾制取氧气。 连接仪器,检查装置气密性。用____(填仪器名称)取少量高锰酸钾装入试管中,并在试管口放一团棉花,固定好装置,加热试管,用排水法收集O2。 当观察到___时,开始收集气体。 收集O2之前,将集气瓶内空气完全排净的方法是___。产生O2的现象为____。
(2)酸与碱发生中和反应。 i.取少量稀NaOH溶液于试管中,滴入2滴酚酞溶液,再逐滴加入稀盐酸,边滴边振荡,至溶液的颜色恰好变为无色。 ii.往上述无色溶液中再滴入1滴稀NaOH溶液,观察现象。 步骤ⅱ中观察到___。 步骤i中“边滴边振荡”的目的是____。
18.学习氢氧化钠化学性质时,某化学兴趣小组设计以下实验,探究氢氧化钠与二氧化碳是否发生反应及所得溶液的溶质成分。
方法一:从反应物减少角度探究氢氧化钠与二氧化碳是否反应。
(1)实验操作如图所示,观察到软塑料瓶变瘪,认为氢氧化钠与二氧化碳发生了反应,反应的现象为_____;
(2)一位同学认为此实验操作及现象不足以证明氢氧化钠与二氧化碳发生了反应,其理由是_____;小组同学进一步思考讨论后,他们用和甲相同的充满二氧化碳的软塑料瓶,加入_____,做了对照实验,完善了方案。
方法二:从_____角度探究氢氧化钠与二氧化碳是否反应。
(3)③取上述方案C中的溶液少许,滴加_____,观察到有产生气泡,证明氢氧化钠与二氧化碳发生了反应。
四、计算题
19.将适量二氧化碳通入100g氢氧化钠溶液中,恰好完全反应后,得到108.8g碳酸钠溶液。请计算:
(1)参加反应的二氧化碳的质量为_______g;
(2)氢氧化钠溶液的溶质质量分数_________.
20.工业纯碱中含少量氯化钠。兴趣小组采用如图装置测定工业纯碱样品中碳酸钠的质量分数。称取12g样品与足量的稀盐酸充分反应,生成的二氧化碳通入乙装置,实验测得乙装置增加的质量为 4.4g。
(1)计算样品中碳酸钠的质量。
(2)实验分析:该方法测得的碳酸钠的质量分数偏______,原因是______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.B
4.B
5.B
6.C
7.B
8.D
9.C
10.A
11.D
12.B
13.(凡合理答案均可得分)H2CO3;
14. (1) OH- (2) Cu(OH)2 C
15. (1) BD 溶液由红色变为无色 (2) 在金属活动顺序中铜位于氢后面,所以不与稀盐酸反应
16.(1) 潮解 二氧化碳
(2)
17. (1) 药匙 导管口有连续并比较均匀的气泡冒出 (2)将集气瓶装满水 溶液变红色 (3)使反应充分(或“使反应物充分混合”等其他合理答案)
18. (1) 二氧化碳能溶于水,且与水反应生成碳酸,也能使塑料瓶内压强较小,使塑料瓶变瘪 (2) 与氢氧化钠溶液相等体积的水 (3) 生成物 稀盐酸
19.(1)据质量守恒定律可知反应前后物质的总质量不变,参加反应的二氧化碳质量为108.8g-100g=8.8g;
(2)设:溶液中氢氧化钠质量为x。
x=16g
氢氧化钠溶液的溶质质量分数= 。
答:(1)参加反应的二氧化碳的质量为4.4 g;
(2)氢氧化钠溶液的溶质质量分数16% 。
20.(1)解:设样品中碳酸钠的质量为x
答:样品中碳酸钠的质量为10.6g。
(2)大;乙装置中氢氧化钠会吸收来自于甲装置中挥发出的氯化氢气体
答案第1页,共2页
答案第1页,共2页
一、单选题
1.已知生活中厕所清洁剂的pH=1,厨房的清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高 B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果 D.厕所清洁剂可能使铁制下水道腐蚀
2.下列关于盐酸用途的叙述中错误的是
A.用于金属表面除锈
B.在实验室用作干燥剂
C.人体胃液中含有盐酸,可帮助消化
D.实验室用稀盐酸与石灰石反应来制取二氧化碳
3.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
4.现有5种物质:①浓盐酸②烧碱③食盐④浓硫酸⑤铁把它们长期露置在空气中,其中发生化学变化且质量增加的是( )
A.①② B.②⑤ C.③④ D.③⑤
5.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
6.下列过程或物质的使用中一定涉及化学反应的是( )
A.用活性炭除去冰箱中的异味 B.用浓硫酸干燥二氧化碳气体
C.二氧化锰作某反应的催化剂 D.工业上常用液氨作制冷剂
7.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的 pH 随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液中,含有的溶质是NaCl和NaOH
B.由a点到b点的pH变化过程证明酸和碱发生了中和反应
C.向图中c点所示溶液中滴加无色酚酞,溶液不变色
D.该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中
8.推理是化学学习中常用的思维方法。下列推理正确的是
A.酸能使紫色石蕊试液变红。通入CO2后的紫色石蕊试液变红,所以CO2是酸
B.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
C.酸与碱作用生成盐和水是中和反应,所以生成盐和水的反应一定是中和反应
D.酸性溶液的pH小于7。食醋是酸性溶液,所以食醋的pH小于7
9.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
10.如图,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是
①试管内液面上升
②试管内溶液变红
③试管内液面不上升
④试管内溶液变蓝
⑤试管内溶液不变色
A.①② B.①④ C.②③ D.③⑤
11.如图是A~H六种物质的相互转化关系,每个反应涉及的所有物质都已给出。下列说法错误的是( )
①若A是金属氧化物,则C可能是盐
②若A是酸,则C不可能是盐
③若H是化合物,则A可能是碱
④若H是化合物,则B不可能是碱
A.①③
B.①④
C.②③
D.②④
12.下列实验操作中正确的是
A. 倾倒液体
B. 加热液体
C. pH试纸使用
D. 量取液体
二、填空题
13.下面观点都是错误的,请用化学式或现象写出相应的否定例证。
错误观点 否定例证
① 含有氧元素的化合物一定是氧化物
② 生成盐和水的反应一定是中和反应
14.酸、碱、盐是我们身边重要的化合物。请根据所学知识回答相关问题:
(1)随着新能源汽车的发展,动力电池领域对氢氧化锂的需求量越来越大。氢氧化锂(LiOH)与氢氧化钠化学性质相似,其原因是溶液中都有______(填离子符号)。
(2)盐酸可用于金属表面除锈,请写出盐酸除铁锈的现象_______。
(3)波尔多液是由硫酸铜和石灰乳等配成的杀菌剂。喷洒波尔多液后,果蔬表面有一些蓝色斑点(一种难溶性碱),蓝色斑点的成分是_____(填化学式)。
(4)下列试剂能将稀盐酸、氯化钠溶液、澄清石灰水三种溶液一次鉴别出来的是_____(填序号)
A 稀硫酸 B 酚酞溶液 C 碳酸钠溶液
15.综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六只试管中进行实验(如图所示),请回答下列问题:
(1)上述六只试管中有气泡产生的是______(填序号),相关反应的现象为_______(只写出一个)。
(2)能证明“C试管中发生了化学反应”的现象是____________。
(3)有一只试管中的物质不与稀盐酸反应,原因是________。
16.氢氧化钠是化学实验室中常用的试剂。
(1)氢氧化钠必须密封保存的原因是它既易______,又易与空气中的______反应而变质,该反应的现象为______;氢氧化钠能吸收尾气中的二氧化硫,该反应的现象为______。
(2)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞黏合在一起,反应的现象为,试推断X的化学式为______。
三、实验题
17.请将下列实验报告补充完整。
实验内容 现象 说明、解释或结论
(1)用高锰酸钾制取氧气。 连接仪器,检查装置气密性。用____(填仪器名称)取少量高锰酸钾装入试管中,并在试管口放一团棉花,固定好装置,加热试管,用排水法收集O2。 当观察到___时,开始收集气体。 收集O2之前,将集气瓶内空气完全排净的方法是___。产生O2的现象为____。
(2)酸与碱发生中和反应。 i.取少量稀NaOH溶液于试管中,滴入2滴酚酞溶液,再逐滴加入稀盐酸,边滴边振荡,至溶液的颜色恰好变为无色。 ii.往上述无色溶液中再滴入1滴稀NaOH溶液,观察现象。 步骤ⅱ中观察到___。 步骤i中“边滴边振荡”的目的是____。
18.学习氢氧化钠化学性质时,某化学兴趣小组设计以下实验,探究氢氧化钠与二氧化碳是否发生反应及所得溶液的溶质成分。
方法一:从反应物减少角度探究氢氧化钠与二氧化碳是否反应。
(1)实验操作如图所示,观察到软塑料瓶变瘪,认为氢氧化钠与二氧化碳发生了反应,反应的现象为_____;
(2)一位同学认为此实验操作及现象不足以证明氢氧化钠与二氧化碳发生了反应,其理由是_____;小组同学进一步思考讨论后,他们用和甲相同的充满二氧化碳的软塑料瓶,加入_____,做了对照实验,完善了方案。
方法二:从_____角度探究氢氧化钠与二氧化碳是否反应。
(3)③取上述方案C中的溶液少许,滴加_____,观察到有产生气泡,证明氢氧化钠与二氧化碳发生了反应。
四、计算题
19.将适量二氧化碳通入100g氢氧化钠溶液中,恰好完全反应后,得到108.8g碳酸钠溶液。请计算:
(1)参加反应的二氧化碳的质量为_______g;
(2)氢氧化钠溶液的溶质质量分数_________.
20.工业纯碱中含少量氯化钠。兴趣小组采用如图装置测定工业纯碱样品中碳酸钠的质量分数。称取12g样品与足量的稀盐酸充分反应,生成的二氧化碳通入乙装置,实验测得乙装置增加的质量为 4.4g。
(1)计算样品中碳酸钠的质量。
(2)实验分析:该方法测得的碳酸钠的质量分数偏______,原因是______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.B
4.B
5.B
6.C
7.B
8.D
9.C
10.A
11.D
12.B
13.(凡合理答案均可得分)H2CO3;
14. (1) OH- (2) Cu(OH)2 C
15. (1) BD 溶液由红色变为无色 (2) 在金属活动顺序中铜位于氢后面,所以不与稀盐酸反应
16.(1) 潮解 二氧化碳
(2)
17. (1) 药匙 导管口有连续并比较均匀的气泡冒出 (2)将集气瓶装满水 溶液变红色 (3)使反应充分(或“使反应物充分混合”等其他合理答案)
18. (1) 二氧化碳能溶于水,且与水反应生成碳酸,也能使塑料瓶内压强较小,使塑料瓶变瘪 (2) 与氢氧化钠溶液相等体积的水 (3) 生成物 稀盐酸
19.(1)据质量守恒定律可知反应前后物质的总质量不变,参加反应的二氧化碳质量为108.8g-100g=8.8g;
(2)设:溶液中氢氧化钠质量为x。
x=16g
氢氧化钠溶液的溶质质量分数= 。
答:(1)参加反应的二氧化碳的质量为4.4 g;
(2)氢氧化钠溶液的溶质质量分数16% 。
20.(1)解:设样品中碳酸钠的质量为x
答:样品中碳酸钠的质量为10.6g。
(2)大;乙装置中氢氧化钠会吸收来自于甲装置中挥发出的氯化氢气体
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
