高中化学人教版(2019)必修第一册1.3.3.氧化剂 还原剂 氧化产物 还原产物(共18张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册1.3.3.氧化剂 还原剂 氧化产物 还原产物(共18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 638.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-08 21:48:22 | ||
图片预览




文档简介
(共18张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第3课时
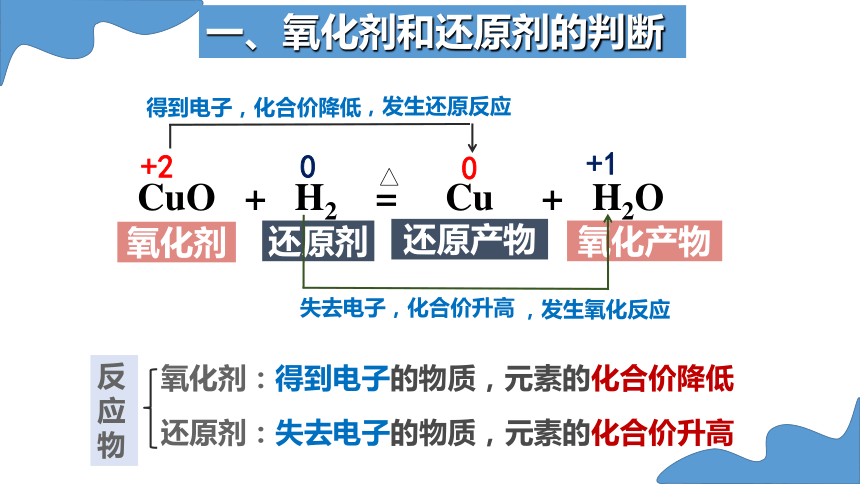
还原剂
氧化产物
氧化剂
CuO + H2 = Cu + H2O
+2
0
0
+1
得到电子,化合价降低
失去电子,化合价升高
氧化剂:得到电子的物质,元素的化合价降低
还原剂:失去电子的物质,元素的化合价升高
反应物
,发生还原反应
,发生氧化反应
还原产物
一、氧化剂和还原剂的判断
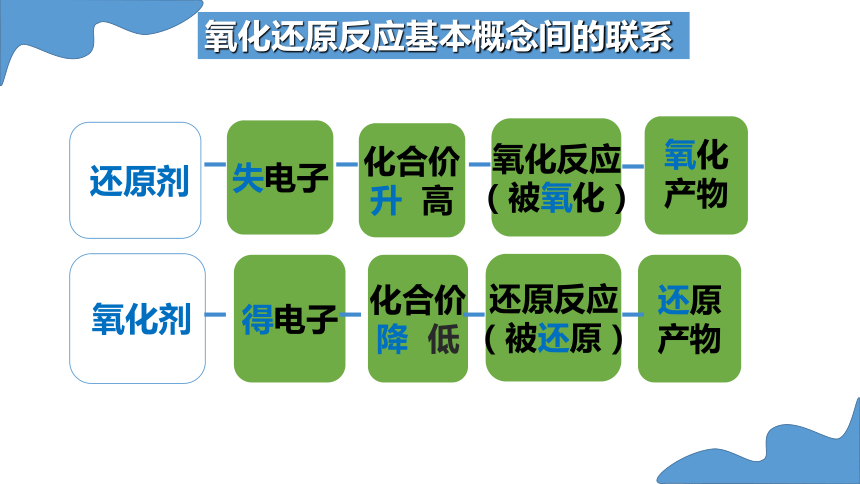
氧化反应
(被氧化)
还原
产物
还原反应
(被还原)
还原剂
氧化
产物
失电子
得电子
化合价
升 高
化合价
降 低
氧化剂
氧化还原反应基本概念间的联系
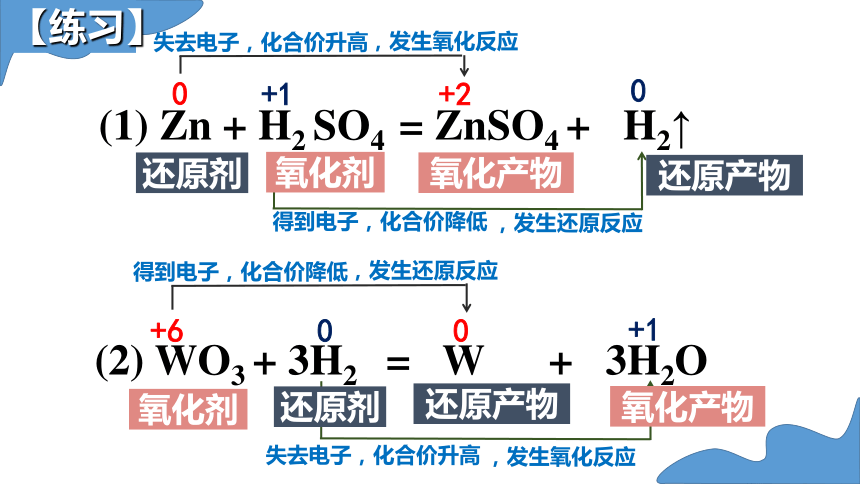
(1) Zn + H2 SO4 = ZnSO4 + H2↑
0
+1
+2
0
失去电子,化合价升高
,发生氧化反应
得到电子,化合价降低
,发生还原反应
还原剂
氧化产物
氧化剂
还原产物
(2) WO3 + 3H2 = W + 3H2O
+6
0
0
+1
得到电子,化合价降低
,发生还原反应
失去电子,化合价升高
,发生氧化反应
还原剂
氧化产物
氧化剂
还原产物
【练习】
(3) 2HgO = 2Hg + O2↑
+2
-2
0
0
还原产物
氧化产物
氧化剂
、还原剂
(4) O2 + 2H2 = 2H2O
氧化剂
还原剂
还原产物
、氧化产物
点燃
0
0
-2
+1
氧化剂、还原剂可以是同一种物质,
氧化产物、还原产物也可以是同一种物质。
【总结】判断依据:化合价的升降
(5)下列反应中,水作氧化剂的是( )
A. SO3+H2O=H2SO4
B. 2Na+2H2O=2NaOH+H2↑
C. 2F2+2H2O = 4HF+O2
D.3NO2 +H2O = 2HNO3 +NO
B
《课后作业》P139,第5题
【练习】
【练习】
《课后作业》P139,第3题
(6)下列过程需要加还原剂实现的是( )
A. Fe2+ → Fe3+
B. H2O2 → O2
C. Cl2 → 2Cl-
D. CO2 → CO32-
C
氧化性:
还原性:
氧化剂、氧化产物具有氧化性
还原剂、还原产物具有还原性
二、氧化性和还原性
氧化剂得电子的能力
还原剂失电子的能力
1、高价氧化,低价还,中间价态有两性
三、氧化性和还原性规律
只判断氧化性、还原性的有无,不能判断性质强弱!
S SO2 H2SO3 Na2SO3
-2
0
+4
+4
+4
+6
H2S
H2SO4
还原性
氧化性
既具有还原性
又具有氧化性
根据化学方程式:Fe + CuSO4 = FeSO4 + Cu,判断Fe、Cu 还原性的强弱,以及Fe2+、Cu2+ 氧化性的强弱 ?
还原剂
氧化产物
氧化剂
还原产物
________>_________
氧化性:
氧化剂
氧化产物
还原性:
________>_________
还原剂
还原产物
还原性:
氧化性:
四、比较氧化性、还原性强弱方法
方法一:
Fe > Cu
Cu2+ > Fe2+
方法二
还原性从左至右逐渐减弱
氧化性从左至右逐渐增强
金属单质的还原性越强,对应金属阳离子的氧化性越弱。
方法三
根据氧化还原反应的程度比较:
根据下面两个化学方程式判断Fe2+,Cu2+,Fe3+ 氧化性由弱到强的顺序是 ( )
(1)2FeCl3+Cu = 2FeCl2+CuCl2
(2)CuCl2 + Fe = Cu + FeCl2
A.Cu2+ < Fe2+< Fe3+
B. Fe3+< Cu2+< Fe2+
C. Fe2+< Fe3+ < Cu2+
D. Fe2+< Cu2+< Fe3+
D
《课后作业》P139,第8题
【练习】
“服用维生素C可防食物中的Fe2+变成Fe3+”,这句话说明维生素C在这一反应中作( )剂,具有( )性。
还原
还原
【练习】
归中律
同一元素不同价态之间的氧化还原:
只靠拢 不交叉
H2S + H2SO4 = S + SO2 + 2H2O
-2
0
+6
+4
-2
0
+4
+6
-2
0
+4
+6
反应物
生成物
-2
0
+4
+6
-2
0
+4
+6
反应物
生成物
得2×2e-
失1×2e-
错误
正确
《课后作业》P138,T9,C项
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
+5
-1
0
失5×1e-
得1×5e-
-1
试一试
(5)制备氰氨基化钙的化学方程式为:
CaCO3+2HCN = CaCN2+CO↑+H2↑+ CO2↑,下列说法正确的是( )
A. 氢元素被氧化,碳元素被还原
B. HCN被氧化,CaCO3被还原
C. HCN是氧化剂,CaCO3是还原剂
D. CaCN2是氧化产物,H2为还原产物
-3
+4
+1
0
+4
+2
+4
+2
D
【归纳总结】
1. 氧化剂、还原剂的判断
还原产物、氧化产物的判断
氧化性、还原性强弱的判断
2. 口诀:
升失氧 还原剂
降得还 氧化剂
第一章 物质及其变化
第三节 氧化还原反应
第3课时
还原剂
氧化产物
氧化剂
CuO + H2 = Cu + H2O
+2
0
0
+1
得到电子,化合价降低
失去电子,化合价升高
氧化剂:得到电子的物质,元素的化合价降低
还原剂:失去电子的物质,元素的化合价升高
反应物
,发生还原反应
,发生氧化反应
还原产物
一、氧化剂和还原剂的判断
氧化反应
(被氧化)
还原
产物
还原反应
(被还原)
还原剂
氧化
产物
失电子
得电子
化合价
升 高
化合价
降 低
氧化剂
氧化还原反应基本概念间的联系
(1) Zn + H2 SO4 = ZnSO4 + H2↑
0
+1
+2
0
失去电子,化合价升高
,发生氧化反应
得到电子,化合价降低
,发生还原反应
还原剂
氧化产物
氧化剂
还原产物
(2) WO3 + 3H2 = W + 3H2O
+6
0
0
+1
得到电子,化合价降低
,发生还原反应
失去电子,化合价升高
,发生氧化反应
还原剂
氧化产物
氧化剂
还原产物
【练习】
(3) 2HgO = 2Hg + O2↑
+2
-2
0
0
还原产物
氧化产物
氧化剂
、还原剂
(4) O2 + 2H2 = 2H2O
氧化剂
还原剂
还原产物
、氧化产物
点燃
0
0
-2
+1
氧化剂、还原剂可以是同一种物质,
氧化产物、还原产物也可以是同一种物质。
【总结】判断依据:化合价的升降
(5)下列反应中,水作氧化剂的是( )
A. SO3+H2O=H2SO4
B. 2Na+2H2O=2NaOH+H2↑
C. 2F2+2H2O = 4HF+O2
D.3NO2 +H2O = 2HNO3 +NO
B
《课后作业》P139,第5题
【练习】
【练习】
《课后作业》P139,第3题
(6)下列过程需要加还原剂实现的是( )
A. Fe2+ → Fe3+
B. H2O2 → O2
C. Cl2 → 2Cl-
D. CO2 → CO32-
C
氧化性:
还原性:
氧化剂、氧化产物具有氧化性
还原剂、还原产物具有还原性
二、氧化性和还原性
氧化剂得电子的能力
还原剂失电子的能力
1、高价氧化,低价还,中间价态有两性
三、氧化性和还原性规律
只判断氧化性、还原性的有无,不能判断性质强弱!
S SO2 H2SO3 Na2SO3
-2
0
+4
+4
+4
+6
H2S
H2SO4
还原性
氧化性
既具有还原性
又具有氧化性
根据化学方程式:Fe + CuSO4 = FeSO4 + Cu,判断Fe、Cu 还原性的强弱,以及Fe2+、Cu2+ 氧化性的强弱 ?
还原剂
氧化产物
氧化剂
还原产物
________>_________
氧化性:
氧化剂
氧化产物
还原性:
________>_________
还原剂
还原产物
还原性:
氧化性:
四、比较氧化性、还原性强弱方法
方法一:
Fe > Cu
Cu2+ > Fe2+
方法二
还原性从左至右逐渐减弱
氧化性从左至右逐渐增强
金属单质的还原性越强,对应金属阳离子的氧化性越弱。
方法三
根据氧化还原反应的程度比较:
根据下面两个化学方程式判断Fe2+,Cu2+,Fe3+ 氧化性由弱到强的顺序是 ( )
(1)2FeCl3+Cu = 2FeCl2+CuCl2
(2)CuCl2 + Fe = Cu + FeCl2
A.Cu2+ < Fe2+< Fe3+
B. Fe3+< Cu2+< Fe2+
C. Fe2+< Fe3+ < Cu2+
D. Fe2+< Cu2+< Fe3+
D
《课后作业》P139,第8题
【练习】
“服用维生素C可防食物中的Fe2+变成Fe3+”,这句话说明维生素C在这一反应中作( )剂,具有( )性。
还原
还原
【练习】
归中律
同一元素不同价态之间的氧化还原:
只靠拢 不交叉
H2S + H2SO4 = S + SO2 + 2H2O
-2
0
+6
+4
-2
0
+4
+6
-2
0
+4
+6
反应物
生成物
-2
0
+4
+6
-2
0
+4
+6
反应物
生成物
得2×2e-
失1×2e-
错误
正确
《课后作业》P138,T9,C项
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
+5
-1
0
失5×1e-
得1×5e-
-1
试一试
(5)制备氰氨基化钙的化学方程式为:
CaCO3+2HCN = CaCN2+CO↑+H2↑+ CO2↑,下列说法正确的是( )
A. 氢元素被氧化,碳元素被还原
B. HCN被氧化,CaCO3被还原
C. HCN是氧化剂,CaCO3是还原剂
D. CaCN2是氧化产物,H2为还原产物
-3
+4
+1
0
+4
+2
+4
+2
D
【归纳总结】
1. 氧化剂、还原剂的判断
还原产物、氧化产物的判断
氧化性、还原性强弱的判断
2. 口诀:
升失氧 还原剂
降得还 氧化剂
