4.3 质量守恒定律课件—2022-2023学年九年级化学科粤版上册(共26张PPT内嵌视频)
文档属性
| 名称 | 4.3 质量守恒定律课件—2022-2023学年九年级化学科粤版上册(共26张PPT内嵌视频) |

|
|
| 格式 | pptx | ||
| 文件大小 | 23.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-08 00:00:00 | ||
图片预览







文档简介
(共26张PPT)
4.3 质量守恒定律
1.提出问题
化学反应前后各物质的质量和是否会发生变化呢?
2 .猜想与假设
(1)参加反应的各物质的质量之和大于生成的各物质的质量之和。
(2)参加反应的各物质的质量之和等于生成的各物质的质量之和。
(3)参加反应的各物质的质量之和小于生成的各物质的质量之和。
红磷燃烧
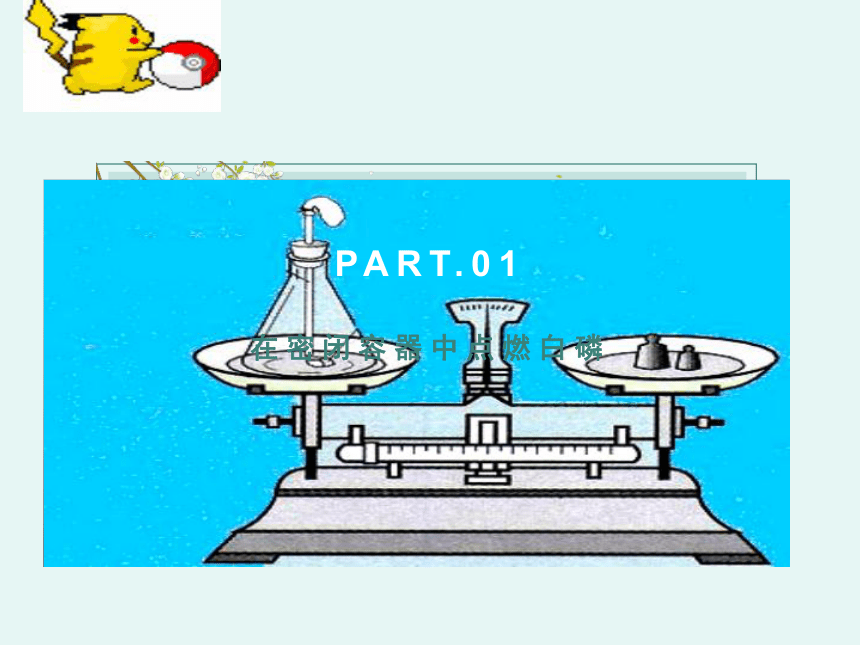
在密闭容器中点燃白磷
PART.01
红磷燃烧前后质量的测定
红磷燃烧产生大量白烟
现 象
气球先变变大后变小
表达式
P + O2 P2O5
称量结果
m前 m后
=
反应前157g
反应后157g
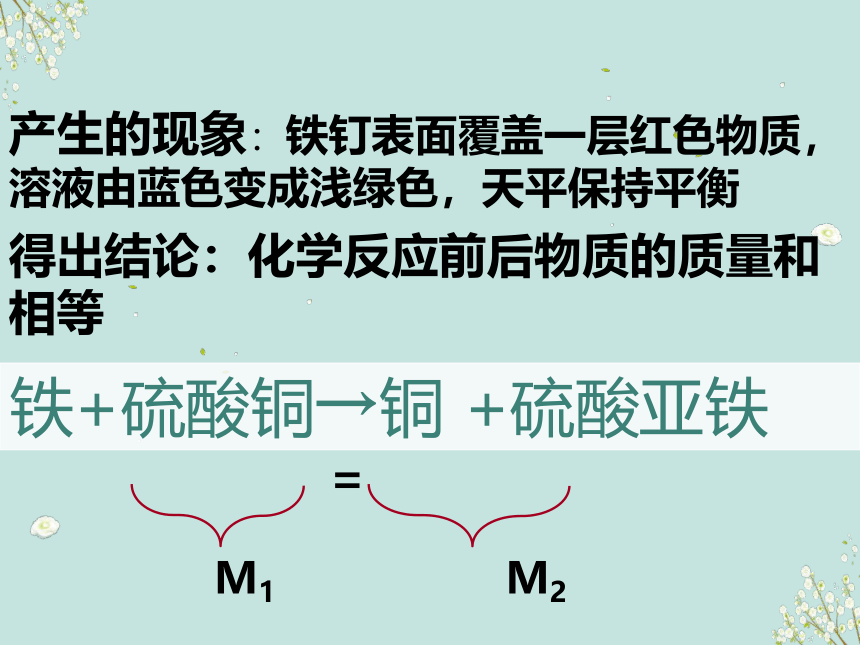
铁和硫酸铜反应
产生的现象:铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色,天平保持平衡
M1 M2
=
铁+硫酸铜→铜 +硫酸亚铁
得出结论:化学反应前后物质的质量和相等
碳酸钠与稀盐酸反应
有大量 产生
现 象
表达式
Na2CO3 + HCl NaCl + H2O + CO2
称量结果
m前 m后
>
气泡
思 考
天平为什么不平衡?
镁条燃烧
发出耀眼 白 光,生成 白 色固体
现 象
表达式
称量结果
m前 m后
思 考
天平为什么不平衡?
Mg + O2 MgO
<
34.5
34.3
开放体系
密闭体系
如果用有气体参加或生成的反应
验证质量守恒定律要在密闭体系中进行
反应前
反应后
157.0
157.0
34.3
34.5
反应前
反应后
37.2
36.2
反应前
反应后
Mg + O2 MgO
点燃
Na2CO3+HCl NaCl+H2O+CO2
P + O2 P2O5
点燃
参加化学反应的各物质的质量总和,等等于反应后生成的各物质的质量总和。
质量守恒定律概念要点:
1、适用于所有的化学反应
2、强调“参加”反应的物质
3、强调“质量总和”
+
氢原子:4 氢原子:4
原子数
相对质量
H2 + O2 H2O
点燃
2×2+16×2=36
2×(2+16)=36
氧原子:2 氧原子:2
反应前
反应后
H
H
H
H
O
O
O
H
H
O
H
H
原子个数不变
原子种类不变
原子质量不变
元素种类不变
元素质量不变
物质质量不变
下列说法能用质量守恒定律解释的( )
A.镁带在空气中燃烧后,生成物的质量比镁带质量增加了
B.蜡烛完全燃烧后,生成水和二氧化碳的质量之和等于蜡烛质量
C.水的质量和受热变成水蒸汽的质量相等
D.高锰酸钾受热分解后,剩余固体的质量比反应物质量轻
A、D
1.解释一些化学变化中的质量变化
2.推断化学反应中某物质的质量
(2)将25 g氯酸钾和1g二氧化锰的混合物加热至完全分解,
得到残余固体质量为14 g,则产生氧气____g。
(1) 6g的碳在充足的氧气中燃烧,生成二氧化碳22 g ,
则有____g 的氧气参加反应。
16
12
3.推断化学反应中反应物或生成物中的组成元素
某矿石+ O2 Fe2O3+SO2,则该矿石中
一定含有 ____和_____元素。可能含有____元素
铁
硫
氧
高温
4.推断化学反应中某物质的化学式
黑火药爆炸原理:2KNO3+3C+S=K2S+N2↑+3X
X的化学式是_______
CO2
总质量
时间
总质量
时间
总质量
时间
总质量
时间
A
B
C
D
1.镁带在密闭的容器中加热,其总质量与时间的关系正确的是 ( )
B
点燃
该化学反应中,参加反应的 和
与反应后生成 的各微粒的个数比为: 。
2∶1∶2
2.根据下图回答问题
3.在一定密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应后, 测得反应前后各物质的质量如下
物质 X Y Z Q
反应前质量 2 2 84 5
反应后质量 待测 24 0 14
求反应后X的质量____,该反应属于______反应.
55
分解
总质量
时间
总质量
时间
总质量
时间
总质量
时间
A
B
C
D
1.镁带在密闭的容器中加热,其总质量与时间的关系正确的是 ( )
B
3.推断化学反应中反应物或生成物中的组成元素
某矿石+ O2 Fe2O3+SO2,则该矿石中
一定含有 ____和_____元素。可能含有____元素
铁
硫
氧
高温
4.推断化学反应中某物质的化学式
黑火药爆炸原理:2KNO3+3C+S=K2S+N2↑+3X
X的化学式是_______
CO2
点燃
该化学反应中,参加反应的 和
与反应后生成 的各微粒的个数比为: 。
2∶1∶2
2.根据下图回答问题
3.在一定密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应后,
测得反应前后各物质的质量如下
物质 X Y Z Q
反应前质量 2 2 84 5
反应后质量 待测 24 0 14
求反应后X的质量____,该反应属于______反应.
55
分解
课内作业:
课外作业:探究性学习:铁钉生锈这个反应是否遵循质量守恒定律,大家亲自实验进行验证。两周后,交流并汇报实验结果。
4.3 质量守恒定律
1.提出问题
化学反应前后各物质的质量和是否会发生变化呢?
2 .猜想与假设
(1)参加反应的各物质的质量之和大于生成的各物质的质量之和。
(2)参加反应的各物质的质量之和等于生成的各物质的质量之和。
(3)参加反应的各物质的质量之和小于生成的各物质的质量之和。
红磷燃烧
在密闭容器中点燃白磷
PART.01
红磷燃烧前后质量的测定
红磷燃烧产生大量白烟
现 象
气球先变变大后变小
表达式
P + O2 P2O5
称量结果
m前 m后
=
反应前157g
反应后157g
铁和硫酸铜反应
产生的现象:铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色,天平保持平衡
M1 M2
=
铁+硫酸铜→铜 +硫酸亚铁
得出结论:化学反应前后物质的质量和相等
碳酸钠与稀盐酸反应
有大量 产生
现 象
表达式
Na2CO3 + HCl NaCl + H2O + CO2
称量结果
m前 m后
>
气泡
思 考
天平为什么不平衡?
镁条燃烧
发出耀眼 白 光,生成 白 色固体
现 象
表达式
称量结果
m前 m后
思 考
天平为什么不平衡?
Mg + O2 MgO
<
34.5
34.3
开放体系
密闭体系
如果用有气体参加或生成的反应
验证质量守恒定律要在密闭体系中进行
反应前
反应后
157.0
157.0
34.3
34.5
反应前
反应后
37.2
36.2
反应前
反应后
Mg + O2 MgO
点燃
Na2CO3+HCl NaCl+H2O+CO2
P + O2 P2O5
点燃
参加化学反应的各物质的质量总和,等等于反应后生成的各物质的质量总和。
质量守恒定律概念要点:
1、适用于所有的化学反应
2、强调“参加”反应的物质
3、强调“质量总和”
+
氢原子:4 氢原子:4
原子数
相对质量
H2 + O2 H2O
点燃
2×2+16×2=36
2×(2+16)=36
氧原子:2 氧原子:2
反应前
反应后
H
H
H
H
O
O
O
H
H
O
H
H
原子个数不变
原子种类不变
原子质量不变
元素种类不变
元素质量不变
物质质量不变
下列说法能用质量守恒定律解释的( )
A.镁带在空气中燃烧后,生成物的质量比镁带质量增加了
B.蜡烛完全燃烧后,生成水和二氧化碳的质量之和等于蜡烛质量
C.水的质量和受热变成水蒸汽的质量相等
D.高锰酸钾受热分解后,剩余固体的质量比反应物质量轻
A、D
1.解释一些化学变化中的质量变化
2.推断化学反应中某物质的质量
(2)将25 g氯酸钾和1g二氧化锰的混合物加热至完全分解,
得到残余固体质量为14 g,则产生氧气____g。
(1) 6g的碳在充足的氧气中燃烧,生成二氧化碳22 g ,
则有____g 的氧气参加反应。
16
12
3.推断化学反应中反应物或生成物中的组成元素
某矿石+ O2 Fe2O3+SO2,则该矿石中
一定含有 ____和_____元素。可能含有____元素
铁
硫
氧
高温
4.推断化学反应中某物质的化学式
黑火药爆炸原理:2KNO3+3C+S=K2S+N2↑+3X
X的化学式是_______
CO2
总质量
时间
总质量
时间
总质量
时间
总质量
时间
A
B
C
D
1.镁带在密闭的容器中加热,其总质量与时间的关系正确的是 ( )
B
点燃
该化学反应中,参加反应的 和
与反应后生成 的各微粒的个数比为: 。
2∶1∶2
2.根据下图回答问题
3.在一定密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应后, 测得反应前后各物质的质量如下
物质 X Y Z Q
反应前质量 2 2 84 5
反应后质量 待测 24 0 14
求反应后X的质量____,该反应属于______反应.
55
分解
总质量
时间
总质量
时间
总质量
时间
总质量
时间
A
B
C
D
1.镁带在密闭的容器中加热,其总质量与时间的关系正确的是 ( )
B
3.推断化学反应中反应物或生成物中的组成元素
某矿石+ O2 Fe2O3+SO2,则该矿石中
一定含有 ____和_____元素。可能含有____元素
铁
硫
氧
高温
4.推断化学反应中某物质的化学式
黑火药爆炸原理:2KNO3+3C+S=K2S+N2↑+3X
X的化学式是_______
CO2
点燃
该化学反应中,参加反应的 和
与反应后生成 的各微粒的个数比为: 。
2∶1∶2
2.根据下图回答问题
3.在一定密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应后,
测得反应前后各物质的质量如下
物质 X Y Z Q
反应前质量 2 2 84 5
反应后质量 待测 24 0 14
求反应后X的质量____,该反应属于______反应.
55
分解
课内作业:
课外作业:探究性学习:铁钉生锈这个反应是否遵循质量守恒定律,大家亲自实验进行验证。两周后,交流并汇报实验结果。
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
