2022-2023学年人教版高中化学必修1教学课件 第四章第三节 化学键(22张ppt)
文档属性
| 名称 | 2022-2023学年人教版高中化学必修1教学课件 第四章第三节 化学键(22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 777.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-09 18:07:53 | ||
图片预览





文档简介
(共22张PPT)
第三节. 化学键
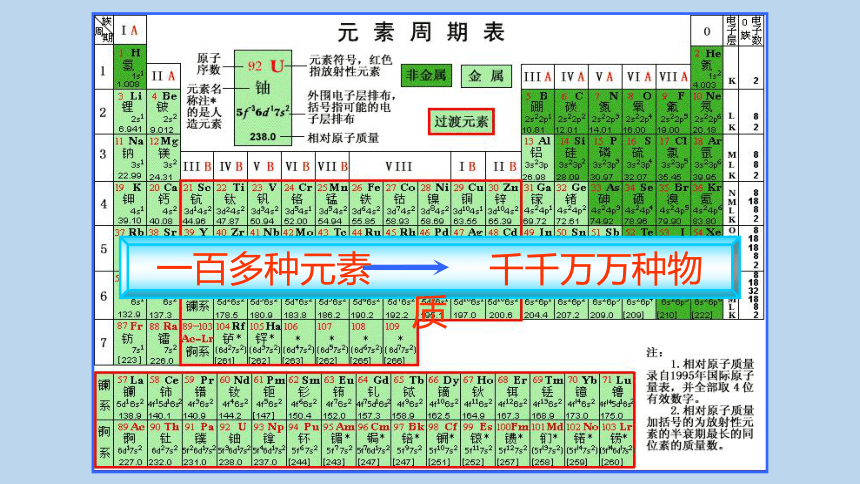
一百多种元素 千千万万种物质
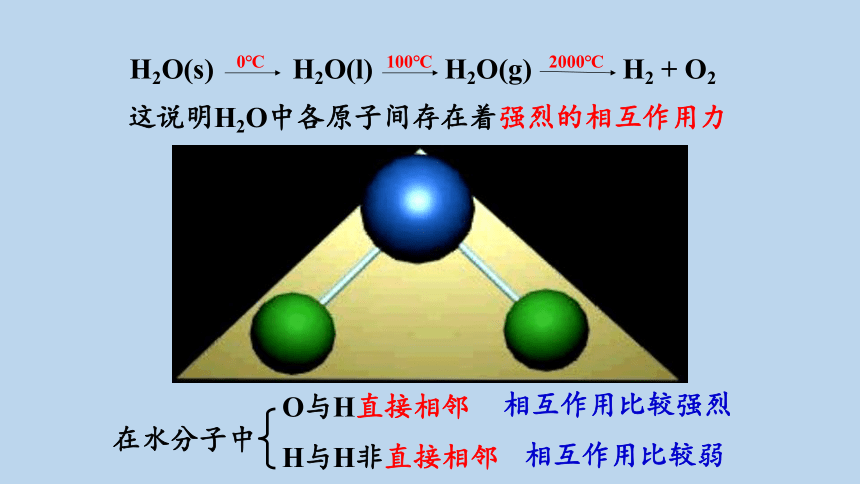
H2O(s)
H2O(l)
H2O(g)
H2 + O2
0℃
100℃
2000℃
这说明H2O中各原子间存在着强烈的相互作用力
在水分子中
O与H直接相邻
相互作用比较强烈
相互作用比较弱
H与H非直接相邻
复习:钠在氯气中燃烧的实验现象及反应的方程式
现象
化学方程式
Na在Cl2中剧烈燃烧,有黄色火焰,产生白烟
2Na + Cl2 ==== 2NaCl
点燃
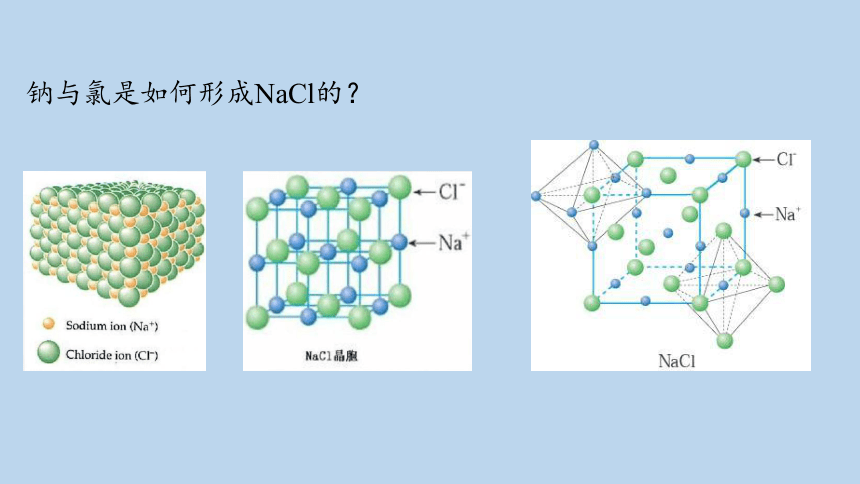
思考:从微观的角度分析,钠原子和氯原子是怎样形成氯化钠的呢?
钠与氯是如何形成NaCl的?
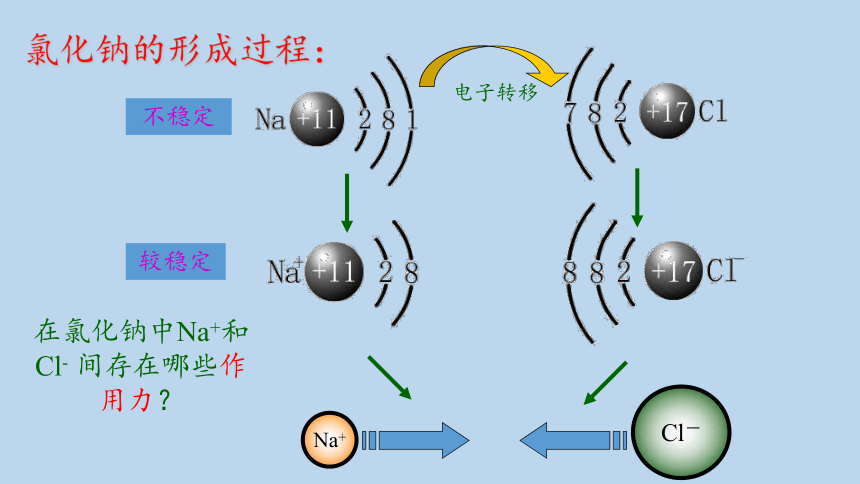
Na+
Cl-
电子转移
氯化钠的形成过程:
不稳定
较稳定
在氯化钠中Na+和Cl- 间存在哪些作用力?
化学键
一、离子键:
离子键:
带相反电荷离子间的相互作用,即阴阳离子间通过静电作用结合在一起
成键粒子:阳离子和阴离子
静电作用既包括静电引力又包括静电斥力
成键元素:一般是活泼金属K、Ca、Na、Mg与活泼非金属F、Cl、O、S等
B
练习:下列原子序数所对应的元素组中,两者可形成离子键的是( )
A.6和17 B.12和9 C.14和7 D.15和8
D
练习:下列化合物中不含离子键的是 ( )
A.(NH4)2S B.Al2(SO4)3 C.KOH D.HNO3
铵根离子(NH4+)是金属离子
化学键
一、离子键:
离子化合物:
阴阳离子间通过离子键构成的化合物(含有离子键的化合物)
离子化合物包含以下几大类:
1.大多数盐:如NaCl、MgCl2、所有的铵盐;
2.强碱:如NaOH、KOH;
3.活泼金属氧化物:Na2O、CaO
思考:所有的金属化合物都是
离子化合物吗?
特性:熔融时能导电
氯化铝(AlCl3)不能导电
B
练习:下列关于离子键和离子化合物的说法正确的是( )
A.阴阳离子通过静电引力形成离子键
B.阴阳离子间通过离子键一定能形成离子化合物
C.离子化合物一定能导电
D.形成离子键时,只能是活泼金属元素和活泼非金属元素化合
D
练习:下列的说法正确的是( )
A.凡金属元素与非金属元素化合时都形成离子键
B.溶于水可导电的化合物一定是离子化合物
C.离子化合物中的阳离子只能是金属离子
D.离子化合物中,一个阴离子可同时与多个阳离子间有静电作用
化学键
一、离子键:
用电子式表示离子键的形成:
电子式:在元素符号周围用“·”或“×”来表示原子最外层电子的式子
原子的电子式:先写元素符号,再在元素符号的周围用“·”或“×”来表示
原子最外层电子
阳离子的电子式:简单阳离子的电子式就是离子符号;复杂阳离子要标明
电子,用[ ]括上,并且在右上角标上所带电荷
化学键
一、离子键:
用电子式表示离子键的形成:
阴离子的电子式:在表示阴离子的符号外加[ ],并在右上角标上所带电荷
用电子式描述离子化合物的形成过程:
D
练习:下列电子式书写正确的是( )
A. B. C. D.
练习:下列用电子式表示化合物的形成过程是否正确:
√
K
O
K =
O
]
[
K
2-
K
[
]
Mg
2 F
Mg
F
2+
2
[
]
Ba
[
]
Cl
[
]
Cl
2+
Ba
Cl
Cl
A
B
C
×
×
共价键的形成:
我是非金属,我很少失电子
我才不会失电子给你
非金属元素之间的成键情况?
双方都不想失去电子。
共用电子对
化学键
二、共价键:
共价键:
原子间通过共用电子对所形成的相互作用
成键元素:一般是同种或不同种非金属元素
分类:
共价键
非极性键
极性键
电子对不发生偏移
电子对发生偏移
成键
特点
同种非金属元素
不同种非金属元素
组成
元素
电子对不偏移
电子对偏向Cl
化学键
二、共价键:
共价化合物:
以共用电子对形成分子的化合物(只含有共价键的化合物)
可能是离子化合物
练习:判断下面说法正误,并说明表达意义
1.含有共价键的化合物不一定是共价化合物
2.共价化合物中只有共价键,没有离子键
3.含有共价键的分子不一定形成共价化合物
4.共价化合物中不一定含有单个的小分子
可能是单质
存在:1、除稀有气体外的所有非金属单质中,如H2、Cl2、P4
2、共价化合物中,如CO2、HCl、H2SO4
3、某些离子化合物中,如Na2O2、NaOH
化学键
二、共价键:
含有共价键分子的表示方法:
一般单质和化合物的电子式书写要考虑8电子稳定结构(氢原子2电子稳定)
单质的电子式:
化合物的电子式:
用电子式描述共价化合物的形成过程:
化学键
二、共价键:
结构式:
在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去
化学式 电子式 结构式 化学式 电子式 结构式
N2 CO2
HCl H2O
NH3 CH4
化学键
三、化学键:
化学键:
使离子相结合或原子相结合的作用力,称为化学键,化学键的形成主要通
过原子的价电子间的转移或共用来实现
价电子
离子键
转移
共用
共价键
不同元素原子
同种元素原子
极性共价键
非极性共价键
化学键对物质性质的影响:
物理性质:金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是
因为其中的共价键很强,破坏时需要很多能量;NaCl等部分离
子化合物,也有很强的离子键,故熔点也较高
化学性质:N2分子中有很强的共价键,所以N2很稳定, H2S、HI等分子中
的共价键较弱,故它们受热易分解
C
练习:关于化学键的各种叙述中正确的是( )
A.在离子化合物里,只能存在离子键
B.非极性键只存在于双原子的单质分子里
C.共价化合物里,一定不存在离子键
D.不同种元素原子构成的多原子分子里,只存在极性键
D
练习:下列各组物质中化学键类型相同的是( )
A.HCl、MgCl2、NH4Cl B.H2O、Na2O、CO2
C.CaCl2、NaOH、H2O D.NH3、H2O、CO2
B
练习:下列化合物中,既有离子键,又有共价键且是非极性共价键的是( )
A.NaOH B.Na2O2 C.KHSO4 D.NH4Cl
C
练习:某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键( )
A.一定是离子键 B.一定是共价键
C.可能是离子键可能是共价键 D.以上说法都不正确
化学键
四、分子间作用力和氢键:
分子间作用力:
分子间把分子聚集在一起的作用力,又称范德华力
特点:1、分子间的作用力比化学键弱得多,它影响物质的熔沸点等物理性
质,化学键则影响化学性质
2、分子间作用力多作用于非金属分子之间,像SiO2、金刚石等由共
价键构成的晶体不存在
变化规律:对于组成和结构相似的物质,相对分子质量越大,分子间作用
力越大,物质的熔沸点越高
熔沸点:I2 > Br2 > Cl2 > F2
熔沸点:HI > HBr > HCl > HF
化学键
四、分子间作用力和氢键:
氢键:
氢原子与电负性大的原子X以共价键结合,若与电负性大、半径小的原子
Y(O、F、N等)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种
特殊的分子间或分子内相互作用,称为氢键
形成条件:O、F、N元素与活性H之间由静电作用形成相互作用
存在:氢键广泛存在于蛋白质、核酸分子中,稳定分子构型;存在于H2O、
HF、NH3等物质中,分子外氢键能大幅提高熔沸点
氢键能量远远小于化学键,但是远远大于分子间作用力
A
练习:以下关于分子间作用力的叙述错误的是( )
A.是一种较弱的化学键 B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对物质的熔沸点有影响
D.稀有气体原子间存在分子间作用力
A
练习:以下关于分子间作用力的叙述错误的是( )
A.是一种较弱的化学键
B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对物质的熔沸点有影响
D.稀有气体原子间存在分子间作用力
C
练习:下列物质的变化过程中,有共价键明显被破坏的是( )
A.I2升华 B.NaCl颗粒被粉碎 C.HCl溶于水得盐酸 D.NaOH受热熔化
4、7
练习:下列物质:1.CO2;2.NaCl;3.CaBr2;4.O2;5.NH4Cl;6.Ca(OH)2;7.N2;8.HBr;
9.NH3;10.Na2O2;试用以上编号填空:
1.只有非极性键的是_______;
2.只有极性键的是________, 写出其电子式________;
3.只有离子键的是________,写出其电子式__________;
4.有离子键,也有非极性键的是_____;既有离子键,又有极性键的是______;
5.属于离子化合物的是_______________;属于共价化合物的是_________
1、8、9
2、3
10
5、6
2、3、5、6、10
1、8、9
第三节. 化学键
一百多种元素 千千万万种物质
H2O(s)
H2O(l)
H2O(g)
H2 + O2
0℃
100℃
2000℃
这说明H2O中各原子间存在着强烈的相互作用力
在水分子中
O与H直接相邻
相互作用比较强烈
相互作用比较弱
H与H非直接相邻
复习:钠在氯气中燃烧的实验现象及反应的方程式
现象
化学方程式
Na在Cl2中剧烈燃烧,有黄色火焰,产生白烟
2Na + Cl2 ==== 2NaCl
点燃
思考:从微观的角度分析,钠原子和氯原子是怎样形成氯化钠的呢?
钠与氯是如何形成NaCl的?
Na+
Cl-
电子转移
氯化钠的形成过程:
不稳定
较稳定
在氯化钠中Na+和Cl- 间存在哪些作用力?
化学键
一、离子键:
离子键:
带相反电荷离子间的相互作用,即阴阳离子间通过静电作用结合在一起
成键粒子:阳离子和阴离子
静电作用既包括静电引力又包括静电斥力
成键元素:一般是活泼金属K、Ca、Na、Mg与活泼非金属F、Cl、O、S等
B
练习:下列原子序数所对应的元素组中,两者可形成离子键的是( )
A.6和17 B.12和9 C.14和7 D.15和8
D
练习:下列化合物中不含离子键的是 ( )
A.(NH4)2S B.Al2(SO4)3 C.KOH D.HNO3
铵根离子(NH4+)是金属离子
化学键
一、离子键:
离子化合物:
阴阳离子间通过离子键构成的化合物(含有离子键的化合物)
离子化合物包含以下几大类:
1.大多数盐:如NaCl、MgCl2、所有的铵盐;
2.强碱:如NaOH、KOH;
3.活泼金属氧化物:Na2O、CaO
思考:所有的金属化合物都是
离子化合物吗?
特性:熔融时能导电
氯化铝(AlCl3)不能导电
B
练习:下列关于离子键和离子化合物的说法正确的是( )
A.阴阳离子通过静电引力形成离子键
B.阴阳离子间通过离子键一定能形成离子化合物
C.离子化合物一定能导电
D.形成离子键时,只能是活泼金属元素和活泼非金属元素化合
D
练习:下列的说法正确的是( )
A.凡金属元素与非金属元素化合时都形成离子键
B.溶于水可导电的化合物一定是离子化合物
C.离子化合物中的阳离子只能是金属离子
D.离子化合物中,一个阴离子可同时与多个阳离子间有静电作用
化学键
一、离子键:
用电子式表示离子键的形成:
电子式:在元素符号周围用“·”或“×”来表示原子最外层电子的式子
原子的电子式:先写元素符号,再在元素符号的周围用“·”或“×”来表示
原子最外层电子
阳离子的电子式:简单阳离子的电子式就是离子符号;复杂阳离子要标明
电子,用[ ]括上,并且在右上角标上所带电荷
化学键
一、离子键:
用电子式表示离子键的形成:
阴离子的电子式:在表示阴离子的符号外加[ ],并在右上角标上所带电荷
用电子式描述离子化合物的形成过程:
D
练习:下列电子式书写正确的是( )
A. B. C. D.
练习:下列用电子式表示化合物的形成过程是否正确:
√
K
O
K =
O
]
[
K
2-
K
[
]
Mg
2 F
Mg
F
2+
2
[
]
Ba
[
]
Cl
[
]
Cl
2+
Ba
Cl
Cl
A
B
C
×
×
共价键的形成:
我是非金属,我很少失电子
我才不会失电子给你
非金属元素之间的成键情况?
双方都不想失去电子。
共用电子对
化学键
二、共价键:
共价键:
原子间通过共用电子对所形成的相互作用
成键元素:一般是同种或不同种非金属元素
分类:
共价键
非极性键
极性键
电子对不发生偏移
电子对发生偏移
成键
特点
同种非金属元素
不同种非金属元素
组成
元素
电子对不偏移
电子对偏向Cl
化学键
二、共价键:
共价化合物:
以共用电子对形成分子的化合物(只含有共价键的化合物)
可能是离子化合物
练习:判断下面说法正误,并说明表达意义
1.含有共价键的化合物不一定是共价化合物
2.共价化合物中只有共价键,没有离子键
3.含有共价键的分子不一定形成共价化合物
4.共价化合物中不一定含有单个的小分子
可能是单质
存在:1、除稀有气体外的所有非金属单质中,如H2、Cl2、P4
2、共价化合物中,如CO2、HCl、H2SO4
3、某些离子化合物中,如Na2O2、NaOH
化学键
二、共价键:
含有共价键分子的表示方法:
一般单质和化合物的电子式书写要考虑8电子稳定结构(氢原子2电子稳定)
单质的电子式:
化合物的电子式:
用电子式描述共价化合物的形成过程:
化学键
二、共价键:
结构式:
在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去
化学式 电子式 结构式 化学式 电子式 结构式
N2 CO2
HCl H2O
NH3 CH4
化学键
三、化学键:
化学键:
使离子相结合或原子相结合的作用力,称为化学键,化学键的形成主要通
过原子的价电子间的转移或共用来实现
价电子
离子键
转移
共用
共价键
不同元素原子
同种元素原子
极性共价键
非极性共价键
化学键对物质性质的影响:
物理性质:金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是
因为其中的共价键很强,破坏时需要很多能量;NaCl等部分离
子化合物,也有很强的离子键,故熔点也较高
化学性质:N2分子中有很强的共价键,所以N2很稳定, H2S、HI等分子中
的共价键较弱,故它们受热易分解
C
练习:关于化学键的各种叙述中正确的是( )
A.在离子化合物里,只能存在离子键
B.非极性键只存在于双原子的单质分子里
C.共价化合物里,一定不存在离子键
D.不同种元素原子构成的多原子分子里,只存在极性键
D
练习:下列各组物质中化学键类型相同的是( )
A.HCl、MgCl2、NH4Cl B.H2O、Na2O、CO2
C.CaCl2、NaOH、H2O D.NH3、H2O、CO2
B
练习:下列化合物中,既有离子键,又有共价键且是非极性共价键的是( )
A.NaOH B.Na2O2 C.KHSO4 D.NH4Cl
C
练习:某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键( )
A.一定是离子键 B.一定是共价键
C.可能是离子键可能是共价键 D.以上说法都不正确
化学键
四、分子间作用力和氢键:
分子间作用力:
分子间把分子聚集在一起的作用力,又称范德华力
特点:1、分子间的作用力比化学键弱得多,它影响物质的熔沸点等物理性
质,化学键则影响化学性质
2、分子间作用力多作用于非金属分子之间,像SiO2、金刚石等由共
价键构成的晶体不存在
变化规律:对于组成和结构相似的物质,相对分子质量越大,分子间作用
力越大,物质的熔沸点越高
熔沸点:I2 > Br2 > Cl2 > F2
熔沸点:HI > HBr > HCl > HF
化学键
四、分子间作用力和氢键:
氢键:
氢原子与电负性大的原子X以共价键结合,若与电负性大、半径小的原子
Y(O、F、N等)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种
特殊的分子间或分子内相互作用,称为氢键
形成条件:O、F、N元素与活性H之间由静电作用形成相互作用
存在:氢键广泛存在于蛋白质、核酸分子中,稳定分子构型;存在于H2O、
HF、NH3等物质中,分子外氢键能大幅提高熔沸点
氢键能量远远小于化学键,但是远远大于分子间作用力
A
练习:以下关于分子间作用力的叙述错误的是( )
A.是一种较弱的化学键 B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对物质的熔沸点有影响
D.稀有气体原子间存在分子间作用力
A
练习:以下关于分子间作用力的叙述错误的是( )
A.是一种较弱的化学键
B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对物质的熔沸点有影响
D.稀有气体原子间存在分子间作用力
C
练习:下列物质的变化过程中,有共价键明显被破坏的是( )
A.I2升华 B.NaCl颗粒被粉碎 C.HCl溶于水得盐酸 D.NaOH受热熔化
4、7
练习:下列物质:1.CO2;2.NaCl;3.CaBr2;4.O2;5.NH4Cl;6.Ca(OH)2;7.N2;8.HBr;
9.NH3;10.Na2O2;试用以上编号填空:
1.只有非极性键的是_______;
2.只有极性键的是________, 写出其电子式________;
3.只有离子键的是________,写出其电子式__________;
4.有离子键,也有非极性键的是_____;既有离子键,又有极性键的是______;
5.属于离子化合物的是_______________;属于共价化合物的是_________
1、8、9
2、3
10
5、6
2、3、5、6、10
1、8、9
