课题3 氧化还原反应
图片预览




文档简介
课件13张PPT。第一单元 氯、溴、碘及其化合物 课题3 氧化还原反应1、2 Na + Cl2 = 2 NaCl判断下列反应为氧化还原反应的是 4、Cl2+H2O HCl+HClO
3、H2 + Cl2 2 HCl6、Ca(ClO)2+CO2+H2O=CaCO3+2HClO5、2HClO O2↑+ 2HCl 2、2 Fe + 3Cl2 2 FeCl3相信你会判断1.元素的化合价升降的本质是什么?
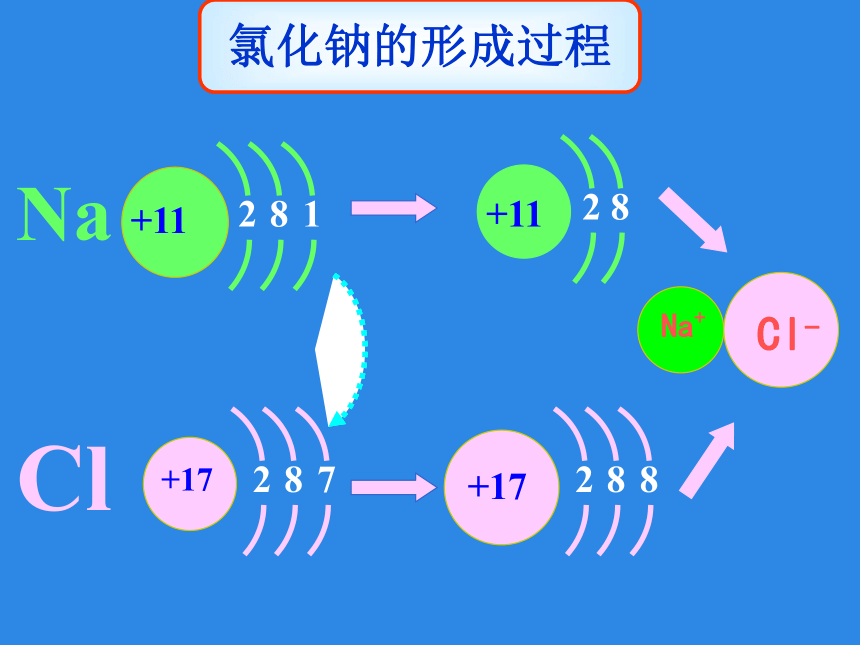
2.化合价升降的多少与电子得失数目有什么关系?活动一:氧化还原反应的特征和本质是什么?①最外层电子数﹤4 时,容易失去电子(化合价=+失去的电子数目)②最外层电子数≥4 时,容易得到电子(化合价=最外层电子数-8)氯化钠的形成过程 共用电子对偏离氢原子,故氢为 +1价共用电子对偏向氯原子,故氯为 -1价氯化氢的形成过程 氯化钠氯化氢电子得失电子对偏移电子转移[结论]
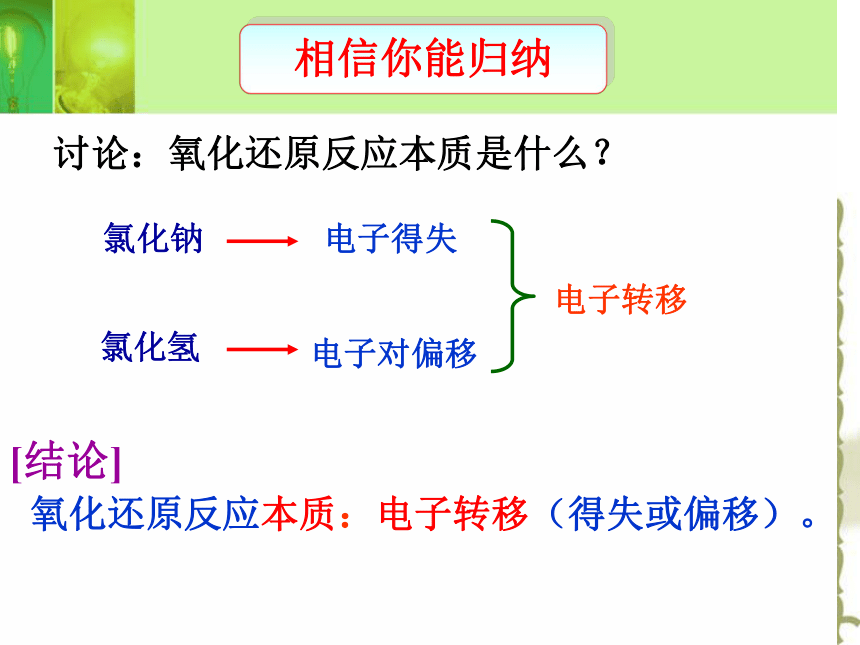
氧化还原反应本质:电子转移(得失或偏移)。相信你能归纳讨论:氧化还原反应本质是什么?☆书写步骤:1.标变价 2.画线桥 3.写数目标电子转移的数目用a×be-的形式☆b表示每个原子得失电子数(等于化合价之差)☆a表示共有多少原子得失电子 CuO + H2 === Cu + H2O
4.查电子活动二:在氧化还原反应中,怎样来表示电子的转移?+2 00+1 失去2×e- 得到1×2e-双线桥法得失电子总数相等失去 2×e-Cl2 + H2O = HCl + HClO失去e-得 到e-得到 2×2e-+4+2-100+1-11.2.动手练一练找出该反应中的氧化剂和还原剂:活动三:在氧化还原反应中,怎样判断氧化剂和还原剂?+200+1化合价降低,得到电子,氧化剂,被还原(还原反应)化合价升高,失去电子,还原剂,被氧化(氧化反应)CuO + H2 === Cu + H2O口诀:降, 得,氧;(将得氧)
升,失,还。(胜师还)(1)氧化剂:得到电子元素化合价降低的物质,具有氧化性。
还原剂:失去电子元素化合价升高的物质,具有还原性。
(2)氧化反应:物质失去电子所含元素化合价升高的反应
还原反应:物质得到电子所含元素化合价降低的反应
(3)氧化产物:还原剂被氧化的产物
还原产物:氧化剂被还原的产物几组概念相信你能归纳几组概念之间的关系还原产物
氧化剂具有氧化性得电子化合价降低发生还原反应(被还原)反应物性 质实 质特征生成物反 应还原剂具有还原性失电子化合价升高发生氧化反应(被氧化)氧化产物口诀:降, 得,氧;(将得氧)
升,失,还。(胜师还)
剂性相同,其他相反。 还原剂的风格高,
它愿把电子往外抛,
虽然把电子失去了,
最后却是价升高。还原剂赞氧化剂 + 还原剂 还原产物 + 氧化产物化合价升高,失去电子,还原剂,被氧化(氧化反应)化合价降低,得到电子,氧化剂,被还原(还原反应)氧化性: 氧化剂 > 氧化产物还原性:还原剂 > 还原产物
3、H2 + Cl2 2 HCl6、Ca(ClO)2+CO2+H2O=CaCO3+2HClO5、2HClO O2↑+ 2HCl 2、2 Fe + 3Cl2 2 FeCl3相信你会判断1.元素的化合价升降的本质是什么?
2.化合价升降的多少与电子得失数目有什么关系?活动一:氧化还原反应的特征和本质是什么?①最外层电子数﹤4 时,容易失去电子(化合价=+失去的电子数目)②最外层电子数≥4 时,容易得到电子(化合价=最外层电子数-8)氯化钠的形成过程 共用电子对偏离氢原子,故氢为 +1价共用电子对偏向氯原子,故氯为 -1价氯化氢的形成过程 氯化钠氯化氢电子得失电子对偏移电子转移[结论]
氧化还原反应本质:电子转移(得失或偏移)。相信你能归纳讨论:氧化还原反应本质是什么?☆书写步骤:1.标变价 2.画线桥 3.写数目标电子转移的数目用a×be-的形式☆b表示每个原子得失电子数(等于化合价之差)☆a表示共有多少原子得失电子 CuO + H2 === Cu + H2O
4.查电子活动二:在氧化还原反应中,怎样来表示电子的转移?+2 00+1 失去2×e- 得到1×2e-双线桥法得失电子总数相等失去 2×e-Cl2 + H2O = HCl + HClO失去e-得 到e-得到 2×2e-+4+2-100+1-11.2.动手练一练找出该反应中的氧化剂和还原剂:活动三:在氧化还原反应中,怎样判断氧化剂和还原剂?+200+1化合价降低,得到电子,氧化剂,被还原(还原反应)化合价升高,失去电子,还原剂,被氧化(氧化反应)CuO + H2 === Cu + H2O口诀:降, 得,氧;(将得氧)
升,失,还。(胜师还)(1)氧化剂:得到电子元素化合价降低的物质,具有氧化性。
还原剂:失去电子元素化合价升高的物质,具有还原性。
(2)氧化反应:物质失去电子所含元素化合价升高的反应
还原反应:物质得到电子所含元素化合价降低的反应
(3)氧化产物:还原剂被氧化的产物
还原产物:氧化剂被还原的产物几组概念相信你能归纳几组概念之间的关系还原产物
氧化剂具有氧化性得电子化合价降低发生还原反应(被还原)反应物性 质实 质特征生成物反 应还原剂具有还原性失电子化合价升高发生氧化反应(被氧化)氧化产物口诀:降, 得,氧;(将得氧)
升,失,还。(胜师还)
剂性相同,其他相反。 还原剂的风格高,
它愿把电子往外抛,
虽然把电子失去了,
最后却是价升高。还原剂赞氧化剂 + 还原剂 还原产物 + 氧化产物化合价升高,失去电子,还原剂,被氧化(氧化反应)化合价降低,得到电子,氧化剂,被还原(还原反应)氧化性: 氧化剂 > 氧化产物还原性:还原剂 > 还原产物
