课题4 溴、碘的提取
图片预览





文档简介
课件18张PPT。几组概念之间的关系还原产物
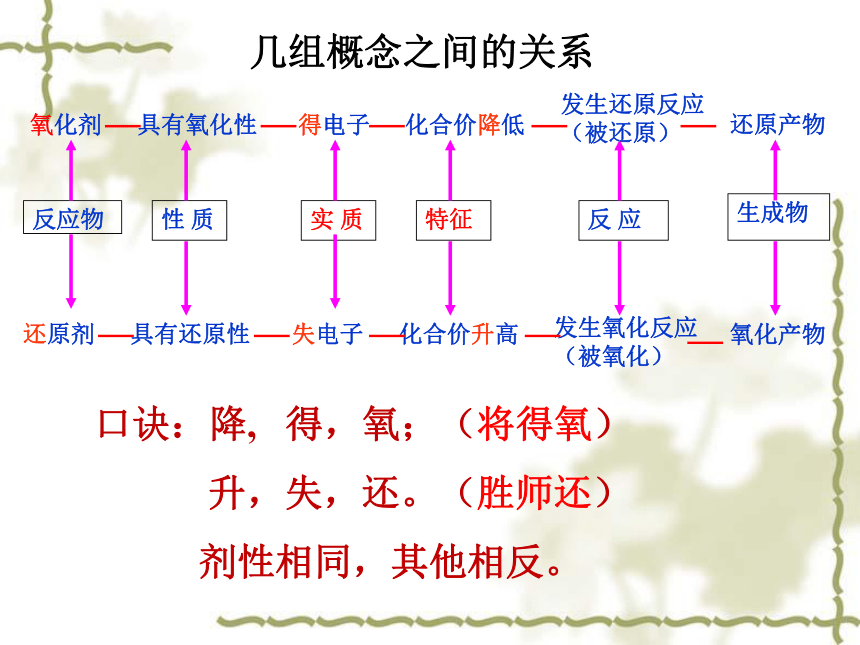
氧化剂具有氧化性得电子化合价降低发生还原反应(被还原)反应物性 质实 质特征生成物反 应还原剂具有还原性失电子化合价升高发生氧化反应(被氧化)氧化产物口诀:降, 得,氧;(将得氧)
升,失,还。(胜师还)
剂性相同,其他相反。 还原剂的风格高,
它愿把电子往外抛,
虽然把电子失去了,
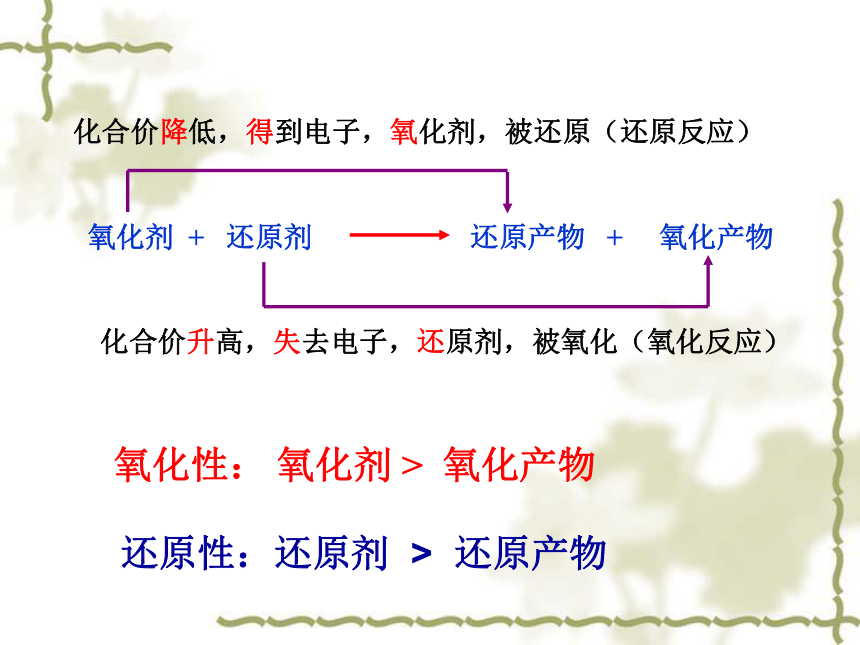
最后却是价升高。还原剂赞氧化剂 + 还原剂 还原产物 + 氧化产物化合价升高,失去电子,还原剂,被氧化(氧化反应)化合价降低,得到电子,氧化剂,被还原(还原反应)氧化性: 氧化剂 > 氧化产物还原性:还原剂 > 还原产物4)Cl2 + 2NaOH== NaCl + NaClO+H2O指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物第一单元 氯、溴、碘及其化合物 溴、碘的提取溴(Br2):深红棕色液体、密度比水大;在水中溶解度很小;易挥发;易溶于酒精、四氯化碳等有机溶剂。溴的保存:
密闭保存,常往盛溴的试剂瓶中加入一些水——水封1、溴的物理性质常温下, Br2唯一呈液态状的非金属单质一、溴、碘的性质2、碘的物理性质碘(I2):紫黑色固体、密度比水大,在水中溶解度很小;易升华;易溶于酒精、四氯化碳等有机溶剂。
特性:碘I2能使淀粉变蓝3、溴、碘的化学性质(和氯气相似) 1)与金属单质反应2)与非金属单质反应
3)与水反应
4)与碱反应Fe+ Br2 点燃 Fe+ I2 △ 23==FeBr32==FeI22实验室常用硝酸银溶液和稀硝酸来检验Cl- 4、Cl-、 Br- 、 I-的鉴别Cl-、 Br- 、 I-的鉴别生成不溶于稀硝酸的白色沉淀生成不溶于稀硝酸的淡黄色沉淀生成不溶于稀硝酸的黄色沉淀NaCl + AgNO3 = AgCl + NaNO3NaBr + AgNO3 = AgBr + NaNO3NaI + AgNO3 = AgI + NaNO3AgBr二、溴、碘及其化合物的用途溴:熏蒸剂、杀虫剂、抗爆剂
AgBr 感光材料
碘:药用、食品
AgI人工降雨
AgI溴元素:海洋总储量1×1014t,“海洋元素”碘元素:8×1010t 在海洋中主要存在形式:NaBr在海洋中主要存在形式:KICl2
活动与探究分层,上层接近无色,下层呈橙红色分层,上层接近无色,下层呈紫红色分层,上层接近无色,下层呈紫红色Cl2+2KBr=Br2+2KClCl2+2KI=I2+2KClBr2+2KI=I2+2KBrCl2+2KBr==Br2+2KCl
Cl2+2KI==I2+2KCl
Br2+2KI==I2+2KBr找出以下三个反应的氧化剂,还原剂以及氧化产物和还原产物,并比较氧化性和还原性的强弱。氧化剂 还原剂 氧化产物 还原产物 ;氧化剂 还原剂 氧化产物 还原产物 ;氧化剂 还原剂 氧化产物 还原产物 。结论:氧化性Cl2 > Br2 > I2 ,还原性 Cl -
氧化剂具有氧化性得电子化合价降低发生还原反应(被还原)反应物性 质实 质特征生成物反 应还原剂具有还原性失电子化合价升高发生氧化反应(被氧化)氧化产物口诀:降, 得,氧;(将得氧)
升,失,还。(胜师还)
剂性相同,其他相反。 还原剂的风格高,
它愿把电子往外抛,
虽然把电子失去了,
最后却是价升高。还原剂赞氧化剂 + 还原剂 还原产物 + 氧化产物化合价升高,失去电子,还原剂,被氧化(氧化反应)化合价降低,得到电子,氧化剂,被还原(还原反应)氧化性: 氧化剂 > 氧化产物还原性:还原剂 > 还原产物4)Cl2 + 2NaOH== NaCl + NaClO+H2O指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物第一单元 氯、溴、碘及其化合物 溴、碘的提取溴(Br2):深红棕色液体、密度比水大;在水中溶解度很小;易挥发;易溶于酒精、四氯化碳等有机溶剂。溴的保存:
密闭保存,常往盛溴的试剂瓶中加入一些水——水封1、溴的物理性质常温下, Br2唯一呈液态状的非金属单质一、溴、碘的性质2、碘的物理性质碘(I2):紫黑色固体、密度比水大,在水中溶解度很小;易升华;易溶于酒精、四氯化碳等有机溶剂。
特性:碘I2能使淀粉变蓝3、溴、碘的化学性质(和氯气相似) 1)与金属单质反应2)与非金属单质反应
3)与水反应
4)与碱反应Fe+ Br2 点燃 Fe+ I2 △ 23==FeBr32==FeI22实验室常用硝酸银溶液和稀硝酸来检验Cl- 4、Cl-、 Br- 、 I-的鉴别Cl-、 Br- 、 I-的鉴别生成不溶于稀硝酸的白色沉淀生成不溶于稀硝酸的淡黄色沉淀生成不溶于稀硝酸的黄色沉淀NaCl + AgNO3 = AgCl + NaNO3NaBr + AgNO3 = AgBr + NaNO3NaI + AgNO3 = AgI + NaNO3AgBr二、溴、碘及其化合物的用途溴:熏蒸剂、杀虫剂、抗爆剂
AgBr 感光材料
碘:药用、食品
AgI人工降雨
AgI溴元素:海洋总储量1×1014t,“海洋元素”碘元素:8×1010t 在海洋中主要存在形式:NaBr在海洋中主要存在形式:KICl2
活动与探究分层,上层接近无色,下层呈橙红色分层,上层接近无色,下层呈紫红色分层,上层接近无色,下层呈紫红色Cl2+2KBr=Br2+2KClCl2+2KI=I2+2KClBr2+2KI=I2+2KBrCl2+2KBr==Br2+2KCl
Cl2+2KI==I2+2KCl
Br2+2KI==I2+2KBr找出以下三个反应的氧化剂,还原剂以及氧化产物和还原产物,并比较氧化性和还原性的强弱。氧化剂 还原剂 氧化产物 还原产物 ;氧化剂 还原剂 氧化产物 还原产物 ;氧化剂 还原剂 氧化产物 还原产物 。结论:氧化性Cl2 > Br2 > I2 ,还原性 Cl -
