四川省成都七中2013-2014学年高二上学期期中考试化学试题
文档属性
| 名称 | 四川省成都七中2013-2014学年高二上学期期中考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 285.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-11-04 12:10:21 | ||
图片预览


文档简介
成都七中2013-2014学年高二上学期期中考试化学试题
可能用到的原子量:H—1 C—12 N—14 O—16 S—32
第Ⅰ卷 选择题(共42分)
一、选择题(每题只有一个选项符合题意,每小题3分,共42分)
1、下列电子排布中,原子处于激发状态的是( )
A.1s22s2 B.1s22s22p5 C.1s22s22p63s23p63d54s1 D. 1s22s22p63s23p63d104s14p3
2、下列现象与氢键有关的是:
①H2O的熔、沸点比ⅥA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④科学家测得氟化氢真实组成为(HF)n
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子是很稳定的分子
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
3、类比推测法是化学研究中重要的一种方法,下列推测正确的是( )
CH4的稳定性高于SiH4,可推测CH4的沸点也高于SiH4
NH4+为正四面体结构,可推测PH4+也为正四面体结构
CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
4、关于杂化轨道类型,下列判断错误的是( )
苯和石墨中的C都采取的是sp2杂化类型
N2H4中的N和HClO中的O都采取的是sp3杂化类型
葡萄糖中的C都采取的是sp3杂化类型
CS2和C2H2中的C都采取的是sp杂化类型
5、用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
SO2、CS2、HI都是直线型的分子
BF3键角为120°,SnBr2键角大于120°
COCl2、BF3、SO3都是平面三角型的分子
PCl3、NH3、PCl5都是三角锥型的分子
6、关于原子轨道的说法正确的是( )
A. 凡是中心原子采取sp3杂化轨道成键的分子其键角一定是109°28′
B. 能层符号为N的能层一共含有9个原子轨道,最多能够容纳18个电子
C. sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混杂起来形成的一组新轨道
D.凡AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键
7、下列有关金属晶体的堆积模型的说法正确的是( )
A.金属晶体中的原子在二维空间有三种放置方式
B.金属晶体中非密置层在三维空间可形成两种堆积方式,其配位数都是6
C.镁型堆积和铜型堆积是密置层在三维空间形成的两种堆积方式,其配位数都是12
D.金属晶体中的原子在三维空间的堆积有多种方式,其空间的利用率相同
8、下列说法正确的是( )
A.熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体
B.单质熔点97.81℃,是热和电的良导体,该晶体最可能是分子晶体
C.SiO2晶体属于原子晶体,1mol的SiO2晶体含有4NA的Si-O键(NA为阿伏伽德罗常数)
D.固态金属单质都是金属晶体,金属晶体含有金属键。非金属单质晶体都是分子晶体,分子晶体主要含有共价键,范德华力,有些分子晶体还含有氢键。
9、下列叙述正确的是( )
①配位键在形成时,是由成键双方各提供一个电子形成共用电子对 ②价电子排布式为ns2的原子属于ⅠA或ⅡA族元素 ③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素 ④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子 ⑤化合物NH4Cl和CuSO4·5H2O都存在配位键 ⑥AgCl是一种白色的沉淀,不溶于硝酸溶液,浓硫酸溶液,烧碱溶液,却能溶于氨水中
A.①③ B.②③ C.⑤⑥ D.④⑤
11、下列说法正确的是( )
A.原子晶体中一定含有共价键;离子晶体中一定含有离子键,可能含有共价键;分子晶体中一定存在分子间作用力和共价键。
B.晶格能是指离子形成1mol离子晶体释放的能量,通常取正值。
C.含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子。
D.元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐渐增大
12、石墨烯(Graphene)是一种由碳原子构成的单层片状结构的新材料,是一种由碳原子组成六角型呈蜂巢晶格的平面薄膜,只有一个碳原子厚度的二维材料(结构示意图如图),可由石墨剥离而成。2013年10月18日,欧盟启动总投资10亿欧元的石墨烯半导体材料技术研究项目。对于石墨烯
下列说法正确的是( )
A.石墨烯与石墨互为同位素
B.石墨烯是一种有机物
C.石墨烯中碳原子数与C-C键数之比为2:3
D.石墨烯中C原子杂化类型与乙醇中的C原子杂化类型相同
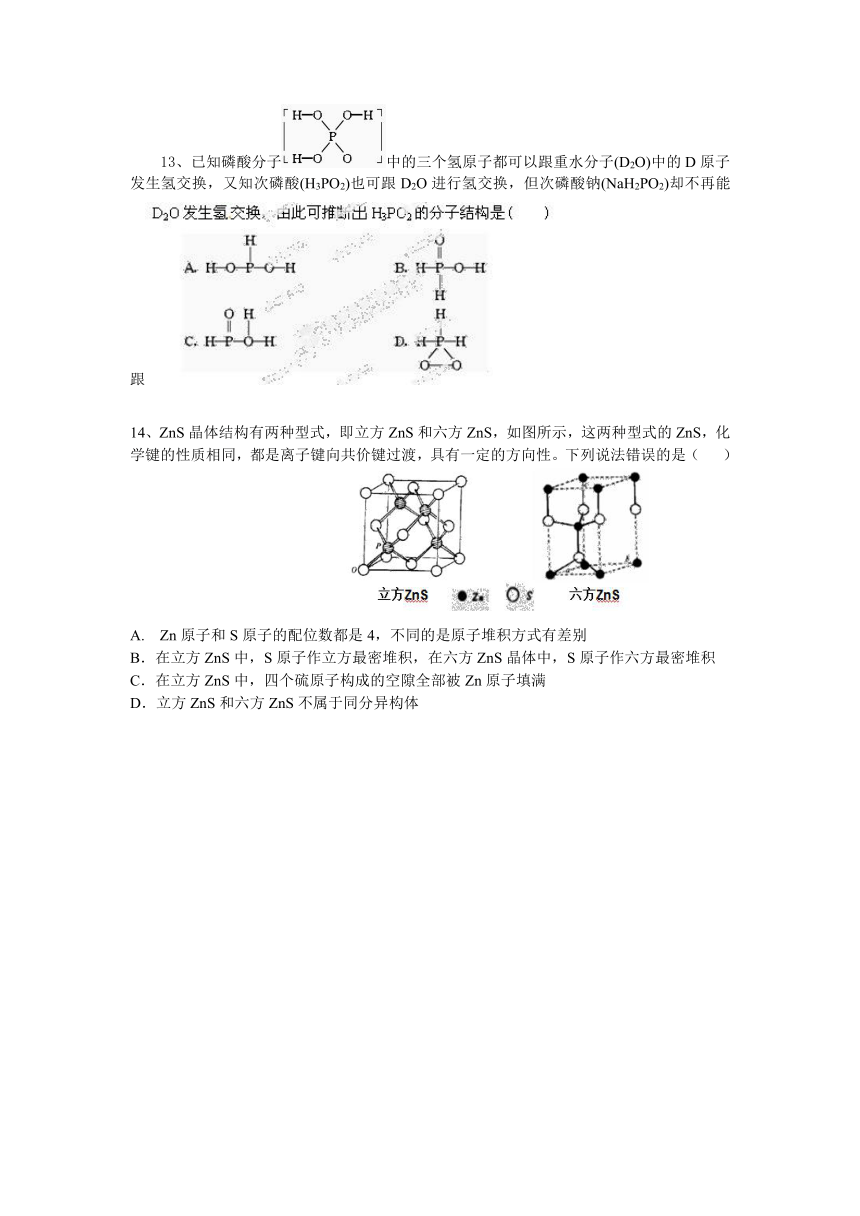
13、已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟
14、ZnS晶体结构有两种型式,即立方ZnS和六方ZnS,如图所示,这两种型式的ZnS,化学键的性质相同,都是离子键向共价键过渡,具有一定的方向性。下列说法错误的是( )
A. Zn原子和S原子的配位数都是4,不同的是原子堆积方式有差别
B.在立方ZnS中,S原子作立方最密堆积,在六方ZnS晶体中,S原子作六方最密堆积
C.在立方ZnS中,四个硫原子构成的空隙全部被Zn原子填满
D.立方ZnS和六方ZnS不属于同分异构体
第Ⅱ卷 非选择题(共58分)
试回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式 。
(2)D的气态氢化物的VSEPR模型为 _ ,其中心原子的杂化类型为__ _ _ _ _ _ 。
(3)由A、C、D形成的ACD分子中,σ键个数:π键个数=__________。
(4)要证明太阳上是否含有R 元素,可采用的方法是 。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有_______________(填元素符号)
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___________________________(填分子式)。
16、(共8分)我国高校目前联合研究一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为________________。
(2)试从结构角度解释H2SO4的酸性大于H2SO3的酸性:_____________________________________________________。
(3)据报道,Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应生成H2N-NH2, H2N-NH2能否作配体?_____________(填“能”或“否”)
②肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。已知NH3能与盐酸反应形成一种含有配位键的离子化合物,试写出N2H4与盐酸反应的离子方程式:__________________________________________
③欲比较CaO与NaCl的晶格能大小,需考虑的数据是______________________________________________________________________;已知MgCO3、CaCO3、SrCO3、BaCO3晶格能依次减小,而它们的热分解温度依次升高,原因是:___________________________________________________________________。
17、(共10分)前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。 回答下列问题: (1)C在元素周期表中的位置是________,属于____区元素; D2+的价层电子排布式图为_____________________________。 (2)四种元素中第一电离最小的是______________,电负性最大的是________。(均填元素符号) (3)A、B和D三种元素组成的一个化合物的晶胞如图所示。 该化合物的化学式为__________________;
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____________________;该化合物中存在一个复杂离子,该离子的化学式为_____________________,配位体是__________________。
18、(共10分)已知尿素的结构式为: 尿素可用于制有机铁肥,主要代表物有三硝酸
六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)C、N、O三种元素的第一电离能由大到小的顺序是 ;电负性由大到小的顺序是_____________。
(2)尿素分子中C和N原子的杂化方式分别是 。
(3)NH4+中H—N—H键角比NH3中H—N—H键角大,原因为 。
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu的原子个数比为___________。
(5)[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(Ⅲ)之间的作用力是_________________。FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是_______________________。化合物FeCl3是棕色固体、易潮解、100℃左右时升华,它的晶体类型是_______________;KSCN中的阴离子与CO2互为等电子体,该阴离子的电子式是___________________________。
19、(共8分)在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7。其中A、C两元素原子的次外层电子数为8,B、D两元 素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置__________________; D元素基态原子电子排布式为___________________。
(2)E的氢化物在同族元素中沸点最高的原因是_____________________。
(3)C原子构成的金属晶体原子堆积方式为:_______________,空间利用率为__________。
(4)已知B离子类似Cu2+能与NH3形成配合离子,且两者配位数也相同,请类比Cu(OH)2溶于氨水的反应,写出B的氢氧化物溶于氨水的反应方程式:_________________________________。
(5)A元素可与E元素形成离子化合物,它的晶胞如右图所示,E离子的配位数为__________。每个A离子周围与之最近等距的A离子有________个。
20、(共12分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
电离能(kJ/mol)
I1
I2
I3
I4
A
932
1821
15390
21771
B
738
1451
7733
10540
①某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 原理。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
答案及评分标准
二、非选择题(共58分)
15(评分标准:共10分,除第5题的第①③小题2分外,其余每空1分)
(1)2Mg+CO2=2MgO+C (2)四面体 sp3 (3)1:1
(4)对太阳光进行光谱分析(5)①K、Cu ②非极性 ③ C2H4、CH2O
16(评分标准:共8分,第1题和第2题每题2分外,其余每空1分)
(1)3d54s2
(2)硫酸分子中的非羟基氧原子数比亚硫酸多,硫酸中心原子硫价态高,易于电离出H+
(3)①能 ②N2H4+2H+=[N2H6]2+ ③钙离子、氧离子与钠离子、氯离子的离子半径与离子所带的电荷数 热分解温度除与晶格能有关外,还与产物MgO、CaO、SrO、BaO稳定性等因素有关
17(评分标准:共10分,除第4题第一空2分外,其余每空1分)
↑↓
↑↓
↑↓
↑
↑
(1)第四周期第Ⅷ族 d
(2)K F
(3)K2NiF4 (4)离子键 配位键 [FeF6]3- F-
19(评分标准:共8分,每空1分)、
(1)第4周期ⅡB族;1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5
(2)E的氢化物分子间存在氢键,破坏它需要较高的能量,所以沸点较高
(3)体心立方堆积 68%
(4)Zn(OH)2+4NH3=[Zn(NH3)4](OH)2
(5)4 12
可能用到的原子量:H—1 C—12 N—14 O—16 S—32
第Ⅰ卷 选择题(共42分)
一、选择题(每题只有一个选项符合题意,每小题3分,共42分)
1、下列电子排布中,原子处于激发状态的是( )
A.1s22s2 B.1s22s22p5 C.1s22s22p63s23p63d54s1 D. 1s22s22p63s23p63d104s14p3
2、下列现象与氢键有关的是:
①H2O的熔、沸点比ⅥA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④科学家测得氟化氢真实组成为(HF)n
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子是很稳定的分子
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
3、类比推测法是化学研究中重要的一种方法,下列推测正确的是( )
CH4的稳定性高于SiH4,可推测CH4的沸点也高于SiH4
NH4+为正四面体结构,可推测PH4+也为正四面体结构
CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
4、关于杂化轨道类型,下列判断错误的是( )
苯和石墨中的C都采取的是sp2杂化类型
N2H4中的N和HClO中的O都采取的是sp3杂化类型
葡萄糖中的C都采取的是sp3杂化类型
CS2和C2H2中的C都采取的是sp杂化类型
5、用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
SO2、CS2、HI都是直线型的分子
BF3键角为120°,SnBr2键角大于120°
COCl2、BF3、SO3都是平面三角型的分子
PCl3、NH3、PCl5都是三角锥型的分子
6、关于原子轨道的说法正确的是( )
A. 凡是中心原子采取sp3杂化轨道成键的分子其键角一定是109°28′
B. 能层符号为N的能层一共含有9个原子轨道,最多能够容纳18个电子
C. sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混杂起来形成的一组新轨道
D.凡AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键
7、下列有关金属晶体的堆积模型的说法正确的是( )
A.金属晶体中的原子在二维空间有三种放置方式
B.金属晶体中非密置层在三维空间可形成两种堆积方式,其配位数都是6
C.镁型堆积和铜型堆积是密置层在三维空间形成的两种堆积方式,其配位数都是12
D.金属晶体中的原子在三维空间的堆积有多种方式,其空间的利用率相同
8、下列说法正确的是( )
A.熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体
B.单质熔点97.81℃,是热和电的良导体,该晶体最可能是分子晶体
C.SiO2晶体属于原子晶体,1mol的SiO2晶体含有4NA的Si-O键(NA为阿伏伽德罗常数)
D.固态金属单质都是金属晶体,金属晶体含有金属键。非金属单质晶体都是分子晶体,分子晶体主要含有共价键,范德华力,有些分子晶体还含有氢键。
9、下列叙述正确的是( )
①配位键在形成时,是由成键双方各提供一个电子形成共用电子对 ②价电子排布式为ns2的原子属于ⅠA或ⅡA族元素 ③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素 ④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子 ⑤化合物NH4Cl和CuSO4·5H2O都存在配位键 ⑥AgCl是一种白色的沉淀,不溶于硝酸溶液,浓硫酸溶液,烧碱溶液,却能溶于氨水中
A.①③ B.②③ C.⑤⑥ D.④⑤
11、下列说法正确的是( )
A.原子晶体中一定含有共价键;离子晶体中一定含有离子键,可能含有共价键;分子晶体中一定存在分子间作用力和共价键。
B.晶格能是指离子形成1mol离子晶体释放的能量,通常取正值。
C.含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子。
D.元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐渐增大
12、石墨烯(Graphene)是一种由碳原子构成的单层片状结构的新材料,是一种由碳原子组成六角型呈蜂巢晶格的平面薄膜,只有一个碳原子厚度的二维材料(结构示意图如图),可由石墨剥离而成。2013年10月18日,欧盟启动总投资10亿欧元的石墨烯半导体材料技术研究项目。对于石墨烯
下列说法正确的是( )
A.石墨烯与石墨互为同位素
B.石墨烯是一种有机物
C.石墨烯中碳原子数与C-C键数之比为2:3
D.石墨烯中C原子杂化类型与乙醇中的C原子杂化类型相同
13、已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟
14、ZnS晶体结构有两种型式,即立方ZnS和六方ZnS,如图所示,这两种型式的ZnS,化学键的性质相同,都是离子键向共价键过渡,具有一定的方向性。下列说法错误的是( )
A. Zn原子和S原子的配位数都是4,不同的是原子堆积方式有差别
B.在立方ZnS中,S原子作立方最密堆积,在六方ZnS晶体中,S原子作六方最密堆积
C.在立方ZnS中,四个硫原子构成的空隙全部被Zn原子填满
D.立方ZnS和六方ZnS不属于同分异构体
第Ⅱ卷 非选择题(共58分)
试回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式 。
(2)D的气态氢化物的VSEPR模型为 _ ,其中心原子的杂化类型为__ _ _ _ _ _ 。
(3)由A、C、D形成的ACD分子中,σ键个数:π键个数=__________。
(4)要证明太阳上是否含有R 元素,可采用的方法是 。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有_______________(填元素符号)
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___________________________(填分子式)。
16、(共8分)我国高校目前联合研究一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为________________。
(2)试从结构角度解释H2SO4的酸性大于H2SO3的酸性:_____________________________________________________。
(3)据报道,Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应生成H2N-NH2, H2N-NH2能否作配体?_____________(填“能”或“否”)
②肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。已知NH3能与盐酸反应形成一种含有配位键的离子化合物,试写出N2H4与盐酸反应的离子方程式:__________________________________________
③欲比较CaO与NaCl的晶格能大小,需考虑的数据是______________________________________________________________________;已知MgCO3、CaCO3、SrCO3、BaCO3晶格能依次减小,而它们的热分解温度依次升高,原因是:___________________________________________________________________。
17、(共10分)前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。 回答下列问题: (1)C在元素周期表中的位置是________,属于____区元素; D2+的价层电子排布式图为_____________________________。 (2)四种元素中第一电离最小的是______________,电负性最大的是________。(均填元素符号) (3)A、B和D三种元素组成的一个化合物的晶胞如图所示。 该化合物的化学式为__________________;
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____________________;该化合物中存在一个复杂离子,该离子的化学式为_____________________,配位体是__________________。
18、(共10分)已知尿素的结构式为: 尿素可用于制有机铁肥,主要代表物有三硝酸
六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)C、N、O三种元素的第一电离能由大到小的顺序是 ;电负性由大到小的顺序是_____________。
(2)尿素分子中C和N原子的杂化方式分别是 。
(3)NH4+中H—N—H键角比NH3中H—N—H键角大,原因为 。
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu的原子个数比为___________。
(5)[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(Ⅲ)之间的作用力是_________________。FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是_______________________。化合物FeCl3是棕色固体、易潮解、100℃左右时升华,它的晶体类型是_______________;KSCN中的阴离子与CO2互为等电子体,该阴离子的电子式是___________________________。
19、(共8分)在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7。其中A、C两元素原子的次外层电子数为8,B、D两元 素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置__________________; D元素基态原子电子排布式为___________________。
(2)E的氢化物在同族元素中沸点最高的原因是_____________________。
(3)C原子构成的金属晶体原子堆积方式为:_______________,空间利用率为__________。
(4)已知B离子类似Cu2+能与NH3形成配合离子,且两者配位数也相同,请类比Cu(OH)2溶于氨水的反应,写出B的氢氧化物溶于氨水的反应方程式:_________________________________。
(5)A元素可与E元素形成离子化合物,它的晶胞如右图所示,E离子的配位数为__________。每个A离子周围与之最近等距的A离子有________个。
20、(共12分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
电离能(kJ/mol)
I1
I2
I3
I4
A
932
1821
15390
21771
B
738
1451
7733
10540
①某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 原理。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
答案及评分标准
二、非选择题(共58分)
15(评分标准:共10分,除第5题的第①③小题2分外,其余每空1分)
(1)2Mg+CO2=2MgO+C (2)四面体 sp3 (3)1:1
(4)对太阳光进行光谱分析(5)①K、Cu ②非极性 ③ C2H4、CH2O
16(评分标准:共8分,第1题和第2题每题2分外,其余每空1分)
(1)3d54s2
(2)硫酸分子中的非羟基氧原子数比亚硫酸多,硫酸中心原子硫价态高,易于电离出H+
(3)①能 ②N2H4+2H+=[N2H6]2+ ③钙离子、氧离子与钠离子、氯离子的离子半径与离子所带的电荷数 热分解温度除与晶格能有关外,还与产物MgO、CaO、SrO、BaO稳定性等因素有关
17(评分标准:共10分,除第4题第一空2分外,其余每空1分)
↑↓
↑↓
↑↓
↑
↑
(1)第四周期第Ⅷ族 d
(2)K F
(3)K2NiF4 (4)离子键 配位键 [FeF6]3- F-
19(评分标准:共8分,每空1分)、
(1)第4周期ⅡB族;1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5
(2)E的氢化物分子间存在氢键,破坏它需要较高的能量,所以沸点较高
(3)体心立方堆积 68%
(4)Zn(OH)2+4NH3=[Zn(NH3)4](OH)2
(5)4 12
同课章节目录
