高中化学 人教版(2019)必修一 1.1物质的分类及转化(1)(课件共17页)
文档属性
| 名称 | 高中化学 人教版(2019)必修一 1.1物质的分类及转化(1)(课件共17页) |  | |
| 格式 | zip | ||
| 文件大小 | 33.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-11 14:11:12 | ||
图片预览



文档简介
(共17张PPT)
有序的物质世界
——物质的分类
第一章 物质及其变化
第一节 物质的分类及转化(1)
深圳雅昌艺术中心“Artron Wall”
全球最大艺术图书书墙
交流研讨
你在图书馆是如何找书的?
书籍分类的意义是什么?
其他分类的例子?
交流研讨
人们总在追求有序!
交流研讨
如何对物质进行分类呢?
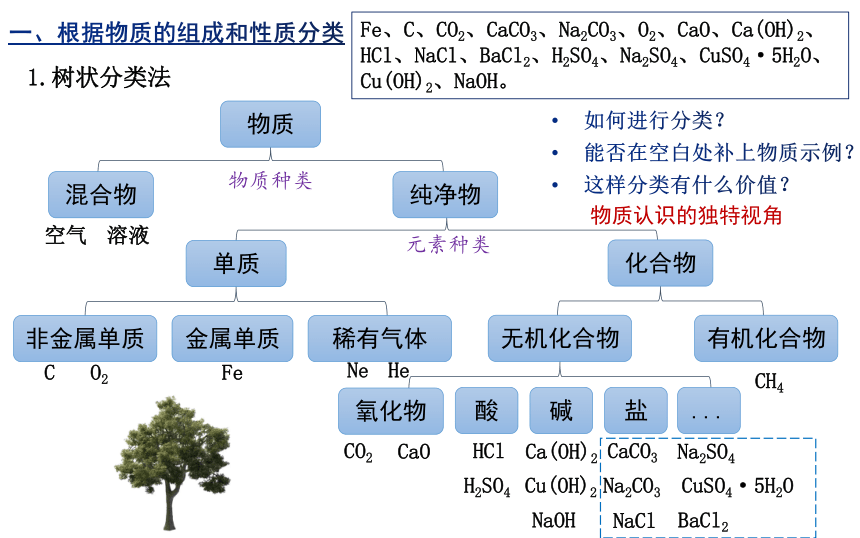
按照物质类别将下列物质分类:Fe、C、CO2、CaCO3、Na2CO3、O2、CaO、Ca(OH)2、HCl、NaCl、BaCl2、H2SO4、Na2SO4、CuSO4·5H2O、Cu(OH)2、NaOH、AgNO3。
你有哪些分类方法?
分类的依据是什么?
一、根据物质的组成和性质分类
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
Fe、C、CO2、CaCO3、Na2CO3、O2、CaO、Ca(OH)2、HCl、NaCl、BaCl2、H2SO4、Na2SO4、CuSO4·5H2O、Cu(OH)2、NaOH。
1.树状分类法
Fe
C
CO2
CaCO3
Na2CO3
O2
CaO
Ca(OH)2
HCl
NaCl
H2SO4
Na2SO4
CuSO4·5H2O
Cu(OH)2
NaOH
BaCl2
如何进行分类?
能否在空白处补上物质示例?
这样分类有什么价值?
Ne
He
CH4
物质认识的独特视角
空气
溶液
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
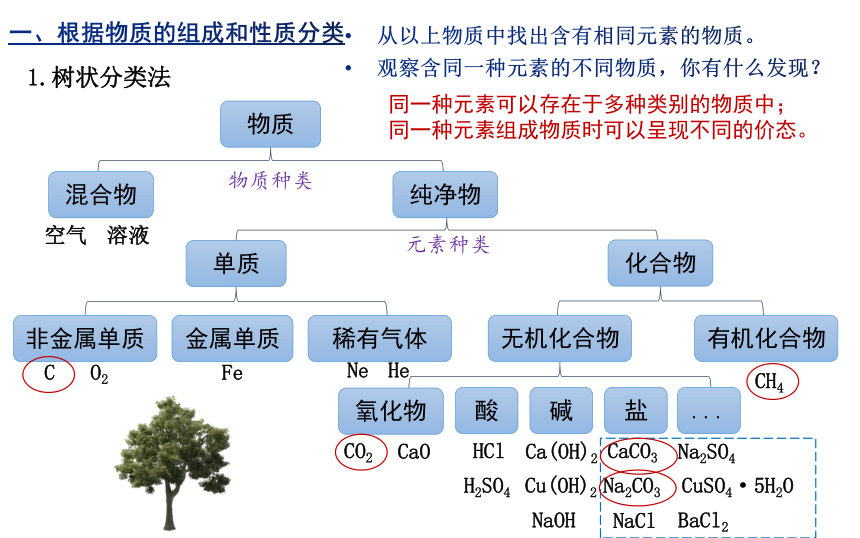
Fe
C
CO2
CaCO3
Na2CO3
O2
CaO
Ca(OH)2
HCl
NaCl
H2SO4
Na2SO4
Cu(OH)2
NaOH
Ne
He
从以上物质中找出含有相同元素的物质。
观察含同一种元素的不同物质,你有什么发现?
同一种元素可以存在于多种类别的物质中;
同一种元素组成物质时可以呈现不同的价态。
CH4
1.树状分类法
一、根据物质的组成和性质分类
CuSO4·5H2O
BaCl2
溶液
空气
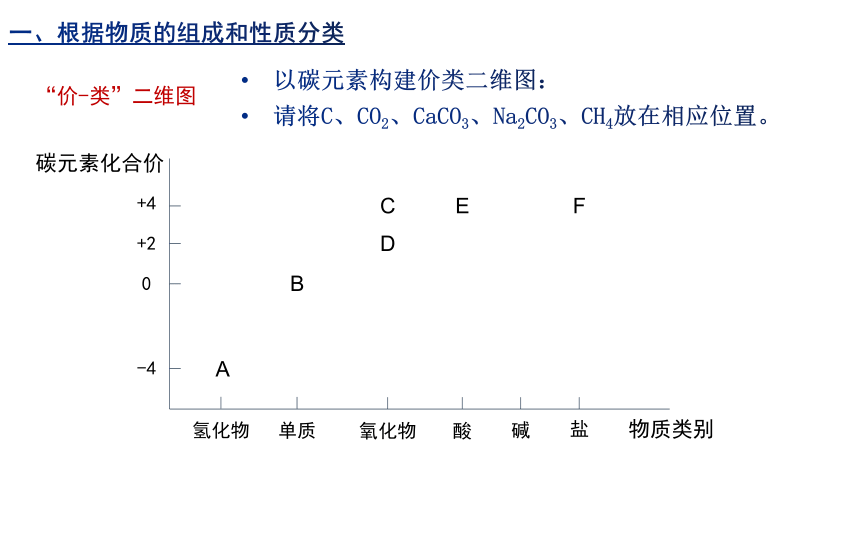
以碳元素构建价类二维图:
请将C、CO2、CaCO3、Na2CO3、CH4放在相应位置。
“价-类”二维图
碳元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-4
0
+2
+4
一、根据物质的组成和性质分类
A
B
C
D
E
F
以碳元素构建价类二维图:
请将C、CO2、CaCO3、Na2CO3、CH4放在相应位置。
补充其他的含碳物质。
“价-类”二维图
碳元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-4
0
+2
+4
一、根据物质的组成和性质分类
C
CO2
CO
CaCO3
CH4
H2CO3
Na2CO3
NaHCO3
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
Fe
C
CO2
CaCO3
Na2CO3
O2
CaO
Ca(OH)2
HCl
NaCl
H2SO4
Na2SO4
Cu(OH)2
NaOH
AgNO3
Ne
He
树状分类法只是根据组成分类吗?
各类物质分别具有哪些相似的性质?
CH4
1.树状分类法
一、根据物质的组成和性质分类
CuSO4·5H2O
CO2
氧化物
...
酸性氧化物能与碱反应生成盐和水
碱性氧化物能与酸反应生成盐和水
能否举出其他的酸性氧化物示例?
能否举出其他的碱性氧化物示例?
酸性氧化物和碱性氧化物还有什么共性?
CO属于哪类?
酸性氧化物
碱性氧化物
1.树状分类法
一、根据物质的组成和性质分类
多数酸性氧化物能与水化合生成酸;
部分碱性氧化物能与水化合生成碱。
SO2、SO3、SiO2等
CaO
MgO、CuO、FeO、Fe2O3、HgO、Ag2O、K2O、Na2O等
不成盐氧化物
CO、NO、NO2
两性氧化物
Al2O3
(多数非金属氧化物)
(多数金属氧化物)
CO2
CaO
非金属氧化物不一定是酸性氧化物:CO、NO、NO2(不成盐氧化物)
金属氧化物不一定是碱性氧化物:Al2O3(两性氧化物)、Mn2O7(酸性氧化物)、Fe3O4(不成盐氧化物)
一般中总有特殊!
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
1.树状分类法
一、根据物质的组成和性质分类
...
酸性氧化物
碱性氧化物
其他分类方法
2.交叉分类法
CaCO3
一、根据物质的组成和性质分类
根据组成
从不同的角度对物质进行分类。
碳酸盐
钙盐
根据性质
难溶性盐
钠盐
钾盐
硫酸盐
碳酸盐
Na2CO3
Na2SO4
K2CO3
K2SO4
金属氧化物
非金属氧化物
酸性氧化物
碱性氧化物
CuO
MgO
CO2
SO3
我?
组成
性质
酸
从是否含氧分
从酸性强弱分
无氧酸
中强酸
弱酸
一元酸
H2SO4、HNO3、H3PO4、H2CO3
HCl、H2S
H2SO4、HNO3、HCl
H3PO4
H2CO3 CH3COOH
含氧酸
据电离出氢离子数
强酸
多元酸
二元酸
HCl、HNO3
H2SO4、H2SO3、H2CO3
H3PO4
酸:电离出来的阳离子全部是 H+ 的化合物
2.交叉分类法
一、根据物质的组成和性质分类
NaOH、KOH、Ba(OH)2、NH3·H2O
NaOH、KOH、Ca(OH) 2、Ba(OH)2
Cu(OH)2、Mg(OH)2、Fe(OH) 3
NH3·H2O 、Cu(OH)2、Mg(OH)2、Fe(OH) 3
碱
是否溶于水
碱性强弱
难溶碱
弱碱
可溶碱
强碱
一元碱
据电离出氢氧根离子数
多元碱
二元碱
NH3·H2O 、 NaOH、KOH
Cu(OH)2、Mg(OH)2、Fe(OH) 2 、Ca(OH) 2、Ba(OH)2
Al(OH)3、Fe(OH) 3
碱:电离出来的阴离子都是 OH— 的化合物
2.交叉分类法
一、根据物质的组成和性质分类
盐
否溶于水
阴阳离子
无氧酸盐
钠盐
钾盐
铵盐
硫酸盐
碳酸盐
硝酸盐
酸根是否含氧
含氧酸盐
可溶盐
难溶盐
KNO3、Na2CO3、NH4Cl
CaCO3、BaSO4、AgCl
KNO3、KMnO4、FeSO4
NaCl、ZnS、CaCl2
……
NaHCO3、NH4HCO3、NaHSO4
KNO3、KMnO4、FeSO4 、NaCl、ZnS、CaCl2
盐:由金属阳离子或者铵根离子(NH4+)与酸根阴离子组成的化合物。
正盐
组成
碱式盐
酸式盐
Cu2(OH)2CO3
复盐
KAl(SO4)2
2.交叉分类法
一、根据物质的组成和性质分类
(K+ Na+ NH4+ NO3— )
二、根据物质的构成、结构等分类
分类
分类是根据研究对象的共同点和差异点,将它们区分为不同种类和层次的科学方法。科学的分类能够反映事物的本质特征,有利于人们分门别类地进行深入研究。
分类有一定的标准,根据不同的标准,人们对研究对象进行不同的分类。在高中化学的学习中,对物质及其变化的分类标准将从物质的组成和性质等宏观视角,拓展到物质的构成、结构和参加化学反应的粒子等微观视角。
运用分类的方法,可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。
同素异形体:由同一种元素形成的不同单质。
是否还有其他同素异形体?
H2O C NaCl
C60 金刚石 石墨
红磷和白磷、S2和S8等
课堂总结
一、分类的依据(组成、性质、构成、结构等)
二、分类的结果(树状分类法、交叉分类法)
三、分类的意义
2.交叉分类法
1.树状分类法
新工具:“价-类”二维图
CaCO3
根据组成
碳酸盐
钙盐
根据性质
难溶性盐
碳元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-4
0
+2
+4
C
CO2
CO
CaCO3、Na2CO3、NaHCO3
CH4
H2CO3
新概念:酸性氧化物、碱性氧化物、同素异形体
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
...
酸性氧化物
碱性氧化物
有序的物质世界
——物质的分类
第一章 物质及其变化
第一节 物质的分类及转化(1)
深圳雅昌艺术中心“Artron Wall”
全球最大艺术图书书墙
交流研讨
你在图书馆是如何找书的?
书籍分类的意义是什么?
其他分类的例子?
交流研讨
人们总在追求有序!
交流研讨
如何对物质进行分类呢?
按照物质类别将下列物质分类:Fe、C、CO2、CaCO3、Na2CO3、O2、CaO、Ca(OH)2、HCl、NaCl、BaCl2、H2SO4、Na2SO4、CuSO4·5H2O、Cu(OH)2、NaOH、AgNO3。
你有哪些分类方法?
分类的依据是什么?
一、根据物质的组成和性质分类
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
Fe、C、CO2、CaCO3、Na2CO3、O2、CaO、Ca(OH)2、HCl、NaCl、BaCl2、H2SO4、Na2SO4、CuSO4·5H2O、Cu(OH)2、NaOH。
1.树状分类法
Fe
C
CO2
CaCO3
Na2CO3
O2
CaO
Ca(OH)2
HCl
NaCl
H2SO4
Na2SO4
CuSO4·5H2O
Cu(OH)2
NaOH
BaCl2
如何进行分类?
能否在空白处补上物质示例?
这样分类有什么价值?
Ne
He
CH4
物质认识的独特视角
空气
溶液
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
Fe
C
CO2
CaCO3
Na2CO3
O2
CaO
Ca(OH)2
HCl
NaCl
H2SO4
Na2SO4
Cu(OH)2
NaOH
Ne
He
从以上物质中找出含有相同元素的物质。
观察含同一种元素的不同物质,你有什么发现?
同一种元素可以存在于多种类别的物质中;
同一种元素组成物质时可以呈现不同的价态。
CH4
1.树状分类法
一、根据物质的组成和性质分类
CuSO4·5H2O
BaCl2
溶液
空气
以碳元素构建价类二维图:
请将C、CO2、CaCO3、Na2CO3、CH4放在相应位置。
“价-类”二维图
碳元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-4
0
+2
+4
一、根据物质的组成和性质分类
A
B
C
D
E
F
以碳元素构建价类二维图:
请将C、CO2、CaCO3、Na2CO3、CH4放在相应位置。
补充其他的含碳物质。
“价-类”二维图
碳元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-4
0
+2
+4
一、根据物质的组成和性质分类
C
CO2
CO
CaCO3
CH4
H2CO3
Na2CO3
NaHCO3
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
Fe
C
CO2
CaCO3
Na2CO3
O2
CaO
Ca(OH)2
HCl
NaCl
H2SO4
Na2SO4
Cu(OH)2
NaOH
AgNO3
Ne
He
树状分类法只是根据组成分类吗?
各类物质分别具有哪些相似的性质?
CH4
1.树状分类法
一、根据物质的组成和性质分类
CuSO4·5H2O
CO2
氧化物
...
酸性氧化物能与碱反应生成盐和水
碱性氧化物能与酸反应生成盐和水
能否举出其他的酸性氧化物示例?
能否举出其他的碱性氧化物示例?
酸性氧化物和碱性氧化物还有什么共性?
CO属于哪类?
酸性氧化物
碱性氧化物
1.树状分类法
一、根据物质的组成和性质分类
多数酸性氧化物能与水化合生成酸;
部分碱性氧化物能与水化合生成碱。
SO2、SO3、SiO2等
CaO
MgO、CuO、FeO、Fe2O3、HgO、Ag2O、K2O、Na2O等
不成盐氧化物
CO、NO、NO2
两性氧化物
Al2O3
(多数非金属氧化物)
(多数金属氧化物)
CO2
CaO
非金属氧化物不一定是酸性氧化物:CO、NO、NO2(不成盐氧化物)
金属氧化物不一定是碱性氧化物:Al2O3(两性氧化物)、Mn2O7(酸性氧化物)、Fe3O4(不成盐氧化物)
一般中总有特殊!
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
1.树状分类法
一、根据物质的组成和性质分类
...
酸性氧化物
碱性氧化物
其他分类方法
2.交叉分类法
CaCO3
一、根据物质的组成和性质分类
根据组成
从不同的角度对物质进行分类。
碳酸盐
钙盐
根据性质
难溶性盐
钠盐
钾盐
硫酸盐
碳酸盐
Na2CO3
Na2SO4
K2CO3
K2SO4
金属氧化物
非金属氧化物
酸性氧化物
碱性氧化物
CuO
MgO
CO2
SO3
我?
组成
性质
酸
从是否含氧分
从酸性强弱分
无氧酸
中强酸
弱酸
一元酸
H2SO4、HNO3、H3PO4、H2CO3
HCl、H2S
H2SO4、HNO3、HCl
H3PO4
H2CO3 CH3COOH
含氧酸
据电离出氢离子数
强酸
多元酸
二元酸
HCl、HNO3
H2SO4、H2SO3、H2CO3
H3PO4
酸:电离出来的阳离子全部是 H+ 的化合物
2.交叉分类法
一、根据物质的组成和性质分类
NaOH、KOH、Ba(OH)2、NH3·H2O
NaOH、KOH、Ca(OH) 2、Ba(OH)2
Cu(OH)2、Mg(OH)2、Fe(OH) 3
NH3·H2O 、Cu(OH)2、Mg(OH)2、Fe(OH) 3
碱
是否溶于水
碱性强弱
难溶碱
弱碱
可溶碱
强碱
一元碱
据电离出氢氧根离子数
多元碱
二元碱
NH3·H2O 、 NaOH、KOH
Cu(OH)2、Mg(OH)2、Fe(OH) 2 、Ca(OH) 2、Ba(OH)2
Al(OH)3、Fe(OH) 3
碱:电离出来的阴离子都是 OH— 的化合物
2.交叉分类法
一、根据物质的组成和性质分类
盐
否溶于水
阴阳离子
无氧酸盐
钠盐
钾盐
铵盐
硫酸盐
碳酸盐
硝酸盐
酸根是否含氧
含氧酸盐
可溶盐
难溶盐
KNO3、Na2CO3、NH4Cl
CaCO3、BaSO4、AgCl
KNO3、KMnO4、FeSO4
NaCl、ZnS、CaCl2
……
NaHCO3、NH4HCO3、NaHSO4
KNO3、KMnO4、FeSO4 、NaCl、ZnS、CaCl2
盐:由金属阳离子或者铵根离子(NH4+)与酸根阴离子组成的化合物。
正盐
组成
碱式盐
酸式盐
Cu2(OH)2CO3
复盐
KAl(SO4)2
2.交叉分类法
一、根据物质的组成和性质分类
(K+ Na+ NH4+ NO3— )
二、根据物质的构成、结构等分类
分类
分类是根据研究对象的共同点和差异点,将它们区分为不同种类和层次的科学方法。科学的分类能够反映事物的本质特征,有利于人们分门别类地进行深入研究。
分类有一定的标准,根据不同的标准,人们对研究对象进行不同的分类。在高中化学的学习中,对物质及其变化的分类标准将从物质的组成和性质等宏观视角,拓展到物质的构成、结构和参加化学反应的粒子等微观视角。
运用分类的方法,可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。
同素异形体:由同一种元素形成的不同单质。
是否还有其他同素异形体?
H2O C NaCl
C60 金刚石 石墨
红磷和白磷、S2和S8等
课堂总结
一、分类的依据(组成、性质、构成、结构等)
二、分类的结果(树状分类法、交叉分类法)
三、分类的意义
2.交叉分类法
1.树状分类法
新工具:“价-类”二维图
CaCO3
根据组成
碳酸盐
钙盐
根据性质
难溶性盐
碳元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-4
0
+2
+4
C
CO2
CO
CaCO3、Na2CO3、NaHCO3
CH4
H2CO3
新概念:酸性氧化物、碱性氧化物、同素异形体
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
...
酸性氧化物
碱性氧化物
