高中化学人教版(2019)必修一 1.1物质的分类及转化(3)(课件共13页)
文档属性
| 名称 | 高中化学人教版(2019)必修一 1.1物质的分类及转化(3)(课件共13页) |  | |
| 格式 | zip | ||
| 文件大小 | 31.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-11 14:37:41 | ||
图片预览

文档简介
(共13张PPT)
畅想物质世界
——物质的转化
第一章 物质及其变化
第一节 物质的分类及转化(3)
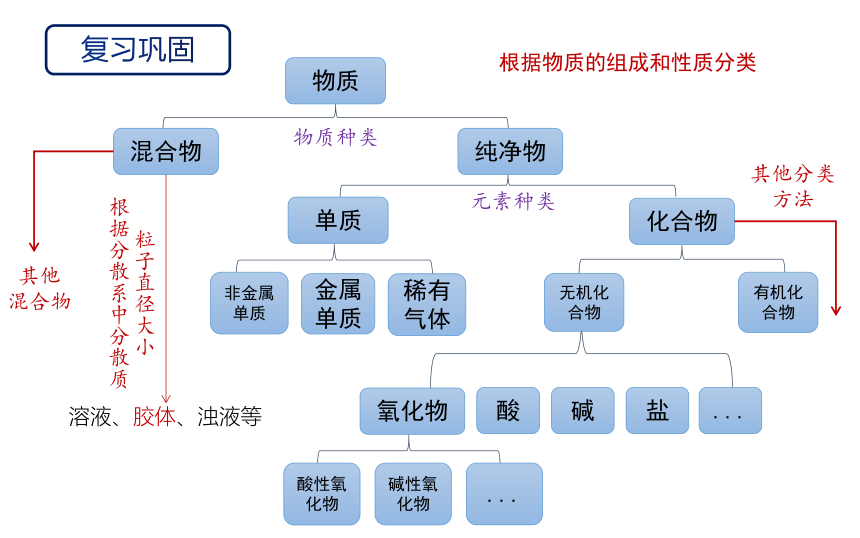
复习巩固
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
...
酸性氧化物
碱性氧化物
根据分散系中分散质粒子直径大小
溶液、胶体、浊液等
根据物质的组成和性质分类
其他分类方法
其他
混合物
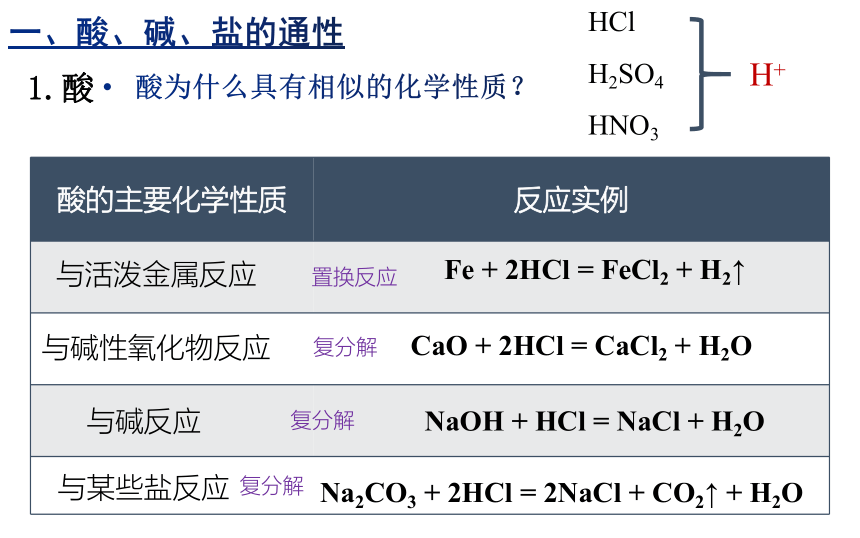
一、酸、碱、盐的通性
1.酸
酸的主要化学性质 反应实例
NaOH + HCl = NaCl + H2O
Fe + 2HCl = FeCl2 + H2↑
CaO + 2HCl = CaCl2 + H2O
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
与活泼金属反应
与碱性氧化物反应
与碱反应
与某些盐反应
酸为什么具有相似的化学性质?
HCl
H2SO4
HNO3
H+
置换反应
复分解
复分解
复分解
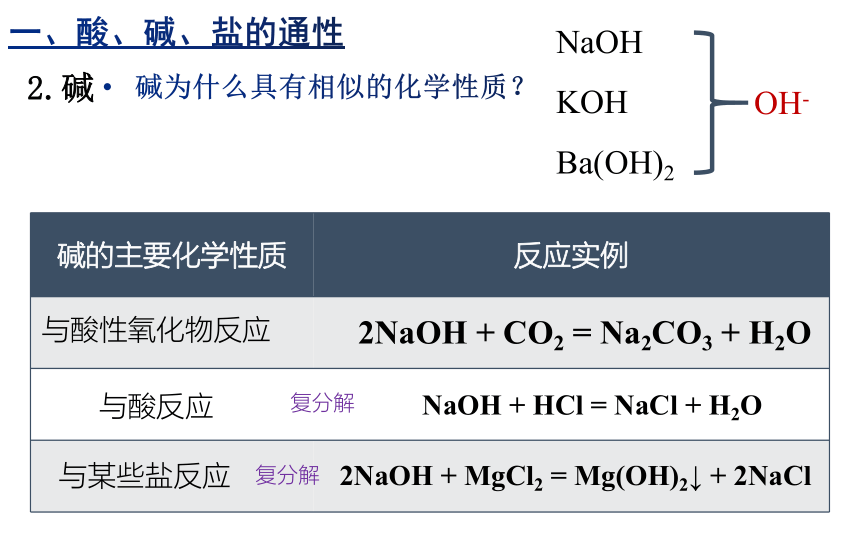
碱的主要化学性质 反应实例
与酸性氧化物反应
与酸反应
与某些盐反应
NaOH + HCl = NaCl + H2O
2NaOH + CO2 = Na2CO3 + H2O
2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl
2.碱
碱为什么具有相似的化学性质?
NaOH
KOH
Ba(OH)2
OH-
一、酸、碱、盐的通性
复分解
复分解
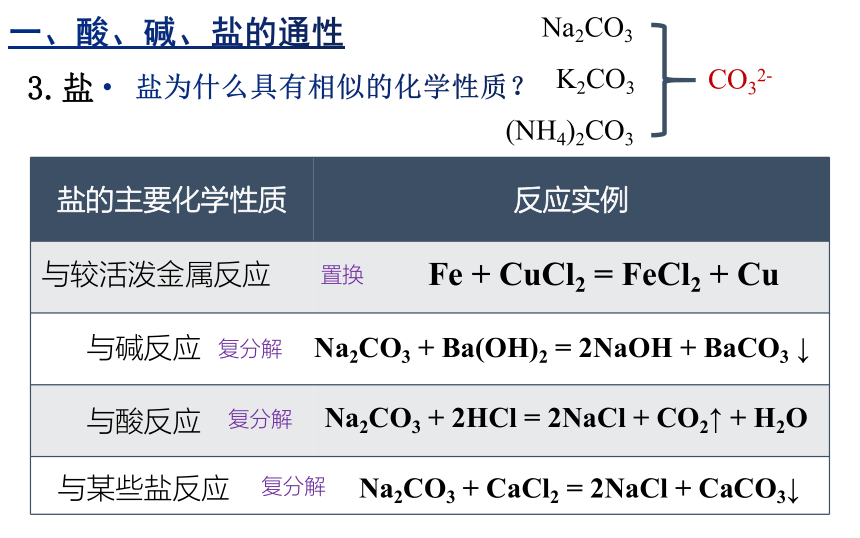
盐的主要化学性质 反应实例
与较活泼金属反应
与碱反应
与酸反应
与某些盐反应
Fe + CuCl2 = FeCl2 + Cu
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
Na2CO3 + Ba(OH)2 = 2NaOH + BaCO3 ↓
Na2CO3 + CaCl2 = 2NaCl + CaCO3↓
Na2CO3
K2CO3
(NH4)2CO3
CO32-
3.盐
盐为什么具有相似的化学性质?
一、酸、碱、盐的通性
复分解
复分解
复分解
置换
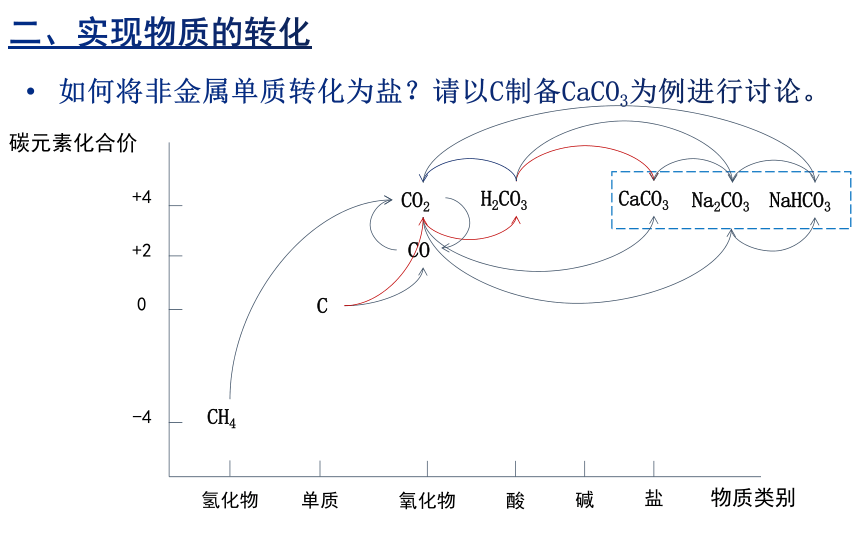
碳元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-4
0
+2
+4
C
CO2
CO
CaCO3
CH4
H2CO3
Na2CO3
NaHCO3
如何将非金属单质转化为盐?请以C制备CaCO3为例进行讨论。
二、实现物质的转化
C+O2 CO2
任务1:如何将非金属单质转化为盐?
请以C制备CaCO3为例进行讨论。
C
→
CO2
→
H2CO3
→
CaCO3
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
CO2+H2O=H2CO3
Ca(OH)2+H2CO3=CaCO3↓+2H2O
点燃
二、实现物质的转化
钙元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-2
0
+2
+4
Ca
CaO
Ca(OH)2
CaH2
CaSO4
如何将金属单质转化为盐?请以Ca制备CaSO4为例进行讨论。
二、实现物质的转化
CaCO3
二、实现物质的转化
任务2:如何将金属单质转化为盐?
请以Ca制备CaSO4为例进行讨论。
Ca
→
CaO
→
Ca(OH)2
→
CaSO4
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+H2SO4=CaSO4+H2O
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
任务3:如何制备氢氧化钠?
(1)Na2O+H2O=2NaOH
(2)Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
工业生产中除了要考虑反应进行的可能性,还要考虑原料来源、成本高低和设备要求等。
电解饱和食盐水
二、实现物质的转化
二、实现物质的转化
任务4:如何制备盐?
课堂总结
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
一、酸、碱、盐的通性
二、实现物质的转化
实际工业生产综合考虑
原料来源、成本高低、设备要求等
畅想物质世界
——物质的转化
第一章 物质及其变化
第一节 物质的分类及转化(3)
复习巩固
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
...
酸性氧化物
碱性氧化物
根据分散系中分散质粒子直径大小
溶液、胶体、浊液等
根据物质的组成和性质分类
其他分类方法
其他
混合物
一、酸、碱、盐的通性
1.酸
酸的主要化学性质 反应实例
NaOH + HCl = NaCl + H2O
Fe + 2HCl = FeCl2 + H2↑
CaO + 2HCl = CaCl2 + H2O
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
与活泼金属反应
与碱性氧化物反应
与碱反应
与某些盐反应
酸为什么具有相似的化学性质?
HCl
H2SO4
HNO3
H+
置换反应
复分解
复分解
复分解
碱的主要化学性质 反应实例
与酸性氧化物反应
与酸反应
与某些盐反应
NaOH + HCl = NaCl + H2O
2NaOH + CO2 = Na2CO3 + H2O
2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl
2.碱
碱为什么具有相似的化学性质?
NaOH
KOH
Ba(OH)2
OH-
一、酸、碱、盐的通性
复分解
复分解
盐的主要化学性质 反应实例
与较活泼金属反应
与碱反应
与酸反应
与某些盐反应
Fe + CuCl2 = FeCl2 + Cu
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
Na2CO3 + Ba(OH)2 = 2NaOH + BaCO3 ↓
Na2CO3 + CaCl2 = 2NaCl + CaCO3↓
Na2CO3
K2CO3
(NH4)2CO3
CO32-
3.盐
盐为什么具有相似的化学性质?
一、酸、碱、盐的通性
复分解
复分解
复分解
置换
碳元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-4
0
+2
+4
C
CO2
CO
CaCO3
CH4
H2CO3
Na2CO3
NaHCO3
如何将非金属单质转化为盐?请以C制备CaCO3为例进行讨论。
二、实现物质的转化
C+O2 CO2
任务1:如何将非金属单质转化为盐?
请以C制备CaCO3为例进行讨论。
C
→
CO2
→
H2CO3
→
CaCO3
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
CO2+H2O=H2CO3
Ca(OH)2+H2CO3=CaCO3↓+2H2O
点燃
二、实现物质的转化
钙元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-2
0
+2
+4
Ca
CaO
Ca(OH)2
CaH2
CaSO4
如何将金属单质转化为盐?请以Ca制备CaSO4为例进行讨论。
二、实现物质的转化
CaCO3
二、实现物质的转化
任务2:如何将金属单质转化为盐?
请以Ca制备CaSO4为例进行讨论。
Ca
→
CaO
→
Ca(OH)2
→
CaSO4
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+H2SO4=CaSO4+H2O
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
任务3:如何制备氢氧化钠?
(1)Na2O+H2O=2NaOH
(2)Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
工业生产中除了要考虑反应进行的可能性,还要考虑原料来源、成本高低和设备要求等。
电解饱和食盐水
二、实现物质的转化
二、实现物质的转化
任务4:如何制备盐?
课堂总结
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
一、酸、碱、盐的通性
二、实现物质的转化
实际工业生产综合考虑
原料来源、成本高低、设备要求等
