高中化学人教版(2019)必修一 2.1钠及其化合物(2)(课件共19页)
文档属性
| 名称 | 高中化学人教版(2019)必修一 2.1钠及其化合物(2)(课件共19页) |  | |
| 格式 | zip | ||
| 文件大小 | 34.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-11 15:44:34 | ||
图片预览



文档简介
(共19张PPT)
变化多姿的元素
——钠的几种化合物
第二章 海水中的重要元素——钠和氯
第1节 钠及其化合物(2)
交流讨论
如果要为潜水艇选择一种制氧剂,你会选择哪一种?
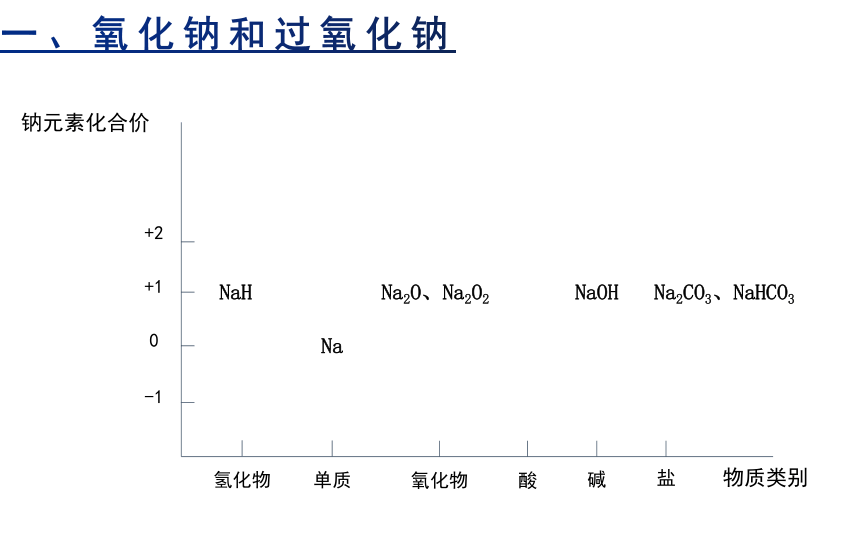
钠元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-1
0
+1
+2
Na
Na2O、Na2O2
NaOH
NaH
Na2CO3、NaHCO3
一、氧化钠和过氧化钠
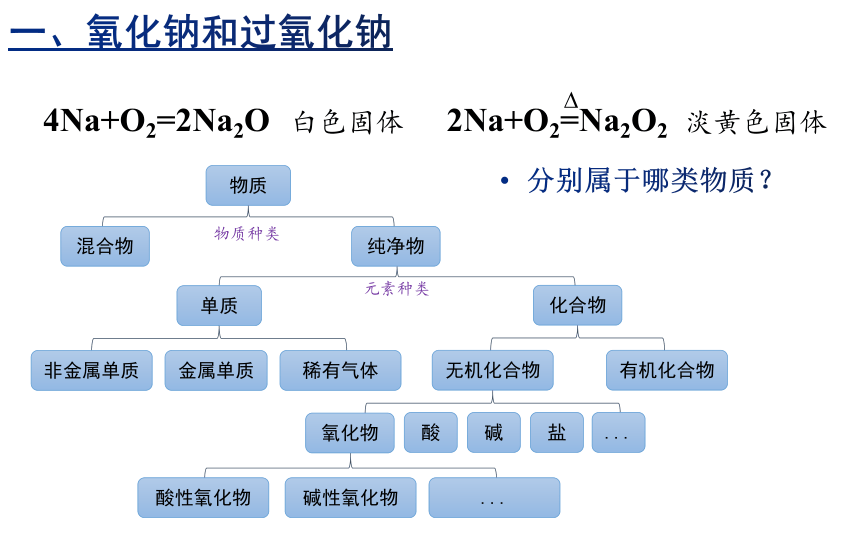
4Na+O2=2Na2O
2Na+O2=Na2O2
白色固体
淡黄色固体
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
...
酸性氧化物
碱性氧化物
分别属于哪类物质?
一、氧化钠和过氧化钠
一、氧化钠和过氧化钠
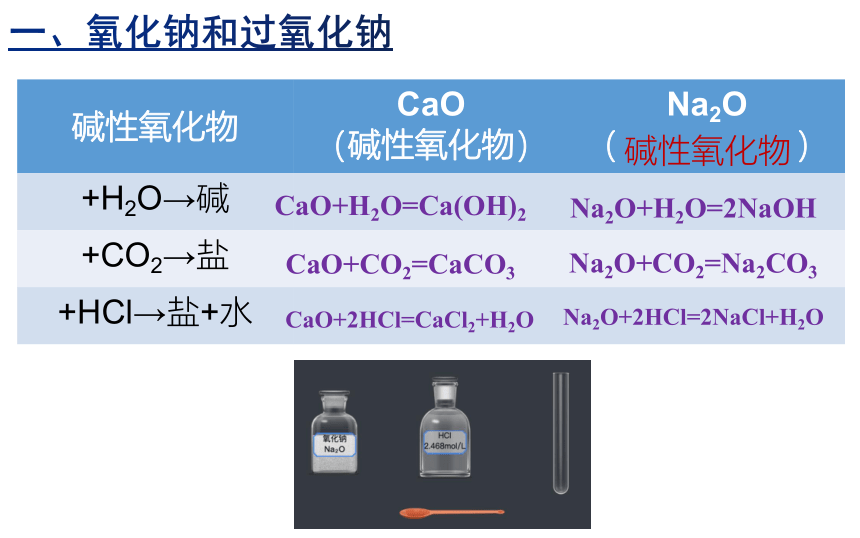
碱性氧化物 CaO (碱性氧化物) Na2O
( )
+H2O→碱
+CO2→盐
+HCl→盐+水
CaO+H2O=Ca(OH)2
CaO+CO2=CaCO3
CaO+2HCl=CaCl2+H2O
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
碱性氧化物
一、氧化钠和过氧化钠
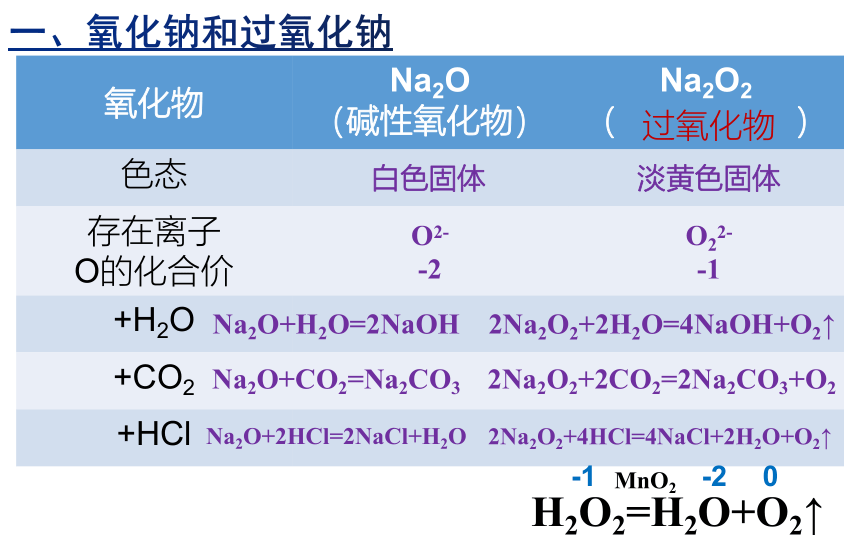
氧化物 Na2O (碱性氧化物) Na2O2
( )
色态
存在离子 O的化合价
+H2O
+CO2
+HCl
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
H2O2=H2O+O2↑
MnO2
-1
-2
0
白色固体
淡黄色固体
O2-
-2
O22-
-1
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+4HCl=4NaCl+2H2O+O2↑
过氧化物
一、氧化钠和过氧化钠
2Na2CO3·3H2O2 =2Na2CO3 +3H2O2
H2O2=H2O+O2↑
MnO2
过碳酸钠
一、氧化钠和过氧化钠
氧化物 Na2O (碱性氧化物) Na2O2
( )
色态
存在离子 O的化合价
+H2O
+CO2
+HCl
特性
用途
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
白色固体
淡黄色固体
O2-
-2
O22-
-1
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+4HCl=4NaCl+2H2O+O2↑
过氧化物
强氧化性
供氧剂、漂白剂、氧化剂
钠元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-1
0
+1
+2
Na
Na2O、Na2O2
NaOH
NaH
Na2CO3、NaHCO3
二、碳酸钠和碳酸氢钠
二、碳酸钠和碳酸氢钠
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
碱性
溶解性
热稳定性
与酸
与碱
相互转化
白色粉末
细小白色晶体
碳酸盐
二、碳酸钠和碳酸氢钠
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
溶解性
碱性
热稳定性
与酸
与碱
相互转化
白色粉末
碳酸盐
如何比较?
如何比较?
如何比较?
细小白色晶体
二、碳酸钠和碳酸氢钠
盐 Na2CO3 NaHCO3
(1) 白色粉末 白色粉末
(2) 加几滴水后,结块变成晶体;温度上升 加几滴水后,少部分溶解;温度略有下降
(3) 振荡后可溶解 固体量有所减少
(4) 溶液变红(较深) 溶液微红
初步结论 加水先变成含结晶水的晶体,溶于水放热,溶液碱性比NaHCO的强 加水少量溶解,溶于水吸热,溶液碱性比NaCO的弱
【实验2-4】实验记录
二、碳酸钠和碳酸氢钠
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
溶解性
碱性
热稳定性
与酸
与碱
相互转化
白色粉末
白色粉末
碳酸盐
大
小
强
弱
好
差
2NaHCO3 =Na2CO3 +CO2↑+H2O
如何比较?
二、碳酸钠和碳酸氢钠
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
溶解性
碱性
热稳定性
与酸
与碱
相互转化
白色粉末
白色粉末
碳酸盐
大
小
强
弱
好
差
2NaHCO3 =Na2CO3 +CO2↑+H2O
2H++CO32- =CO2↑+H2O
H++HCO3- =CO2↑+H2O
二、碳酸钠和碳酸氢钠
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
溶解性
碱性
热稳定性
与酸
与碱
相互转化
白色粉末
白色粉末
碳酸盐
大
小
强
弱
好
差
2NaHCO3 =Na2CO3 +CO2↑+H2O
2H++CO32- =CO2↑+H2O
H++HCO3- =CO2↑+H2O
——
OH-+HCO3- =CO32-+H2O
Na2CO3
NaHCO3
CO2+H2O
溶液加NaOH或固态加热
二、碳酸钠和碳酸氢钠
研究物质性质的基本程序
观察物质的外部特征
预测物质的性质
实验和观察
解释和结论
验证预测
作出新的预测
发现特殊现象,提出新问题
进一步研究
物质的颜色、气味、存在状态等
可以运用分类的方法,根据物质所属的类别或利用有关反应规律预测物质的性质
对实验现象进行分析、综合、推理,得出结论
运用比较的方法,归纳总结一类物质的共性和差异
课堂总结
课堂总结
氧化物 Na2O (碱性氧化物) Na2O2
( )
色态
存在离子 O的化合价
+H2O
+CO2
+HCl
特性
用途
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
白色固体
淡黄色固体
O2-
-2
O22-
-1
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+4HCl=4NaCl+2H2O+O2↑
过氧化物
强氧化性
供氧剂、漂白剂、氧化剂
课堂总结
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
溶解性
碱性
热稳定性
与酸
与碱
相互转化
白色粉末
白色粉末
碳酸盐
大
小
强
弱
好
差
2NaHCO3 =Na2CO3 +CO2↑+H2O
2H++CO32- =CO2↑+H2O
H++HCO3- =CO2↑+H2O
——
OH-+HCO3- =CO32-+H2O
Na2CO3
NaHCO3
CO2+H2O
溶液加NaOH或固态加热
变化多姿的元素
——钠的几种化合物
第二章 海水中的重要元素——钠和氯
第1节 钠及其化合物(2)
交流讨论
如果要为潜水艇选择一种制氧剂,你会选择哪一种?
钠元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-1
0
+1
+2
Na
Na2O、Na2O2
NaOH
NaH
Na2CO3、NaHCO3
一、氧化钠和过氧化钠
4Na+O2=2Na2O
2Na+O2=Na2O2
白色固体
淡黄色固体
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
...
物质种类
元素种类
...
酸性氧化物
碱性氧化物
分别属于哪类物质?
一、氧化钠和过氧化钠
一、氧化钠和过氧化钠
碱性氧化物 CaO (碱性氧化物) Na2O
( )
+H2O→碱
+CO2→盐
+HCl→盐+水
CaO+H2O=Ca(OH)2
CaO+CO2=CaCO3
CaO+2HCl=CaCl2+H2O
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
碱性氧化物
一、氧化钠和过氧化钠
氧化物 Na2O (碱性氧化物) Na2O2
( )
色态
存在离子 O的化合价
+H2O
+CO2
+HCl
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
H2O2=H2O+O2↑
MnO2
-1
-2
0
白色固体
淡黄色固体
O2-
-2
O22-
-1
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+4HCl=4NaCl+2H2O+O2↑
过氧化物
一、氧化钠和过氧化钠
2Na2CO3·3H2O2 =2Na2CO3 +3H2O2
H2O2=H2O+O2↑
MnO2
过碳酸钠
一、氧化钠和过氧化钠
氧化物 Na2O (碱性氧化物) Na2O2
( )
色态
存在离子 O的化合价
+H2O
+CO2
+HCl
特性
用途
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
白色固体
淡黄色固体
O2-
-2
O22-
-1
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+4HCl=4NaCl+2H2O+O2↑
过氧化物
强氧化性
供氧剂、漂白剂、氧化剂
钠元素化合价
物质类别
氢化物
单质
氧化物
酸
碱
盐
-1
0
+1
+2
Na
Na2O、Na2O2
NaOH
NaH
Na2CO3、NaHCO3
二、碳酸钠和碳酸氢钠
二、碳酸钠和碳酸氢钠
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
碱性
溶解性
热稳定性
与酸
与碱
相互转化
白色粉末
细小白色晶体
碳酸盐
二、碳酸钠和碳酸氢钠
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
溶解性
碱性
热稳定性
与酸
与碱
相互转化
白色粉末
碳酸盐
如何比较?
如何比较?
如何比较?
细小白色晶体
二、碳酸钠和碳酸氢钠
盐 Na2CO3 NaHCO3
(1) 白色粉末 白色粉末
(2) 加几滴水后,结块变成晶体;温度上升 加几滴水后,少部分溶解;温度略有下降
(3) 振荡后可溶解 固体量有所减少
(4) 溶液变红(较深) 溶液微红
初步结论 加水先变成含结晶水的晶体,溶于水放热,溶液碱性比NaHCO的强 加水少量溶解,溶于水吸热,溶液碱性比NaCO的弱
【实验2-4】实验记录
二、碳酸钠和碳酸氢钠
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
溶解性
碱性
热稳定性
与酸
与碱
相互转化
白色粉末
白色粉末
碳酸盐
大
小
强
弱
好
差
2NaHCO3 =Na2CO3 +CO2↑+H2O
如何比较?
二、碳酸钠和碳酸氢钠
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
溶解性
碱性
热稳定性
与酸
与碱
相互转化
白色粉末
白色粉末
碳酸盐
大
小
强
弱
好
差
2NaHCO3 =Na2CO3 +CO2↑+H2O
2H++CO32- =CO2↑+H2O
H++HCO3- =CO2↑+H2O
二、碳酸钠和碳酸氢钠
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
溶解性
碱性
热稳定性
与酸
与碱
相互转化
白色粉末
白色粉末
碳酸盐
大
小
强
弱
好
差
2NaHCO3 =Na2CO3 +CO2↑+H2O
2H++CO32- =CO2↑+H2O
H++HCO3- =CO2↑+H2O
——
OH-+HCO3- =CO32-+H2O
Na2CO3
NaHCO3
CO2+H2O
溶液加NaOH或固态加热
二、碳酸钠和碳酸氢钠
研究物质性质的基本程序
观察物质的外部特征
预测物质的性质
实验和观察
解释和结论
验证预测
作出新的预测
发现特殊现象,提出新问题
进一步研究
物质的颜色、气味、存在状态等
可以运用分类的方法,根据物质所属的类别或利用有关反应规律预测物质的性质
对实验现象进行分析、综合、推理,得出结论
运用比较的方法,归纳总结一类物质的共性和差异
课堂总结
课堂总结
氧化物 Na2O (碱性氧化物) Na2O2
( )
色态
存在离子 O的化合价
+H2O
+CO2
+HCl
特性
用途
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
白色固体
淡黄色固体
O2-
-2
O22-
-1
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+4HCl=4NaCl+2H2O+O2↑
过氧化物
强氧化性
供氧剂、漂白剂、氧化剂
课堂总结
类别: Na2CO3 (正盐) NaHCO3
(酸式盐)
色态
溶解性
碱性
热稳定性
与酸
与碱
相互转化
白色粉末
白色粉末
碳酸盐
大
小
强
弱
好
差
2NaHCO3 =Na2CO3 +CO2↑+H2O
2H++CO32- =CO2↑+H2O
H++HCO3- =CO2↑+H2O
——
OH-+HCO3- =CO32-+H2O
Na2CO3
NaHCO3
CO2+H2O
溶液加NaOH或固态加热
