化学人教版(2019)必修第一册2.1.2钠的几种化合物(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.2钠的几种化合物(共19张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 235.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-11 08:05:08 | ||
图片预览




文档简介
(共19张PPT)
第二章 海水中的重要元素
第一节 钠及其化合物
第2课时 钠的几种化合物
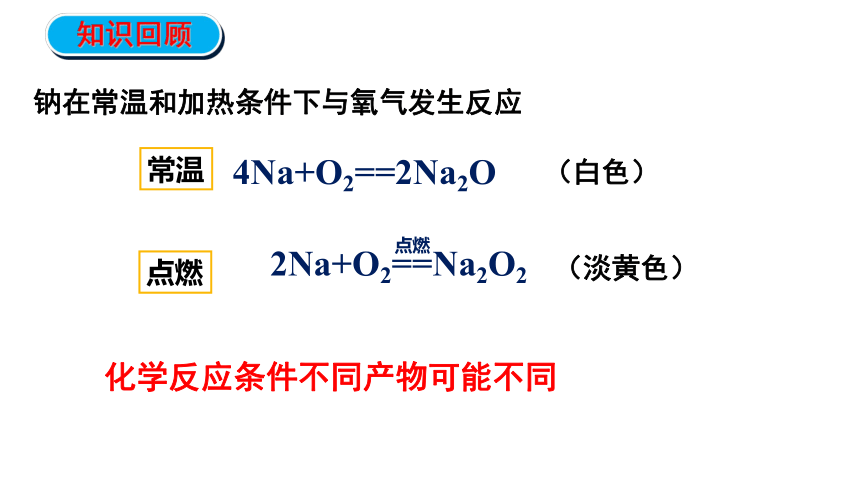
钠在常温和加热条件下与氧气发生反应
化学反应条件不同产物可能不同
知识回顾
常温
点燃
4Na+O2==2Na2O
2Na+O2==Na2O2
点燃
(白色)
(淡黄色)
氧化钠的化学性质
碱性氧化物
Na2O + H2O = 2NaOH
Na2O + 2HCl = 2NaCl + H2O
Na2O + CO2 = Na2CO3
实 验 现 象
1.滴入水后有大量气泡产生,生成的气体使带火星的木条复燃(说明有O2生成);
2.试管外壁发热;
3.pH试纸变蓝(说明有碱生成)。
思考:Na2O2是否与水、CO2发生了反应?如何证明(实验2-3)
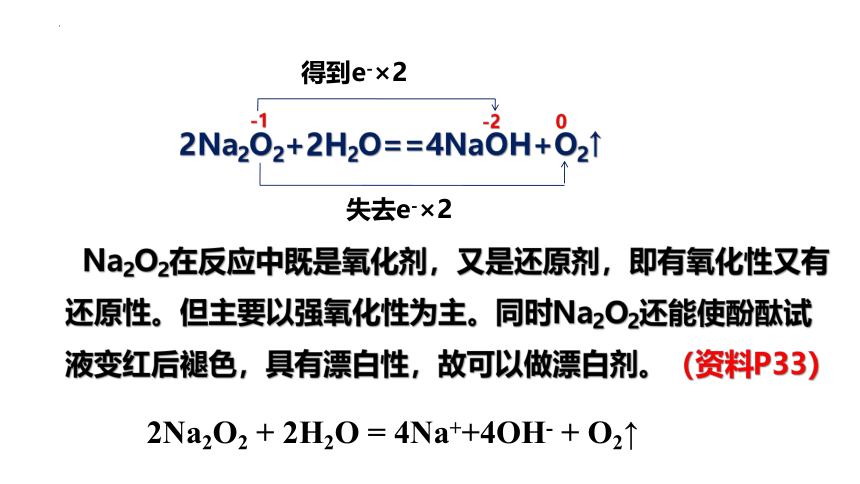
2Na2O2+2H2O==4NaOH+O2↑
-1
-2
0
得到e-×2
失去e-×2
Na2O2在反应中既是氧化剂,又是还原剂,即有氧化性又有还原性。但主要以强氧化性为主。同时Na2O2还能使酚酞试液变红后褪色,具有漂白性,故可以做漂白剂。(资料P33)
即既可以
2Na2O2 + 2H2O = 4Na++4OH- + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
对上面的反应进行双线桥分析,并指出氧化剂、还原剂
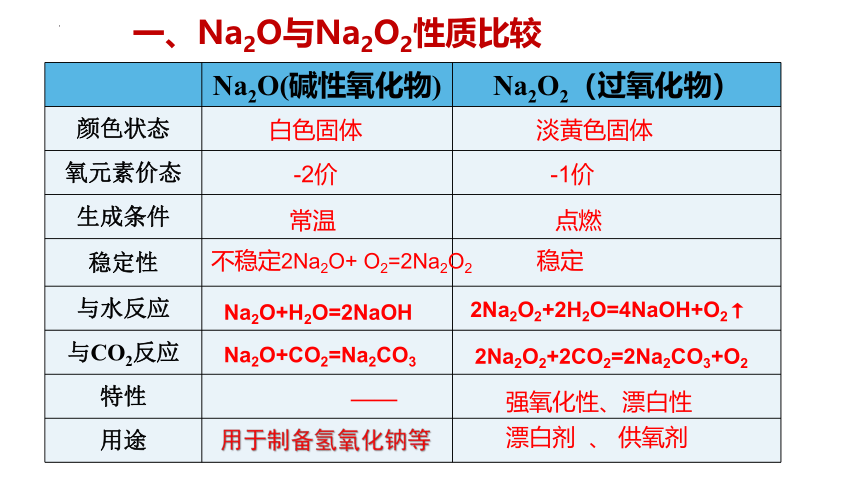
一、Na2O与Na2O2性质比较
Na2O(碱性氧化物) Na2O2(过氧化物)
颜色状态
氧元素价态
生成条件
稳定性
与水反应
与CO2反应
特性
用途
用于制备氢氧化钠等
白色固体 淡黄色固体
-2价 -1价
常温 点燃
不稳定2Na2O+ O2=2Na2O2 稳定
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
强氧化性、漂白性
漂白剂 、 供氧剂
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
——
在面粉发酵或油条制作时常常用到纯碱或小苏打,你知道纯碱、小苏打的成分是什么吗?
请思考:
碳酸钠(Na2CO3)俗名叫纯碱,也叫苏打;碳酸氢钠(NaHCO3)俗名叫小苏打。
二、碳酸钠和碳酸氢钠的性质
1.Na2CO3和NaHCO3外观、溶解性及水溶液的酸碱性(课本P36)
盐 Na2CO3 NaHCO3
( 1)观察外观 白色粉末 细小白色粉末
(2)分别滴入几滴水,振荡,观察现象;将温度计分别插入其中
(3)继续向(2)的试管中分别加入5 mL水,用力振荡
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液
初步结论
形成晶体,放热
部分溶解,吸热
溶解
部分溶解
变红
微红
溶解度 Na2CO3 ﹥ NaHCO3
碱性:Na2CO3 ﹥NaHCO3
2. Na2CO3和NaHCO3的热稳定性
2NaHCO3=Na2CO3+H2O+CO2↑
Na2CO3很稳定,受热不分解
NaHCO3不稳定,受热易分解
证明Na2CO3、NaHCO3热稳定性的套管实验装置(资料P33)
3. Na2CO3和NaHCO3与盐酸的反应
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CO32- + 2H+ = H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O +CO2↑
HCO3- +H+=H2O+CO2↑
(反应较快)
CO32-
H+
HCO3-
2H+(两步)
H+
(一步)
H2CO3
H2O+CO2
实验分析:
① NaHCO3与稀盐酸反应要比Na2CO3与稀盐酸反应快。因为:CO32- →CO2是两步反应,反应较慢,而HCO3- →CO2是一步反应,反应较快。
CO32-+H+=HCO3- ①
HCO3-+H+=H2O+CO2↑ ②
② Na2CO3与稀盐酸反应,因滴加顺序不同,现象不同:
b、将Na2CO3溶液逐滴滴入稀盐酸中,由于盐酸过量,开始就有大量气泡产生
a、将稀盐酸逐滴滴入Na2CO3溶液中,开始无明显现象:
CO3+H+ == HCO3-,
当滴加到一定程度,会有气泡产生,
HCO3 + H+ == CO2↑+H2O
-
实验分析:资料P35方法规律
4. Na2CO3和NaHCO3与碱的反应
Na2CO3 + Ca(OH)2=CaCO3 +2H2O
HCO3-+OH-=H2O +CO32-
CO32-+Ca2+=CaCO3
NaHCO3 + NaOH=Na2CO3+H2O
↓
↓
5.Na2CO3与盐(BaCl2)的反应:(资料P35鉴别)
Na2CO3 + BaCl2=BaCO3 ↓ +2NaCl
CO32- + Ba2+ = BaCO3
↓
6.Na2CO3与CO2和水的反应
回顾: CO2通入澄清石灰水的实验现象及有关反应方程式。
现象:澄清石灰水先变浑浊,后变澄清。
Ca(OH)2+CO2=H2O+CaCO3
CaCO3+CO2+H2O=Ca(HCO3)2
结论: Na2CO3+CO2+H2O=2NaHCO3
补充:2NaOH+CO2(少量)=H2O+Na2CO3 ①
Na2CO3+CO2+H2O=2NaHCO3 ②
① + ②: NaOH+CO2(过量)=NaHCO3
Na2CO3
NaHCO3
H2O、CO2
①△
②(aq).NaOH
1.Na2CO3与NaHCO3转化?
思考
2NaHCO3=Na2CO3+H2O+CO2↑
△
Na2CO3+ CO2+H2O = 2NaHCO3
NaHCO3 + NaOH=Na2CO3+H2O
资料P35
本节收获
一、Na2O与Na2O2的性质
二、碳酸钠和碳酸氢钠的性质
第二章 海水中的重要元素
第一节 钠及其化合物
第2课时 钠的几种化合物
钠在常温和加热条件下与氧气发生反应
化学反应条件不同产物可能不同
知识回顾
常温
点燃
4Na+O2==2Na2O
2Na+O2==Na2O2
点燃
(白色)
(淡黄色)
氧化钠的化学性质
碱性氧化物
Na2O + H2O = 2NaOH
Na2O + 2HCl = 2NaCl + H2O
Na2O + CO2 = Na2CO3
实 验 现 象
1.滴入水后有大量气泡产生,生成的气体使带火星的木条复燃(说明有O2生成);
2.试管外壁发热;
3.pH试纸变蓝(说明有碱生成)。
思考:Na2O2是否与水、CO2发生了反应?如何证明(实验2-3)
2Na2O2+2H2O==4NaOH+O2↑
-1
-2
0
得到e-×2
失去e-×2
Na2O2在反应中既是氧化剂,又是还原剂,即有氧化性又有还原性。但主要以强氧化性为主。同时Na2O2还能使酚酞试液变红后褪色,具有漂白性,故可以做漂白剂。(资料P33)
即既可以
2Na2O2 + 2H2O = 4Na++4OH- + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
对上面的反应进行双线桥分析,并指出氧化剂、还原剂
一、Na2O与Na2O2性质比较
Na2O(碱性氧化物) Na2O2(过氧化物)
颜色状态
氧元素价态
生成条件
稳定性
与水反应
与CO2反应
特性
用途
用于制备氢氧化钠等
白色固体 淡黄色固体
-2价 -1价
常温 点燃
不稳定2Na2O+ O2=2Na2O2 稳定
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
强氧化性、漂白性
漂白剂 、 供氧剂
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
——
在面粉发酵或油条制作时常常用到纯碱或小苏打,你知道纯碱、小苏打的成分是什么吗?
请思考:
碳酸钠(Na2CO3)俗名叫纯碱,也叫苏打;碳酸氢钠(NaHCO3)俗名叫小苏打。
二、碳酸钠和碳酸氢钠的性质
1.Na2CO3和NaHCO3外观、溶解性及水溶液的酸碱性(课本P36)
盐 Na2CO3 NaHCO3
( 1)观察外观 白色粉末 细小白色粉末
(2)分别滴入几滴水,振荡,观察现象;将温度计分别插入其中
(3)继续向(2)的试管中分别加入5 mL水,用力振荡
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液
初步结论
形成晶体,放热
部分溶解,吸热
溶解
部分溶解
变红
微红
溶解度 Na2CO3 ﹥ NaHCO3
碱性:Na2CO3 ﹥NaHCO3
2. Na2CO3和NaHCO3的热稳定性
2NaHCO3=Na2CO3+H2O+CO2↑
Na2CO3很稳定,受热不分解
NaHCO3不稳定,受热易分解
证明Na2CO3、NaHCO3热稳定性的套管实验装置(资料P33)
3. Na2CO3和NaHCO3与盐酸的反应
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CO32- + 2H+ = H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O +CO2↑
HCO3- +H+=H2O+CO2↑
(反应较快)
CO32-
H+
HCO3-
2H+(两步)
H+
(一步)
H2CO3
H2O+CO2
实验分析:
① NaHCO3与稀盐酸反应要比Na2CO3与稀盐酸反应快。因为:CO32- →CO2是两步反应,反应较慢,而HCO3- →CO2是一步反应,反应较快。
CO32-+H+=HCO3- ①
HCO3-+H+=H2O+CO2↑ ②
② Na2CO3与稀盐酸反应,因滴加顺序不同,现象不同:
b、将Na2CO3溶液逐滴滴入稀盐酸中,由于盐酸过量,开始就有大量气泡产生
a、将稀盐酸逐滴滴入Na2CO3溶液中,开始无明显现象:
CO3+H+ == HCO3-,
当滴加到一定程度,会有气泡产生,
HCO3 + H+ == CO2↑+H2O
-
实验分析:资料P35方法规律
4. Na2CO3和NaHCO3与碱的反应
Na2CO3 + Ca(OH)2=CaCO3 +2H2O
HCO3-+OH-=H2O +CO32-
CO32-+Ca2+=CaCO3
NaHCO3 + NaOH=Na2CO3+H2O
↓
↓
5.Na2CO3与盐(BaCl2)的反应:(资料P35鉴别)
Na2CO3 + BaCl2=BaCO3 ↓ +2NaCl
CO32- + Ba2+ = BaCO3
↓
6.Na2CO3与CO2和水的反应
回顾: CO2通入澄清石灰水的实验现象及有关反应方程式。
现象:澄清石灰水先变浑浊,后变澄清。
Ca(OH)2+CO2=H2O+CaCO3
CaCO3+CO2+H2O=Ca(HCO3)2
结论: Na2CO3+CO2+H2O=2NaHCO3
补充:2NaOH+CO2(少量)=H2O+Na2CO3 ①
Na2CO3+CO2+H2O=2NaHCO3 ②
① + ②: NaOH+CO2(过量)=NaHCO3
Na2CO3
NaHCO3
H2O、CO2
①△
②(aq).NaOH
1.Na2CO3与NaHCO3转化?
思考
2NaHCO3=Na2CO3+H2O+CO2↑
△
Na2CO3+ CO2+H2O = 2NaHCO3
NaHCO3 + NaOH=Na2CO3+H2O
资料P35
本节收获
一、Na2O与Na2O2的性质
二、碳酸钠和碳酸氢钠的性质
