人教版九年级化学 第六单元课题1 金刚石、石墨和C60 课时2 碳单质的化学性质 课件(共21张PPT)
文档属性
| 名称 | 人教版九年级化学 第六单元课题1 金刚石、石墨和C60 课时2 碳单质的化学性质 课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 387.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-11 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
第六单元 碳和碳的氧化物
课题1 金刚石、石墨和C60
课时2 碳单质的化学性质
目录
01
课程要求
03
知识点精讲
04
课堂检测
02
课前预习
掌握碳的化学性质:稳定性、可燃性、还原性;探究木炭还原氧化铜的实验,了解还原反应。
课程要求
画出碳原子的结构示意图,并说明碳单质在常温下化学性质稳定的原因。
课前预习
由于碳原子的最外层电子数为4,不易得失电子,所以碳单质在常温下化学性质稳定。
知识点精讲
知识点
碳单质的化学性质(单质碳的物理性质各异,而化学性质却____________)
1. 常温下碳的化学性质比较____________。(用墨写字、作画千年不褪色,档案用碳素墨水书写,烤焦埋入地下的木桩不易腐烂)
相似
稳定
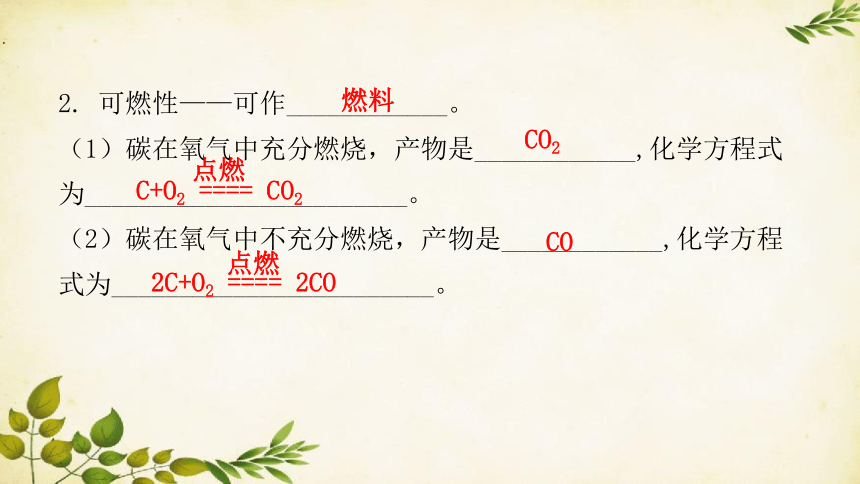
2. 可燃性——可作____________。
(1)碳在氧气中充分燃烧,产物是____________,化学方程式为________________________。
(2)碳在氧气中不充分燃烧,产物是____________,化学方程式为________________________。
燃料
CO2
C+O2 ==== CO2
点燃
CO
2C+O2 ==== 2CO
点燃
3. 还原性(即在____________条件下,碳跟某些____________的反应)——可用于____________。
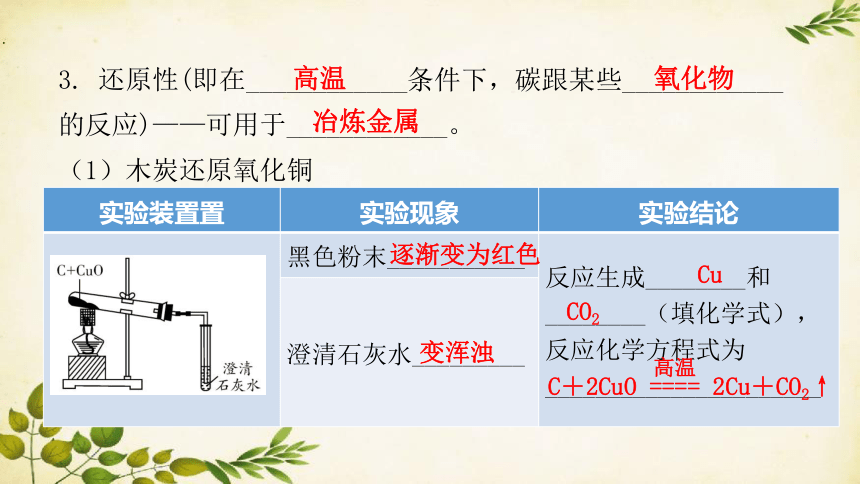
(1)木炭还原氧化铜
高温
氧化物
冶炼金属
实验装置置 实验现象 实验结论
黑色粉末___________ 反应生成________和________(填化学式),反应化学方程式为______________________
澄清石灰水_________
逐渐变为红色
变浑浊
Cu
CO2
C+2CuO ==== 2Cu+CO2↑
高温
【归纳】在碳还原氧化铜的反应里,氧化铜的氧被夺去变成铜,这种含氧化合物的氧被____________的反应,叫做____________反应。夺取氧的性质,叫做____________性,具有还原性的物质叫做还原剂。常见的还原剂有C、H2、CO。
夺去
还原
还原
【交流讨论】①加热时,酒精灯加网罩的目的是___________________________;
②反应结束后,先_________________,后_________________,目的是_________________________________________________;
③实验结束后,待试管冷却后再倒出试管内的粉末的原因是_______________________________。
集中火焰,提高温度
撤导气管
熄灭酒精灯
防止石灰水倒流进入试管中,使试管炸裂
防止灼热的Cu重新被氧化
(2)木炭还原氧化铁,化学方程式为_______________________________________________。
(3)炽热的碳还能把二氧化碳还原成一氧化碳,化学方程式为__________________________(此反应吸收热量)。
3C+2Fe2O3 ==== 4Fe+3CO2↑
高温
C+CO2 ==== 2CO
高温
课堂练习
1. 下列物质中,既具有可燃性,又具有还原性的固体单质是( )
A. 一氧化碳 B. 氢气
C. 碳 D. 氧化铜
C
2. (实验情境)如图6-1-2所示是木炭还原氧化铜的装置,以下说法正确的是( )
A. 实验结束,先熄灭酒精灯
B. 此实验说明木炭具有可燃性
C. 反应前后碳元素的化合价保持不变
D. 石灰水变浑浊说明有二氧化碳生成
D
思路点拨 ①碳的化学性质稳定性的前提条件是“常温下”;温度改变时碳的化学性质改变。②碳的可燃性要注意氧气的量,氧气充足时燃烧产物是CO2;氧气不足时则产生有毒的CO。③氧化反应和还原反应、氧化剂和还原剂这两个概念都是对反应物而言的,不是对生成物而言。
课堂检测
1. 以下反应不能体现碳做还原剂的是( )
A. CO2+C ==== 2CO
B. 2Mg+CO2 ==== C+2MgO
C. C+2CuO ==== 2Cu+CO2↑
D. 3C+2Fe2O3 ==== 4Fe+3CO2↑
高温
点燃
高温
高温
B
2. 下列鉴别木炭粉和氧化铜的方法不可行的是( )
A. 分别在氧气中燃烧 B. 分别通过氢气并加热
C. 观察它们的颜色 D. 分别放入品红溶液中
3. (社会热点)2020年12月12日,郑太高铁正式开通,高性能复合石墨滑板保证了高铁取电的安全稳定,该滑板没有用到的石墨性质是( )
A.润滑性 B.还原性
C.耐高温 D.导电性
C
B
4. 在密闭容器中6 g碳和12 g氧气充分反应后,容器内的气体有 ( )
A. 一氧化碳 B. 二氧化碳
C. 二氧化碳和氧气 D. 一氧化碳和二氧化碳
D
5. (实验情境)我国劳动人民在五千年前就会使用木炭炼铜。在化学实验室里模拟炼铜,既可用传统的实验装置(如图6-1-3甲),又可用改进的微型实验装置(如图6-1-3乙)。化学兴趣小组采用图乙装置,开展以下探究活动。
(1)写出木炭与氧化铜反应的化学
方程式:______________________,
其中发生还原反应的物质是____________。
C+2CuO==== 2Cu+CO2↑
高温
CuO
(2)判断木炭与氧化铜已经发生反应的依据是________________
__________________________________________。
(3)使用图乙装置与使用图甲装置相比,其优点是____________________________(写一条)。
(4)用甲装置进行实验,完毕后先停止加热,可能引起的后果是__________________________________________。
黑色固体中逐渐有红色固体产生,澄清石灰水变浑浊
操作简单(合理即可)
澄清石灰水倒流,引起试管炸裂
【实践活动·跨学科融合】
6. (文化自信)“扬州八怪”之一,清代著名画家郑板桥所绘的字画至今仍不褪色,这是因为墨汁中的碳( )
A. 具有可燃性 B. 具有还原性
C. 具有氧化性 D. 在常温下性质稳定
D
7. 白居易的《卖炭翁》写到“卖炭翁,伐薪烧炭南山中。满面尘灰烟火色,两鬓苍苍十指黑。卖炭得钱何所营?身上衣裳口中食。”那么诗中的“伐”属于____________变化,“炭”指木炭,写出木炭与氧化铜反应的化学方程式:_____________________,现象为________________________。反应前后碳元素的化合价变化为_______________。
物理
C+2CuO ====2Cu+CO2↑
高温
黑色固体逐渐变为红色
0价变为十4价
谢 谢
第六单元 碳和碳的氧化物
课题1 金刚石、石墨和C60
课时2 碳单质的化学性质
目录
01
课程要求
03
知识点精讲
04
课堂检测
02
课前预习
掌握碳的化学性质:稳定性、可燃性、还原性;探究木炭还原氧化铜的实验,了解还原反应。
课程要求
画出碳原子的结构示意图,并说明碳单质在常温下化学性质稳定的原因。
课前预习
由于碳原子的最外层电子数为4,不易得失电子,所以碳单质在常温下化学性质稳定。
知识点精讲
知识点
碳单质的化学性质(单质碳的物理性质各异,而化学性质却____________)
1. 常温下碳的化学性质比较____________。(用墨写字、作画千年不褪色,档案用碳素墨水书写,烤焦埋入地下的木桩不易腐烂)
相似
稳定
2. 可燃性——可作____________。
(1)碳在氧气中充分燃烧,产物是____________,化学方程式为________________________。
(2)碳在氧气中不充分燃烧,产物是____________,化学方程式为________________________。
燃料
CO2
C+O2 ==== CO2
点燃
CO
2C+O2 ==== 2CO
点燃
3. 还原性(即在____________条件下,碳跟某些____________的反应)——可用于____________。
(1)木炭还原氧化铜
高温
氧化物
冶炼金属
实验装置置 实验现象 实验结论
黑色粉末___________ 反应生成________和________(填化学式),反应化学方程式为______________________
澄清石灰水_________
逐渐变为红色
变浑浊
Cu
CO2
C+2CuO ==== 2Cu+CO2↑
高温
【归纳】在碳还原氧化铜的反应里,氧化铜的氧被夺去变成铜,这种含氧化合物的氧被____________的反应,叫做____________反应。夺取氧的性质,叫做____________性,具有还原性的物质叫做还原剂。常见的还原剂有C、H2、CO。
夺去
还原
还原
【交流讨论】①加热时,酒精灯加网罩的目的是___________________________;
②反应结束后,先_________________,后_________________,目的是_________________________________________________;
③实验结束后,待试管冷却后再倒出试管内的粉末的原因是_______________________________。
集中火焰,提高温度
撤导气管
熄灭酒精灯
防止石灰水倒流进入试管中,使试管炸裂
防止灼热的Cu重新被氧化
(2)木炭还原氧化铁,化学方程式为_______________________________________________。
(3)炽热的碳还能把二氧化碳还原成一氧化碳,化学方程式为__________________________(此反应吸收热量)。
3C+2Fe2O3 ==== 4Fe+3CO2↑
高温
C+CO2 ==== 2CO
高温
课堂练习
1. 下列物质中,既具有可燃性,又具有还原性的固体单质是( )
A. 一氧化碳 B. 氢气
C. 碳 D. 氧化铜
C
2. (实验情境)如图6-1-2所示是木炭还原氧化铜的装置,以下说法正确的是( )
A. 实验结束,先熄灭酒精灯
B. 此实验说明木炭具有可燃性
C. 反应前后碳元素的化合价保持不变
D. 石灰水变浑浊说明有二氧化碳生成
D
思路点拨 ①碳的化学性质稳定性的前提条件是“常温下”;温度改变时碳的化学性质改变。②碳的可燃性要注意氧气的量,氧气充足时燃烧产物是CO2;氧气不足时则产生有毒的CO。③氧化反应和还原反应、氧化剂和还原剂这两个概念都是对反应物而言的,不是对生成物而言。
课堂检测
1. 以下反应不能体现碳做还原剂的是( )
A. CO2+C ==== 2CO
B. 2Mg+CO2 ==== C+2MgO
C. C+2CuO ==== 2Cu+CO2↑
D. 3C+2Fe2O3 ==== 4Fe+3CO2↑
高温
点燃
高温
高温
B
2. 下列鉴别木炭粉和氧化铜的方法不可行的是( )
A. 分别在氧气中燃烧 B. 分别通过氢气并加热
C. 观察它们的颜色 D. 分别放入品红溶液中
3. (社会热点)2020年12月12日,郑太高铁正式开通,高性能复合石墨滑板保证了高铁取电的安全稳定,该滑板没有用到的石墨性质是( )
A.润滑性 B.还原性
C.耐高温 D.导电性
C
B
4. 在密闭容器中6 g碳和12 g氧气充分反应后,容器内的气体有 ( )
A. 一氧化碳 B. 二氧化碳
C. 二氧化碳和氧气 D. 一氧化碳和二氧化碳
D
5. (实验情境)我国劳动人民在五千年前就会使用木炭炼铜。在化学实验室里模拟炼铜,既可用传统的实验装置(如图6-1-3甲),又可用改进的微型实验装置(如图6-1-3乙)。化学兴趣小组采用图乙装置,开展以下探究活动。
(1)写出木炭与氧化铜反应的化学
方程式:______________________,
其中发生还原反应的物质是____________。
C+2CuO==== 2Cu+CO2↑
高温
CuO
(2)判断木炭与氧化铜已经发生反应的依据是________________
__________________________________________。
(3)使用图乙装置与使用图甲装置相比,其优点是____________________________(写一条)。
(4)用甲装置进行实验,完毕后先停止加热,可能引起的后果是__________________________________________。
黑色固体中逐渐有红色固体产生,澄清石灰水变浑浊
操作简单(合理即可)
澄清石灰水倒流,引起试管炸裂
【实践活动·跨学科融合】
6. (文化自信)“扬州八怪”之一,清代著名画家郑板桥所绘的字画至今仍不褪色,这是因为墨汁中的碳( )
A. 具有可燃性 B. 具有还原性
C. 具有氧化性 D. 在常温下性质稳定
D
7. 白居易的《卖炭翁》写到“卖炭翁,伐薪烧炭南山中。满面尘灰烟火色,两鬓苍苍十指黑。卖炭得钱何所营?身上衣裳口中食。”那么诗中的“伐”属于____________变化,“炭”指木炭,写出木炭与氧化铜反应的化学方程式:_____________________,现象为________________________。反应前后碳元素的化合价变化为_______________。
物理
C+2CuO ====2Cu+CO2↑
高温
黑色固体逐渐变为红色
0价变为十4价
谢 谢
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
