江西省瑞金市第二中学2022-2023学年高三上学期开学考试化学试题(Word含答案)
文档属性
| 名称 | 江西省瑞金市第二中学2022-2023学年高三上学期开学考试化学试题(Word含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 807.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-11 00:00:00 | ||
图片预览




文档简介
瑞金二中2022-2023学年度高三第一学期开学考试化学试题
一、单选题
1.化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是
A.利用废弃的秸秆生产生物质燃料乙醇 B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物 D.利用反渗透膜从海水中分离出淡水
2.已知NA是阿伏加德罗常数的值,下列说法错误的是
A.3g 3He含有的中子数为1NA
B.1 L 0.1 mol·L 1磷酸钠溶液含有的数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
3. 《千里江山图》是宋代画家王希孟创作的绢本设色画。关于成画工序涉及化学知识的描述正确的是
选项 成画工序 化学知识
A 以绢为画布 蚕丝是绢的主要成分,属于纤维素
B 以水墨描底,画出粉本 炭黑是墨的主要成分,炭黑和石墨结构相同
C 以孔雀石上绿色 碱式碳酸铜是孔雀石的主要成分,常温易分解
D 以蓝铜矿上青色 蓝铜矿含重金属元素,可避免作品被虫蛀
4. NaH与水发生反应:。现将0.01molNaH与适量的水完全反应,得到100mL溶液。设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 该反应中NaH失去电子的数目为0.02NA B. 0.01molNaH固体中,质子数为0.12NA
C. 所得溶液中浓度为 D. 该反应中产生的体积约为0.224L(标准状况)
5.四氟肼可发生反应:,下列有关叙述错误的是
A.的氧化性比的强 B.的电子式为
C.中既含极性键又含非极性键 D.在水溶液中的电离方程式为
6.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在新制饱和氯水中:、、、
B.在能使酚酞变红的溶液中:、、、
C.在加入铝粉能产生H2的溶液中:、、、
D.在水电离出的的溶液中:、、、
7.下列离子方程式正确的是
A.等物质的量浓度的与NaOH溶液等体积混合:
B.足量气体通入NaClO溶液中:
C.溶液与过量溶液反应:
D.溶液中滴加少量稀:
8.下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
纯净物 混合物 强电解质 弱电解质 非电解质
A 盐酸 水煤气 硫酸 醋酸 干冰
B 冰醋酸 铝热剂 硫酸钡 亚硫酸 二氧化硫
C 纯碱 天然气 苛性钾 氢硫酸 碳酸钙
D 玻璃 盐酸 氯化钠 次氯酸 氯气
9.一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
.10.某种医药中间体X,其结构简式如下图。下列有关该化合物说法正确的是
A.X的分子式为C16H11O4
B.X分子中有3种不同的官能团
C.X分子中3个六元环可能处于同一平面
D.即能发生酯化反应,又能发生水解反应
11.常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为。下列说法错误的是
A.产生22.4L(标准状况)时,反应中转移
B.反应中氧化剂和还原剂的物质的量之比为11:6
C.可用石灰乳吸收反应产生的制备漂白粉
D.可用酸化的淀粉碘化钾溶液检验食盐中的存在
12.T K时,向2.0L恒容密闭容器中充入0.10mol COCl2,发生反应COCl2(g) Cl2(g)+ CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是
t/s 0 2 4 6 8
n(Cl2)/mol 0 0.030 0.039 0.040 0.040
A.反应在前2s的平均速率v(COCl2)=0.015mol·L-1·s-1
B.平衡后,温度不变再充入一定量COCl2,该反应的化学平衡常数减小
C.保持其他条件不变,升高温度,若新平衡时c(Cl2)=0.038 mol·L-1,则反应的△H<0
D.平衡后向上述容器中再充入0.10 mol COCl2,平衡正向移动,COCl2的转化率减小
13.常温下,c(H+)=0.1mol/L的某溶液中可能含有Na+、Fe3+、Fe2+、I-、Cl-、CO中的某几种离子,现取100mL该溶液进行如图所示实验:
已知氧化性Fe3+>I2。根据实验结果,判断下列说法正确的是
A.Fe3+与Fe2+至少有一种
B.一定不存在CO,可能存在Na+和Cl-
C.一定存在Fe2+、I-、Cl-
D.该溶液中一定存在Fe2+、I-,可能含Cl-
14.实验室模拟工业处理含铬废水,操作及现象如图1所示,反应过程中铬元素的化合价变化如图2。已知:深蓝色溶液中生成了。下列说法正确的是
A.过程中,发生了氧化还原反应
B.实验开始至,溶液中发生的总反应离子方程式为:
C.过程中,元素被氧化,一定是溶液中溶解的氧气所致
D.时,在碱性条件下,溶液中含铬微粒主要为
15. 室温下,用溶液滴定溶液,混合溶液pH随所加NaOH溶液的体积V变化如图所示。下列说法不正确的是
A. 可选择酚酞作指示剂
B. ②点处的溶液中:
C. ①→③过程中水的电离程度逐渐增大
D. 当滴至时,
16.往10mL0.1mol/L的Ba(OH)2溶液中滴加等浓度NaHSO4溶液,溶液的导电能力随滴入溶液体积变化的曲线如图。下列说法正确的是
A.a点对应的溶液呈碱性
B.V2=10mL
C.水的电离程度:a> b
D.b点后的溶液满足c(Na+)>2c(SO42-)
二、填空题
17.二氧化氯(ClO2)和臭氧(O3)均有强氧化性,可用于水处理。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸;O3是一种微溶于水的蓝色气体,其体积分数超过25%时容易引起爆炸。
(1)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为___________________________________________________。
(2)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图1所示。
①反应容器B应置于30 ℃左右的水浴中,目的是__________________________。
②通入氮气的目的除了有利于将ClO2排出,还有___________________________。
③ClO2处理含CN-废水的离子方程式为_______________________________________。
④装置D的作用是________________________________。
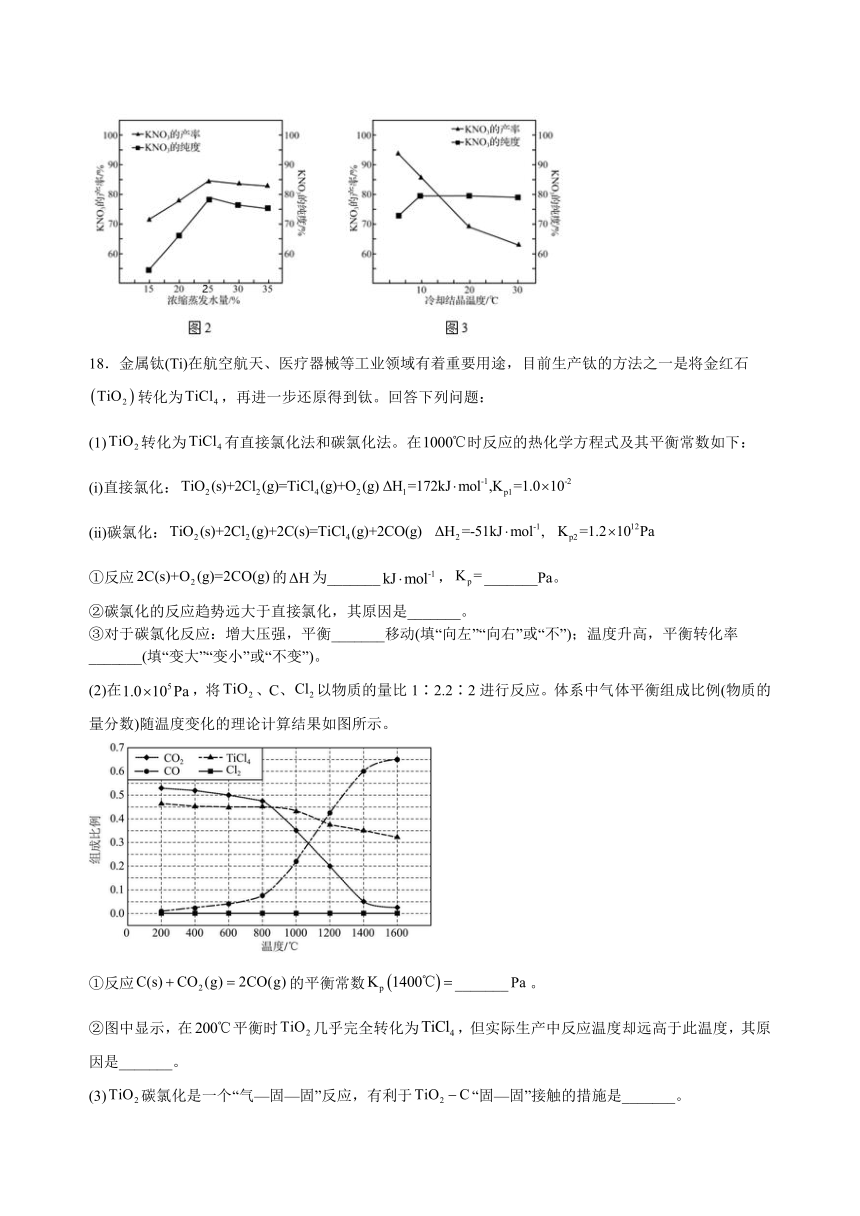
(3)某科研机构经多次实验,利用O3、KCl和工业废渣(主要成分为NaNO3和NaNO2)制得KNO3,相关工艺参数如图2和图3[浓缩蒸发水量=m(反应液蒸发的水量)/m(反应液的总质量)]。请选择最佳实验方案,参与完成他们的制备:将100 g废渣加入80 mL热水中,充分搅拌,____________________,在50 ℃恒温水浴锅中充分反应后,过滤,_____________,趁热过滤,________________, 过滤得KNO3粗品,再重结晶提纯得到KNO3。(需使用的试剂及用量:60 L 0.008 g/L O3 和80 g KCl固体)
18.金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石转化为,再进一步还原得到钛。回答下列问题:
(1)转化为有直接氯化法和碳氯化法。在时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
(ⅱ)碳氯化:
①反应的为_______,_______Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是_______。
③对于碳氯化反应:增大压强,平衡_______移动(填“向左”“向右”或“不”);温度升高,平衡转化率_______(填“变大”“变小”或“不变”)。
(2)在,将、C、以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应的平衡常数_______。
②图中显示,在平衡时几乎完全转化为,但实际生产中反应温度却远高于此温度,其原因是_______。
(3)碳氯化是一个“气—固—固”反应,有利于“固—固”接触的措施是_______。
四、工业流程题
19.磁选后的炼铁高钛炉渣,主要成分有、、、、以及少量的。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的见下表
金属离子
开始沉淀的 2.2 3.5 9.5 12.4
沉淀完全的 3.2 4.7 11.1 13.8
(1)“焙烧”中,、几乎不发生反应,、、、转化为相应的硫酸盐,写出转化为的化学方程式_______。
(2)“水浸”后“滤液”的约为2.0,在“分步沉淀”时用氨水逐步调节至11.6,依次析出的金属离子是_______。
(3)“母液①"中浓度为_______。
(4)“水浸渣”在160℃“酸溶”最适合的酸是_______。“酸溶渣”的成分是_______、_______。
(5)“酸溶”后,将溶液适当稀释并加热,水解析出沉淀,该反应的离子方程式是______。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得_______,循环利用。
20.以有机物A为原料合成K的路线如图:
已知:,R为烃基。
回答下列问题:
(1)的化学名称是_______
(2)H的结构简式为_______;其分子中的官能团名称为_______
(3)写出由C生成D第①步反应的化学方程式:_______。
(4)A→B、D→E的反应类型分别为_______、_______。
(5)上述路线设计F→G的目的是_______。
(6)同时满足下列条件的F的同分异构体有_______种(不含立体异构),其中核磁共振氢谱显示有五组氢(氢原子数量比为)的结构简式为_______(写出一种即可)。
a.含有一个苯环且苯环上有两个取代基;
b.能与溶液发生显色反应;
c.分子中含有碳碳三键。
参考答案:
1.D
【详解】A、秸杆主要成分为纤维素,利用废弃的秸秆生产生物质燃料乙醇,有新物质生成,属于化学变化,故A涉及化学反应;
B、利用石油生产塑料、化纤等高分子材料,产生新物质,属于化学变化,故B涉及化学反应;
C、利用基本化学原料生产化学合成药,产生新物质,属于化学变化,故C涉及化学反应;
D、海水中的水淡化成淡水,没有产生新物质,属于物理变化,故D不涉及化学反应;
故选D。
2.B
A. 的中子数为3-2=1,则3g的中子数为=NA,A项正确;
B. 磷酸钠为强碱弱酸盐,磷酸根离子在水溶液中会发生水解,则1L 0.1mol/L的磷酸钠溶液中磷酸根离子的个数小于1L×0.1mol/L×NA mol-1 =0.1NA,B项错误;
C. 重铬酸钾被还原为铬离子时,铬元素从+6降低到+3,1mol重铬酸钾转移的电子数为3mol×2×NA mol-1 =6NA,C项正确;
D. 正丁烷与异丁烷的分子式相同,1个分子内所含共价键数目均为13个,则48g正丁烷与10g异丁烷所得的混合物中共价键数目为×13×NA mol-1 =13NA,D项正确;
3. 【答案】D
【详解】A.由蚕丝属于蛋白质,蚕丝属于天然高分子材料,A错误;
B.炭黑结构是用炭黑颗粒聚集成链或葡萄的程度来表示的,石墨的结构是原子晶体、金属晶体和分子晶体之间的过渡晶体,炭黑在结构和组成上不同于石墨,B错误;
C.碱式碳酸铜是孔雀石的主要成分,加热易分解,C错误;
D.蓝铜矿含重金属元素,虫子是蛋白质,重金属盐能使蛋白质变性,D正确;
故选D。
4. 【答案】A
【详解】A. H由-1价升高为0价,该反应中NaH失去电子的数目为0.01NA,故A错误;
B. 0.01molNaH固体中,质子数为0.01mol×(11+1)NA/mol=0.12NA,故B正确;
C. 所得溶液中浓度为 =,故C正确;
D. 该反应中产生的体积约为0.01mol×22.4L/mol=0.224L(标准状况),故D正确;
5.B
【详解】A.反应中作氧化剂,氧气是氧化产物,所以的氧化性比的强,正确;
B.中氟原子周用应满足结构,电子式为,B错误。
C.的电子式为,其中既含极性键又含非极性键,C正确;
D.是一元弱酸,在水溶液中的电离方程式为,D正确;
6.B
【详解】A.在新制饱和氯水中存在强氧化性物质HClO和Cl2,均能氧化SO,A不合题意;
B.在能使红色石蕊试纸变蓝的溶液中存在大量的OH-:OH-、、、、均不反应,能够大量共存,,B符合题意;
C.在加入铝粉能产生H2的溶液中可能是强酸性溶液也可能是强碱性溶液,OH- 与Fe2+反应生成氢氧化亚铁沉淀,H+、NO和Fe2+将发生氧化还原反应而不能大量共存,C错误;
D.在水电离出的的溶液中可能是强酸性溶液也可能是强碱性溶液,若为酸性,则氢离子与、反应,不能够大量共存,D不符合题意;
7.C
【详解】A.等物质的量浓度的与NaOH溶液等体积混合,氢离子首先和氢氧化钠反应生成水:,故A错误;
B.足量气体通入NaClO溶液中,会发生氧化还原反应生成硫酸根离子和氯离子:ClO-+SO2+ H2O =+Cl-+2H+;,故B错误;
C.溶液与过量溶液反应生成碳酸钡沉淀和水,故C正确;
D.溶液中滴加少量稀,碘离子的还原性更强,首先反应:,故D错误;
8.B
【详解】A.盐酸是HCl的水溶液,属于混合物,故A错误;
B.冰醋酸是纯净物,铝热剂是金属铝和氧化铁的混合物,硫酸钡是强电解质,亚硫酸是弱酸,属于弱电解质,二氧化硫是非电解质,故B正确;
C.碳酸钙是盐,属于强电解质,不是非电解质,故C错误;
D.玻璃是混合物,氯气是单质,不是电解质,也不是非电解质,故D错误;
9.D
一种由短周期主族元素形成的化合物,具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大,且总和为24,根据图示,W为1价形成共价键,W为氢,Z为+1价阳离子,Z为Na,Y为3价,Y为N,24-1-11-7=5,X为B元素。
10.D
A、根据有机物碳原子成键特点,此有机物的分子式为C16H12O4,故A错误;B、含有的官能团的是酯基、羧基,故B错误;C、有机物中有sp3杂化的碳原子,因此3个六元环不一定共面,故C错误;D、含有羧基,能发生酯化反应,含有酯基能发生水解反应,故D正确。
11.A
【详解】A.该反应中只有碘元素价态升高,由0价升高至KH(IO3)2中+5价,每个碘原子升高5价,即6I260e-,又因方程式中6I23Cl2,故3Cl260e-,即Cl220e-,所以产生22.4L (标准状况) Cl2即1mol Cl2时,反应中应转移20 mol e-,A错误;
B.该反应中KClO3中氯元素价态降低,KClO3作氧化剂,I2中碘元素价态升高,I2作还原剂,由该方程式的计量系数可知,11KClO36I2,故该反应的氧化剂和还原剂的物质的量之比为11:6,B正确;
C.漂白粉的有效成分是次氯酸钙,工业制漂白粉可用石灰乳与氯气反应,C正确;
D.食盐中可先与酸化的淀粉碘化钾溶液中的H+、I-发生归中反应生成I2,I2再与淀粉发生特征反应变为蓝色,故可用酸化的淀粉碘化钾溶液检验食盐中的存在,D正确。
12.D
A.根据表格数据可知,前2s生成Cl20.03mol,由方程式可知,消耗0.03molCOCl2,则v(COCl2),A错误;
B.平衡常数只与温度有关,温度不变时,平衡常数不发生改变,B错误;
C.根据表格数据可知,反应达到平衡时,c(Cl2)=0.020 mol·L-1,保持其他条件不变,升高温度,若新平衡时c(Cl2)=0.038 mol·L-1,说明平衡正向移动,则反应为吸热反应,即△H>0,C错误;
D.平衡后向上述容器中再充入0.10 mol COCl2,增大了反应物的浓度,平衡正向移动,但根据勒夏特列原理原理,只能削弱不能抵消,COCl2增加的更多,所以COCl2的转化率减小,D正确;
13.C
【分析】c(H+)=0.1mol/L溶液中的H+可以与CO反应,故溶液中不存在CO;向溶液中通入氯气分液后得到紫色溶液,说明有I2生成,则原溶液中含有I-, Fe3+能够氧化I-,则一定不存在Fe3+;2.54g为碘单质,物质的量为=0.01mol,原溶液中含有I-的物质的量为0.02mol;水层中加入NaOH溶液得到固体,剩余离子中能与NaOH生成沉淀的离子只有Fe2+,该固体为Fe(OH)2,灼烧固体得到的1.60g为Fe2O3,则溶液中一定存在Fe2+,根据铁元素守恒可知亚铁离子的物质的量为×2=0.02mol,0.02mol Fe2+带有正电荷为0.04mol,H+带有正电荷为0.1mol/L ×0.1L=0.01mol,0.02mol I-带有负电荷为0.02mol,根据电荷守恒,原溶液中一定含有Cl-,其物质的量至少为0.04mol+0.01mol -0.02mol=0.03mol,由于不能确定是否存在Na+,故Cl-含量≥0.03mol。
14.D
A.0~5 s过程中,发生反应生成CrO5,Cr元素都呈+6价,发生非氧化还原反应,A错误;
B.由图2可知,实验开始至30s时,K2Cr2O7被还原为Cr3+,H2O2被氧化生成O2,总反应离子方程式为:+3H2O2+8H+=2Cr3++7H2O+3O2↑,B错误;
C.30s时,绿色溶液中主要含有Cr3+,80s时黄色溶液中主要含有,所以30~80 s过程中,Cr元素被氧化,可能是剩余的H2O2所致,C错误;
D.+H2O2+2H+,80 s时,在碱性条件下,平衡正向移动,溶液中含铬微粒主要为,D正确;
15. 【答案】D
【详解】A.用溶液滴定溶液时,滴定终点为,溶液显碱性,可选择酚酞作指示剂,故A正确;
B.②点处的溶液中pH=7,即c(H+)=c(OH-),根据电荷守恒可得:,故B正确;
C.①→③过程中,溶液中的溶质渐少,渐多,水的电离程度逐渐增大,故C正确;
D.当溶液滴加10ml时,溶质为和,且为1:1,由图可知溶液显酸性,即电离程度大于水解程度,当滴至时,则溶液滴加应少于10ml,此时溶液显酸性,即,故D错误;
16.A
【分析】向Ba(OH)2溶液中滴加等浓度NaHSO4溶液依次发生NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,当二者体积相等时溶液中的溶质为NaOH,当NaHSO4溶液体积为Ba(OH)2溶液体积的2倍时,二者完全反应,溶液的溶质为Na2SO4,所以当二者体积相等后继续滴加NaHSO4溶液的导电性变化减缓,当二者完全反应后滴加浓度较大NaHSO4溶液,溶液的导电性有所上升。
【详解】A.根据分析可知a二者体积相等,所以溶液中的溶质为NaOH,溶液显碱性,故A正确;
B.根据分析可知b点应为完全反应的点,NaHSO4溶液体积为Ba(OH)2溶液体积的2倍,所以V2=20mL,故B错误;
C.a点溶液溶质为NaOH,抑制水的电离,b点溶液溶质为Na2SO4,不影响水的电离,所以水的电离程度:aD.b点溶液溶质为Na2SO4,溶液中c(Na+)=2c(SO42-),b点后NaHSO4溶液过量,且NaHSO4溶液中c(Na+)=c(SO42-),所以b点后的溶液中c(Na+)<2c(SO42-),故D错误;
17. 2FeS2 +30NaClO3+14H2SO4===30ClO2↑ +Fe2(SO4)3+15Na2SO4+14H2O 提高化学反应速率,同时防止H2O2受热分解(或答:高于30 ℃会导致H2O2分解,低于30 ℃会导致反应速率较低) 稀释ClO2,防止其发生爆炸 2CN- +2ClO2===2CO2+N2+2Cl- 吸收ClO2等气体,防止污染大气 通入60 L 0.008 g·L-1O3充分反应,再加入80 g KCl固体充分反应 然后将溶液浓缩蒸发水量25% 将滤液冷却到10 ℃结晶
18.(1) -223 1.2×1014 碳氯化反应气体分子数增加, H小于0,是熵增、放热过程,熵判据与焓判据均是自发过程,而直接氯化的体系气体分子数不变、且是吸热过程 向左 变小
(2) 7.2×105 为了提高反应速率,在相同时间内得到更多的TiCl4产品,提高效益
(3)将两固体粉碎后混合,同时鼓入Cl2,使固体粉末“沸腾”
19. 硫酸
20.(1)乙二醇
(2) 醚键
(3)
(4) 加成反应 取代反应
(5)保护酮羰基
(6) 12
一、单选题
1.化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是
A.利用废弃的秸秆生产生物质燃料乙醇 B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物 D.利用反渗透膜从海水中分离出淡水
2.已知NA是阿伏加德罗常数的值,下列说法错误的是
A.3g 3He含有的中子数为1NA
B.1 L 0.1 mol·L 1磷酸钠溶液含有的数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
3. 《千里江山图》是宋代画家王希孟创作的绢本设色画。关于成画工序涉及化学知识的描述正确的是
选项 成画工序 化学知识
A 以绢为画布 蚕丝是绢的主要成分,属于纤维素
B 以水墨描底,画出粉本 炭黑是墨的主要成分,炭黑和石墨结构相同
C 以孔雀石上绿色 碱式碳酸铜是孔雀石的主要成分,常温易分解
D 以蓝铜矿上青色 蓝铜矿含重金属元素,可避免作品被虫蛀
4. NaH与水发生反应:。现将0.01molNaH与适量的水完全反应,得到100mL溶液。设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 该反应中NaH失去电子的数目为0.02NA B. 0.01molNaH固体中,质子数为0.12NA
C. 所得溶液中浓度为 D. 该反应中产生的体积约为0.224L(标准状况)
5.四氟肼可发生反应:,下列有关叙述错误的是
A.的氧化性比的强 B.的电子式为
C.中既含极性键又含非极性键 D.在水溶液中的电离方程式为
6.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在新制饱和氯水中:、、、
B.在能使酚酞变红的溶液中:、、、
C.在加入铝粉能产生H2的溶液中:、、、
D.在水电离出的的溶液中:、、、
7.下列离子方程式正确的是
A.等物质的量浓度的与NaOH溶液等体积混合:
B.足量气体通入NaClO溶液中:
C.溶液与过量溶液反应:
D.溶液中滴加少量稀:
8.下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
纯净物 混合物 强电解质 弱电解质 非电解质
A 盐酸 水煤气 硫酸 醋酸 干冰
B 冰醋酸 铝热剂 硫酸钡 亚硫酸 二氧化硫
C 纯碱 天然气 苛性钾 氢硫酸 碳酸钙
D 玻璃 盐酸 氯化钠 次氯酸 氯气
9.一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
.10.某种医药中间体X,其结构简式如下图。下列有关该化合物说法正确的是
A.X的分子式为C16H11O4
B.X分子中有3种不同的官能团
C.X分子中3个六元环可能处于同一平面
D.即能发生酯化反应,又能发生水解反应
11.常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为。下列说法错误的是
A.产生22.4L(标准状况)时,反应中转移
B.反应中氧化剂和还原剂的物质的量之比为11:6
C.可用石灰乳吸收反应产生的制备漂白粉
D.可用酸化的淀粉碘化钾溶液检验食盐中的存在
12.T K时,向2.0L恒容密闭容器中充入0.10mol COCl2,发生反应COCl2(g) Cl2(g)+ CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是
t/s 0 2 4 6 8
n(Cl2)/mol 0 0.030 0.039 0.040 0.040
A.反应在前2s的平均速率v(COCl2)=0.015mol·L-1·s-1
B.平衡后,温度不变再充入一定量COCl2,该反应的化学平衡常数减小
C.保持其他条件不变,升高温度,若新平衡时c(Cl2)=0.038 mol·L-1,则反应的△H<0
D.平衡后向上述容器中再充入0.10 mol COCl2,平衡正向移动,COCl2的转化率减小
13.常温下,c(H+)=0.1mol/L的某溶液中可能含有Na+、Fe3+、Fe2+、I-、Cl-、CO中的某几种离子,现取100mL该溶液进行如图所示实验:
已知氧化性Fe3+>I2。根据实验结果,判断下列说法正确的是
A.Fe3+与Fe2+至少有一种
B.一定不存在CO,可能存在Na+和Cl-
C.一定存在Fe2+、I-、Cl-
D.该溶液中一定存在Fe2+、I-,可能含Cl-
14.实验室模拟工业处理含铬废水,操作及现象如图1所示,反应过程中铬元素的化合价变化如图2。已知:深蓝色溶液中生成了。下列说法正确的是
A.过程中,发生了氧化还原反应
B.实验开始至,溶液中发生的总反应离子方程式为:
C.过程中,元素被氧化,一定是溶液中溶解的氧气所致
D.时,在碱性条件下,溶液中含铬微粒主要为
15. 室温下,用溶液滴定溶液,混合溶液pH随所加NaOH溶液的体积V变化如图所示。下列说法不正确的是
A. 可选择酚酞作指示剂
B. ②点处的溶液中:
C. ①→③过程中水的电离程度逐渐增大
D. 当滴至时,
16.往10mL0.1mol/L的Ba(OH)2溶液中滴加等浓度NaHSO4溶液,溶液的导电能力随滴入溶液体积变化的曲线如图。下列说法正确的是
A.a点对应的溶液呈碱性
B.V2=10mL
C.水的电离程度:a> b
D.b点后的溶液满足c(Na+)>2c(SO42-)
二、填空题
17.二氧化氯(ClO2)和臭氧(O3)均有强氧化性,可用于水处理。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸;O3是一种微溶于水的蓝色气体,其体积分数超过25%时容易引起爆炸。
(1)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为___________________________________________________。
(2)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图1所示。
①反应容器B应置于30 ℃左右的水浴中,目的是__________________________。
②通入氮气的目的除了有利于将ClO2排出,还有___________________________。
③ClO2处理含CN-废水的离子方程式为_______________________________________。
④装置D的作用是________________________________。
(3)某科研机构经多次实验,利用O3、KCl和工业废渣(主要成分为NaNO3和NaNO2)制得KNO3,相关工艺参数如图2和图3[浓缩蒸发水量=m(反应液蒸发的水量)/m(反应液的总质量)]。请选择最佳实验方案,参与完成他们的制备:将100 g废渣加入80 mL热水中,充分搅拌,____________________,在50 ℃恒温水浴锅中充分反应后,过滤,_____________,趁热过滤,________________, 过滤得KNO3粗品,再重结晶提纯得到KNO3。(需使用的试剂及用量:60 L 0.008 g/L O3 和80 g KCl固体)
18.金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石转化为,再进一步还原得到钛。回答下列问题:
(1)转化为有直接氯化法和碳氯化法。在时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
(ⅱ)碳氯化:
①反应的为_______,_______Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是_______。
③对于碳氯化反应:增大压强,平衡_______移动(填“向左”“向右”或“不”);温度升高,平衡转化率_______(填“变大”“变小”或“不变”)。
(2)在,将、C、以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应的平衡常数_______。
②图中显示,在平衡时几乎完全转化为,但实际生产中反应温度却远高于此温度,其原因是_______。
(3)碳氯化是一个“气—固—固”反应,有利于“固—固”接触的措施是_______。
四、工业流程题
19.磁选后的炼铁高钛炉渣,主要成分有、、、、以及少量的。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的见下表
金属离子
开始沉淀的 2.2 3.5 9.5 12.4
沉淀完全的 3.2 4.7 11.1 13.8
(1)“焙烧”中,、几乎不发生反应,、、、转化为相应的硫酸盐,写出转化为的化学方程式_______。
(2)“水浸”后“滤液”的约为2.0,在“分步沉淀”时用氨水逐步调节至11.6,依次析出的金属离子是_______。
(3)“母液①"中浓度为_______。
(4)“水浸渣”在160℃“酸溶”最适合的酸是_______。“酸溶渣”的成分是_______、_______。
(5)“酸溶”后,将溶液适当稀释并加热,水解析出沉淀,该反应的离子方程式是______。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得_______,循环利用。
20.以有机物A为原料合成K的路线如图:
已知:,R为烃基。
回答下列问题:
(1)的化学名称是_______
(2)H的结构简式为_______;其分子中的官能团名称为_______
(3)写出由C生成D第①步反应的化学方程式:_______。
(4)A→B、D→E的反应类型分别为_______、_______。
(5)上述路线设计F→G的目的是_______。
(6)同时满足下列条件的F的同分异构体有_______种(不含立体异构),其中核磁共振氢谱显示有五组氢(氢原子数量比为)的结构简式为_______(写出一种即可)。
a.含有一个苯环且苯环上有两个取代基;
b.能与溶液发生显色反应;
c.分子中含有碳碳三键。
参考答案:
1.D
【详解】A、秸杆主要成分为纤维素,利用废弃的秸秆生产生物质燃料乙醇,有新物质生成,属于化学变化,故A涉及化学反应;
B、利用石油生产塑料、化纤等高分子材料,产生新物质,属于化学变化,故B涉及化学反应;
C、利用基本化学原料生产化学合成药,产生新物质,属于化学变化,故C涉及化学反应;
D、海水中的水淡化成淡水,没有产生新物质,属于物理变化,故D不涉及化学反应;
故选D。
2.B
A. 的中子数为3-2=1,则3g的中子数为=NA,A项正确;
B. 磷酸钠为强碱弱酸盐,磷酸根离子在水溶液中会发生水解,则1L 0.1mol/L的磷酸钠溶液中磷酸根离子的个数小于1L×0.1mol/L×NA mol-1 =0.1NA,B项错误;
C. 重铬酸钾被还原为铬离子时,铬元素从+6降低到+3,1mol重铬酸钾转移的电子数为3mol×2×NA mol-1 =6NA,C项正确;
D. 正丁烷与异丁烷的分子式相同,1个分子内所含共价键数目均为13个,则48g正丁烷与10g异丁烷所得的混合物中共价键数目为×13×NA mol-1 =13NA,D项正确;
3. 【答案】D
【详解】A.由蚕丝属于蛋白质,蚕丝属于天然高分子材料,A错误;
B.炭黑结构是用炭黑颗粒聚集成链或葡萄的程度来表示的,石墨的结构是原子晶体、金属晶体和分子晶体之间的过渡晶体,炭黑在结构和组成上不同于石墨,B错误;
C.碱式碳酸铜是孔雀石的主要成分,加热易分解,C错误;
D.蓝铜矿含重金属元素,虫子是蛋白质,重金属盐能使蛋白质变性,D正确;
故选D。
4. 【答案】A
【详解】A. H由-1价升高为0价,该反应中NaH失去电子的数目为0.01NA,故A错误;
B. 0.01molNaH固体中,质子数为0.01mol×(11+1)NA/mol=0.12NA,故B正确;
C. 所得溶液中浓度为 =,故C正确;
D. 该反应中产生的体积约为0.01mol×22.4L/mol=0.224L(标准状况),故D正确;
5.B
【详解】A.反应中作氧化剂,氧气是氧化产物,所以的氧化性比的强,正确;
B.中氟原子周用应满足结构,电子式为,B错误。
C.的电子式为,其中既含极性键又含非极性键,C正确;
D.是一元弱酸,在水溶液中的电离方程式为,D正确;
6.B
【详解】A.在新制饱和氯水中存在强氧化性物质HClO和Cl2,均能氧化SO,A不合题意;
B.在能使红色石蕊试纸变蓝的溶液中存在大量的OH-:OH-、、、、均不反应,能够大量共存,,B符合题意;
C.在加入铝粉能产生H2的溶液中可能是强酸性溶液也可能是强碱性溶液,OH- 与Fe2+反应生成氢氧化亚铁沉淀,H+、NO和Fe2+将发生氧化还原反应而不能大量共存,C错误;
D.在水电离出的的溶液中可能是强酸性溶液也可能是强碱性溶液,若为酸性,则氢离子与、反应,不能够大量共存,D不符合题意;
7.C
【详解】A.等物质的量浓度的与NaOH溶液等体积混合,氢离子首先和氢氧化钠反应生成水:,故A错误;
B.足量气体通入NaClO溶液中,会发生氧化还原反应生成硫酸根离子和氯离子:ClO-+SO2+ H2O =+Cl-+2H+;,故B错误;
C.溶液与过量溶液反应生成碳酸钡沉淀和水,故C正确;
D.溶液中滴加少量稀,碘离子的还原性更强,首先反应:,故D错误;
8.B
【详解】A.盐酸是HCl的水溶液,属于混合物,故A错误;
B.冰醋酸是纯净物,铝热剂是金属铝和氧化铁的混合物,硫酸钡是强电解质,亚硫酸是弱酸,属于弱电解质,二氧化硫是非电解质,故B正确;
C.碳酸钙是盐,属于强电解质,不是非电解质,故C错误;
D.玻璃是混合物,氯气是单质,不是电解质,也不是非电解质,故D错误;
9.D
一种由短周期主族元素形成的化合物,具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大,且总和为24,根据图示,W为1价形成共价键,W为氢,Z为+1价阳离子,Z为Na,Y为3价,Y为N,24-1-11-7=5,X为B元素。
10.D
A、根据有机物碳原子成键特点,此有机物的分子式为C16H12O4,故A错误;B、含有的官能团的是酯基、羧基,故B错误;C、有机物中有sp3杂化的碳原子,因此3个六元环不一定共面,故C错误;D、含有羧基,能发生酯化反应,含有酯基能发生水解反应,故D正确。
11.A
【详解】A.该反应中只有碘元素价态升高,由0价升高至KH(IO3)2中+5价,每个碘原子升高5价,即6I260e-,又因方程式中6I23Cl2,故3Cl260e-,即Cl220e-,所以产生22.4L (标准状况) Cl2即1mol Cl2时,反应中应转移20 mol e-,A错误;
B.该反应中KClO3中氯元素价态降低,KClO3作氧化剂,I2中碘元素价态升高,I2作还原剂,由该方程式的计量系数可知,11KClO36I2,故该反应的氧化剂和还原剂的物质的量之比为11:6,B正确;
C.漂白粉的有效成分是次氯酸钙,工业制漂白粉可用石灰乳与氯气反应,C正确;
D.食盐中可先与酸化的淀粉碘化钾溶液中的H+、I-发生归中反应生成I2,I2再与淀粉发生特征反应变为蓝色,故可用酸化的淀粉碘化钾溶液检验食盐中的存在,D正确。
12.D
A.根据表格数据可知,前2s生成Cl20.03mol,由方程式可知,消耗0.03molCOCl2,则v(COCl2),A错误;
B.平衡常数只与温度有关,温度不变时,平衡常数不发生改变,B错误;
C.根据表格数据可知,反应达到平衡时,c(Cl2)=0.020 mol·L-1,保持其他条件不变,升高温度,若新平衡时c(Cl2)=0.038 mol·L-1,说明平衡正向移动,则反应为吸热反应,即△H>0,C错误;
D.平衡后向上述容器中再充入0.10 mol COCl2,增大了反应物的浓度,平衡正向移动,但根据勒夏特列原理原理,只能削弱不能抵消,COCl2增加的更多,所以COCl2的转化率减小,D正确;
13.C
【分析】c(H+)=0.1mol/L溶液中的H+可以与CO反应,故溶液中不存在CO;向溶液中通入氯气分液后得到紫色溶液,说明有I2生成,则原溶液中含有I-, Fe3+能够氧化I-,则一定不存在Fe3+;2.54g为碘单质,物质的量为=0.01mol,原溶液中含有I-的物质的量为0.02mol;水层中加入NaOH溶液得到固体,剩余离子中能与NaOH生成沉淀的离子只有Fe2+,该固体为Fe(OH)2,灼烧固体得到的1.60g为Fe2O3,则溶液中一定存在Fe2+,根据铁元素守恒可知亚铁离子的物质的量为×2=0.02mol,0.02mol Fe2+带有正电荷为0.04mol,H+带有正电荷为0.1mol/L ×0.1L=0.01mol,0.02mol I-带有负电荷为0.02mol,根据电荷守恒,原溶液中一定含有Cl-,其物质的量至少为0.04mol+0.01mol -0.02mol=0.03mol,由于不能确定是否存在Na+,故Cl-含量≥0.03mol。
14.D
A.0~5 s过程中,发生反应生成CrO5,Cr元素都呈+6价,发生非氧化还原反应,A错误;
B.由图2可知,实验开始至30s时,K2Cr2O7被还原为Cr3+,H2O2被氧化生成O2,总反应离子方程式为:+3H2O2+8H+=2Cr3++7H2O+3O2↑,B错误;
C.30s时,绿色溶液中主要含有Cr3+,80s时黄色溶液中主要含有,所以30~80 s过程中,Cr元素被氧化,可能是剩余的H2O2所致,C错误;
D.+H2O2+2H+,80 s时,在碱性条件下,平衡正向移动,溶液中含铬微粒主要为,D正确;
15. 【答案】D
【详解】A.用溶液滴定溶液时,滴定终点为,溶液显碱性,可选择酚酞作指示剂,故A正确;
B.②点处的溶液中pH=7,即c(H+)=c(OH-),根据电荷守恒可得:,故B正确;
C.①→③过程中,溶液中的溶质渐少,渐多,水的电离程度逐渐增大,故C正确;
D.当溶液滴加10ml时,溶质为和,且为1:1,由图可知溶液显酸性,即电离程度大于水解程度,当滴至时,则溶液滴加应少于10ml,此时溶液显酸性,即,故D错误;
16.A
【分析】向Ba(OH)2溶液中滴加等浓度NaHSO4溶液依次发生NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,当二者体积相等时溶液中的溶质为NaOH,当NaHSO4溶液体积为Ba(OH)2溶液体积的2倍时,二者完全反应,溶液的溶质为Na2SO4,所以当二者体积相等后继续滴加NaHSO4溶液的导电性变化减缓,当二者完全反应后滴加浓度较大NaHSO4溶液,溶液的导电性有所上升。
【详解】A.根据分析可知a二者体积相等,所以溶液中的溶质为NaOH,溶液显碱性,故A正确;
B.根据分析可知b点应为完全反应的点,NaHSO4溶液体积为Ba(OH)2溶液体积的2倍,所以V2=20mL,故B错误;
C.a点溶液溶质为NaOH,抑制水的电离,b点溶液溶质为Na2SO4,不影响水的电离,所以水的电离程度:a
17. 2FeS2 +30NaClO3+14H2SO4===30ClO2↑ +Fe2(SO4)3+15Na2SO4+14H2O 提高化学反应速率,同时防止H2O2受热分解(或答:高于30 ℃会导致H2O2分解,低于30 ℃会导致反应速率较低) 稀释ClO2,防止其发生爆炸 2CN- +2ClO2===2CO2+N2+2Cl- 吸收ClO2等气体,防止污染大气 通入60 L 0.008 g·L-1O3充分反应,再加入80 g KCl固体充分反应 然后将溶液浓缩蒸发水量25% 将滤液冷却到10 ℃结晶
18.(1) -223 1.2×1014 碳氯化反应气体分子数增加, H小于0,是熵增、放热过程,熵判据与焓判据均是自发过程,而直接氯化的体系气体分子数不变、且是吸热过程 向左 变小
(2) 7.2×105 为了提高反应速率,在相同时间内得到更多的TiCl4产品,提高效益
(3)将两固体粉碎后混合,同时鼓入Cl2,使固体粉末“沸腾”
19. 硫酸
20.(1)乙二醇
(2) 醚键
(3)
(4) 加成反应 取代反应
(5)保护酮羰基
(6) 12
同课章节目录
