2022-2023学年人教版九年级化学上册 5.1 质量守恒定律(第1课时)课件(37张PPT 内嵌音视频)
文档属性
| 名称 | 2022-2023学年人教版九年级化学上册 5.1 质量守恒定律(第1课时)课件(37张PPT 内嵌音视频) |  | |
| 格式 | zip | ||
| 文件大小 | 41.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-11 12:30:08 | ||
图片预览










文档简介
(共37张PPT)
课题1 质量守恒定律
U5 化学方程式
1.通过实验探究认识并掌握质量守恒定律,能说明常见化学反应中的质量关系。(重点)
2.能从微观角度解释质量守恒定律并认识化学反应。(重点)
铁生锈后质量为什么增加了?
蜡烛燃烧变短,减少的蜡烛哪里去了?
化学反应发生前后,物质的质量究竟有没有变化呢?
思考:
1.实验探究——反应前后物质的质量关系
【提出问题】
【猜想与假设】
【设计实验】
【收集证据】
探究反应前后物质的质量关系
反应原理:
红磷+氧气 五氧化二磷
点燃
实验目的:
实验方案:
红磷燃烧前后质量的测定
方案一 红磷燃烧反应前后质量测定
实验装置:
(如图所示)
注意观察:1.锥形瓶内红磷燃烧的现象;
2.气球的变化情况;
3.化学反应前后质量的变化情况。
1.实验探究——反应前后物质的质量关系
实验现象:
1.实验探究——反应前后物质的质量关系
实验结论:
实验现象:
①红磷燃烧,产生大量白烟,放出大量热;②玻璃管上端的气球先变大后变小;③天平仍保持平衡,反应前后的质量m1=m2。
反应物质量总和 = 生成物质量总和
m(P)+ m(O2)= m(P2O5)
1.实验探究——反应前后物质的质量关系
反应前物质
反应后物质
锥形瓶
细砂
橡皮塞
玻璃管、气球
(空气)
磷、
锥形瓶
细砂
橡皮塞
玻璃管、气球
氮气
稀有气体等
氮气
稀有气体等
五氧化二磷
氧气
为什么在红磷燃烧前后物质质量总和没有发生变化呢?
五氧化二磷
氧气
磷
=
m1
m2
参加反应的红磷和氧气的质量总和等于反应后生成的五氧化二磷的质量。
【解释与结论】
1.实验探究——反应前后物质的质量关系
(剩余气体)
实验步骤:
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)用带有玻璃管的橡胶塞盖紧,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
【反思与评价】
【表达与交流】
1.实验探究——反应前后物质的质量关系
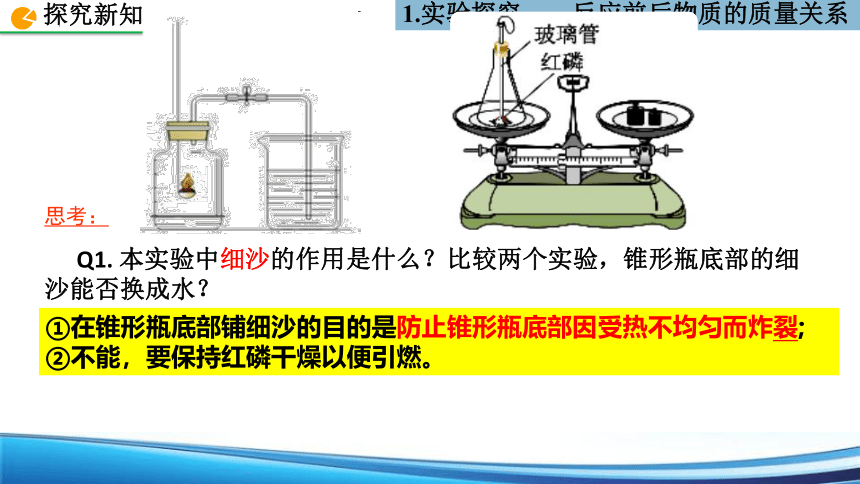
Q1. 本实验中细沙的作用是什么?比较两个实验,锥形瓶底部的细沙能否换成水?
①在锥形瓶底部铺细沙的目的是防止锥形瓶底部因受热不均匀而炸裂;
②不能,要保持红磷干燥以便引燃。
思考:
1.实验探究——反应前后物质的质量关系
实验步骤:
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)用带有玻璃管的橡胶塞盖紧,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
1.实验探究——反应前后物质的质量关系
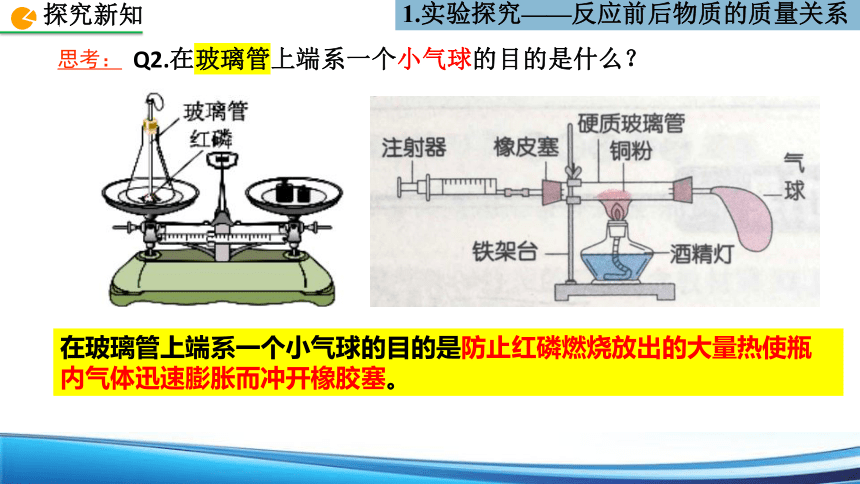
Q2.在玻璃管上端系一个小气球的目的是什么?
在玻璃管上端系一个小气球的目的是防止红磷燃烧放出的大量热使瓶内气体迅速膨胀而冲开橡胶塞。
思考:
1.实验探究——反应前后物质的质量关系
实验步骤:
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)用带有玻璃管的橡胶塞盖紧,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
引燃红磷
1.实验探究——反应前后物质的质量关系
托盘天平使用注意事项
(1)称量干燥的固体药品前,应在两个托盘上各放一张干净的大小相同的纸片,后把药品放在纸片上称量;
(2)易潮解或有腐蚀性的药品,必须放在玻璃器皿(如小烧杯、表面皿)里称量。
1.实验探究——反应前后物质的质量关系
实验步骤:
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)用带有玻璃管的橡胶塞盖紧,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
1.实验探究——反应前后物质的质量关系
Q3.如果没有迅速用橡胶塞将锥形瓶塞紧,可能出现什么现象?
Q4.如果装置漏气,可能出现什么现象?
天平偏向左边。
空气进入装置,使整体偏重。
天平偏向砝码一边。
装置内的物质逸出,导致整体偏轻。
思考:
1.实验探究——反应前后物质的质量关系
实验步骤:
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)用带有玻璃管的橡胶塞盖紧,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
1.实验探究——反应前后物质的质量关系
1.实验探究——反应前后物质的质量关系
Q5.若不等锥形瓶冷却,就将其放在天平上称量,可能出现什么现象?
天平偏向砝码一边。
因为气球受热膨胀会受到向上的空气浮力。
Q6.反应前后气球的体积是否会有不同?为什么?
红磷燃烧消耗氧气,生成五氧化二磷,使锥形瓶内气压小于外界大气压,在大气压的作用下,气球体积变小,小于反应前气球的体积。
Q7.为了保证实验结果的准确,你认为实验成功的关键在什么地方?
实验成功的关键是实验过程中装置气密性良好。
思考:
没有迅速用橡胶塞将锥形瓶塞紧 整体偏轻 装置内的物质逸出
装置漏气 整体偏重 空气进入装置
不等锥形瓶冷却,就将其放在天平上称量 整体偏轻 气球受热膨胀会受到向上的空气浮力
红磷不足 没有影响
红磷燃烧反应前后质量测定的误差分析
1.实验探究——反应前后物质的质量关系
探究反应前后物质的质量关系
反应原理:
实验目的:
实验方案:
铁钉与硫酸铜溶液反应前后质量的测定
实验装置:
(如图所示)
注意观察:
1.铁钉表面和溶液颜色的变化情况
2.化学反应前后质量的变化情况。
铁+硫酸铜 铜+硫酸亚铁
Fe CuSO4 Cu FeSO4
方案二 铁跟硫酸铜溶液反应前后质量的测定
1.实验探究——反应前后物质的质量关系
实验步骤:
1)在锥形瓶中加入适量的CuSO4溶液,塞好橡胶塞;
2)将几根铁钉用砂纸打磨干净,将盛有CuSO4溶液的锥形瓶和铁钉放在托盘天平上称量,记录所称质量m1;
3)将铁钉浸入CuSO4溶液中,观察现象;
4)待反应一段时间后溶液颜色改变时,将盛有CuSO4溶液和铁钉的锥形瓶放在托盘天平上称量,记录所称质量m2。
1.实验探究——反应前后物质的质量关系
实验结论:
实验现象:
铁钉表面有红色固体物质析出,溶液由蓝色逐渐变成浅绿色,反应前后的质量m1=m2。
参加反应的___和________的质量总和,等于反应后生成的____和__________的质量总和。
1.实验探究——反应前后物质的质量关系
铁
硫酸铜
铜
硫酸亚铁
m(Fe)+ m(CuSO4)= m(FeSO4) + m(Cu)
分析两个方案的实验结果,你得到什么结论?
思考:
参加化学反应的各物质的__________,等于反应后生成的各物质的____________。
质量守恒定律:
质量总和
质量总和
2.质量守恒定律
①质量
②化学反应
③参加
④总和
只强调“质量”,不包括“体积”
只适用于化学变化,不解释物理变化
反应物剩余、催化剂、杂质质量除外
不能漏掉气体物质
关键词:
[练习1]
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
质量守恒定律:
2.质量守恒定律
1. 通电分解水的体积一定等于生成的氢气和氧气的体积
1.质量守恒定律研究的仅是指“质量”,不能任意扩展到其他物理量。
X
[练习2]
1.下列哪些反应可用来证明质量守恒定律( )
A.石墨制成金刚石 B.10g水融化后变成10g冰
B.5g酒精与55g水形成60g酒精溶液 D.冰转化为干冰
2.质量守恒定律只适用于所有的化学反应,不适用于物理变化。
A
2.质量守恒定律
D
2.下列叙述完全符合质量守恒定律是( )
A.水结冰前后,质量保持不变,该变化遵守质量守恒定律
B.50ml水和50ml酒精混合后总体积<100ml
C.在100g过氧化氢溶液中,含有30g过氧化氢和70g水
D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
2.质量守恒定律
1.氢气和氧气形成的混合气体的质量一定等于其反应后生成的水的质量。
[练习3]
X
3.参加化学反应的各物质是指实际反应掉的,反应物中剩余的或不参加反应的物质的质量不能计算在内。
2.点燃ag氢气和bg氧气形成的混合气体生成的水的质量 (a+b)g。
[练习4]
4.“各物质质量总和”是指物质的总质量守恒,而非某一种或几种物质的质量守恒。参加反应的各种状态的反应物和生成物都计算在内,包括气液固,如沉淀、肉眼看不见的气体等。
1.agKClO3与bgMnO2混合加热最后剩cg固体,则下列说法正确的是( )
A.反应后得cgKCl B.产生氧气的质量为(a-c)g
B. MnO2的质量反应前后均为bg D.反应后所有物质的总质量为cg
C
2.bg石蜡在空气中充分燃烧,生成水和二氧化碳的质量之和 bg.
2.质量守恒定律
实验原理
实验目的
实验方案
实验装置
(如图所示)
验证质量守恒定律
盐酸+碳酸钠 氯化钠+水+二氧化碳
HCl + Na2CO3 →NaCl + H2O + CO2
盐酸与碳酸钠粉末反应前后质量的测定
注意观察:1.烧杯中盐酸与碳酸钠粉末反应的现象;
2.化学反应前后质量的变化情况。
实验现象
固体粉末溶解,产生大量气泡;天平向右倾斜
3.验证质量守恒定律
实验5-1 盐酸与碳酸钠粉末反应前后质量的测定
实验原理
实验目的
实验方案
验证质量守恒定律
镁 + 氧气 氧化镁
点燃
Mg O2 MgO
镁条燃烧前后质量的测定
注意观察:1.镁条燃烧的现象;
2.化学反应前后质量的变化情况。
实验现象
镁条剧烈燃烧,产生耀眼的白光,生成白色固体,同时还有白烟产生;天平向左倾斜。
3.验证质量守恒定律
实验5-2 镁条燃烧前后质量的测定
1.盐酸与碳酸钠粉末反应后质量为什么减轻了?是否违背质量守恒定律呢?
2.镁条燃烧后的质量为什么增加了?是否违背质量守恒定律呢?
3.镁条燃烧后的质量有没有可能不变或减小呢?
4.如果在燃着的镁条上方罩上罩,使生成物全部收集起来称量,会出现什么实验结果?
会发现天平保持平衡。
若选择有气体参加或有气体生成的化学反应来证明质量守恒定律,则反应一定要在密闭容器内进行。
反应有气体参加或生成。
2HCl + Na2CO3 = 2NaCl + H2O + CO2
2Mg + O2 = 2MgO
点燃
3.验证质量守恒定律
思考:
注意:
碳酸钠粉末
稀盐酸
盐酸与碳酸钠粉末反应前后质量的测定实验应当如何改进?
X
3.验证质量守恒定律
思考:
20.如图所示,康康设计了三个实验装置来验证质量守恒定律,请回答:(资料:NaOH溶液可吸收CO2)
(1)相关反应的化学方程式为 。
(2)图甲实验设计存在的问题是 。
(3)图乙实验设计存在的问题是 。
(4)图丙实验设计的优点是 。
反应在密闭容器中进行,二氧化碳被氢氧化钠吸收,不受浮力影响。
生成的二氧化碳气体会逸散到空气中
气球膨胀,使气球受到的浮力增大,使天平失去平衡
3.验证质量守恒定律
质量守恒定律的实验探究方法
3.验证质量守恒定律
①实验装置的选择
②药品的选择
③现象分析
④实验反思(天平失衡的原因)
对于有气体生成或参加的反应,要在密闭容器中进行。
需选择现象明显的反应,产生气泡、沉淀、变色、发光发热等。
①化学反应现象:通过实验现象,确认反应发生。
②天平平衡状况:通过天平是否平衡,说明质量变化情况。
①反应物或产物呈现不同状态,如气体质量没有计算在内
②反应装置气密性不好,部分物质进入或逸出
③用气球收集气体,受浮力影响
1.镁条燃烧后固体质量增加,不遵守质量守恒定律( )
2.蜡烛燃烧后质量减小,该反应不遵守质量守恒定律( )
H
H
O
H
H
O
水分子
H
H
H
H
O
O
氢原子
氧原子
分裂
O
O
H
H
H
H
氢分子
氧分子
结合
化学反应前后原子的 、 、 都不变。所以,化学反应前后各物质的质量总和必然相等。
数目
质量
种类
一切化学反应都遵守质量守恒定律。
注意:
H2O H2 + O2
化学反应遵守质量守恒的原因
4.质量守恒的原因
4.质量守恒的原因
两个可能变
两个一定变
六不变
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不
变
物质的种类
分子的种类
改变
可能
改变
分子数目
元素的化合价
宏观
化学变化中各种量的变化“622”
反应前后物质总质量
课本P98,T2
(1)在化学反应前后,肯定不会变化的是( )
①原子数目 ②分子数目 ③元素种类
④物质种类 ⑤原子种类 ⑥物质的总质量
A.①④⑥ B.①③⑤⑥ C.①②⑥ D.②③⑤
B
练习1 在化学变化中,下列说法正确的是( )
①原子的种类、元素的种类、分子的种类均不变
②原子的数目、分子的数目均不变
③原子的质量、元素的质量、物质的总质量均不变
④原子的种类、数量、质量均不变
A.①② B.①③ C.③④ D.②④
C
课题1 质量守恒定律
U5 化学方程式
1.通过实验探究认识并掌握质量守恒定律,能说明常见化学反应中的质量关系。(重点)
2.能从微观角度解释质量守恒定律并认识化学反应。(重点)
铁生锈后质量为什么增加了?
蜡烛燃烧变短,减少的蜡烛哪里去了?
化学反应发生前后,物质的质量究竟有没有变化呢?
思考:
1.实验探究——反应前后物质的质量关系
【提出问题】
【猜想与假设】
【设计实验】
【收集证据】
探究反应前后物质的质量关系
反应原理:
红磷+氧气 五氧化二磷
点燃
实验目的:
实验方案:
红磷燃烧前后质量的测定
方案一 红磷燃烧反应前后质量测定
实验装置:
(如图所示)
注意观察:1.锥形瓶内红磷燃烧的现象;
2.气球的变化情况;
3.化学反应前后质量的变化情况。
1.实验探究——反应前后物质的质量关系
实验现象:
1.实验探究——反应前后物质的质量关系
实验结论:
实验现象:
①红磷燃烧,产生大量白烟,放出大量热;②玻璃管上端的气球先变大后变小;③天平仍保持平衡,反应前后的质量m1=m2。
反应物质量总和 = 生成物质量总和
m(P)+ m(O2)= m(P2O5)
1.实验探究——反应前后物质的质量关系
反应前物质
反应后物质
锥形瓶
细砂
橡皮塞
玻璃管、气球
(空气)
磷、
锥形瓶
细砂
橡皮塞
玻璃管、气球
氮气
稀有气体等
氮气
稀有气体等
五氧化二磷
氧气
为什么在红磷燃烧前后物质质量总和没有发生变化呢?
五氧化二磷
氧气
磷
=
m1
m2
参加反应的红磷和氧气的质量总和等于反应后生成的五氧化二磷的质量。
【解释与结论】
1.实验探究——反应前后物质的质量关系
(剩余气体)
实验步骤:
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)用带有玻璃管的橡胶塞盖紧,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
【反思与评价】
【表达与交流】
1.实验探究——反应前后物质的质量关系
Q1. 本实验中细沙的作用是什么?比较两个实验,锥形瓶底部的细沙能否换成水?
①在锥形瓶底部铺细沙的目的是防止锥形瓶底部因受热不均匀而炸裂;
②不能,要保持红磷干燥以便引燃。
思考:
1.实验探究——反应前后物质的质量关系
实验步骤:
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)用带有玻璃管的橡胶塞盖紧,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
1.实验探究——反应前后物质的质量关系
Q2.在玻璃管上端系一个小气球的目的是什么?
在玻璃管上端系一个小气球的目的是防止红磷燃烧放出的大量热使瓶内气体迅速膨胀而冲开橡胶塞。
思考:
1.实验探究——反应前后物质的质量关系
实验步骤:
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)用带有玻璃管的橡胶塞盖紧,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
引燃红磷
1.实验探究——反应前后物质的质量关系
托盘天平使用注意事项
(1)称量干燥的固体药品前,应在两个托盘上各放一张干净的大小相同的纸片,后把药品放在纸片上称量;
(2)易潮解或有腐蚀性的药品,必须放在玻璃器皿(如小烧杯、表面皿)里称量。
1.实验探究——反应前后物质的质量关系
实验步骤:
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)用带有玻璃管的橡胶塞盖紧,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
1.实验探究——反应前后物质的质量关系
Q3.如果没有迅速用橡胶塞将锥形瓶塞紧,可能出现什么现象?
Q4.如果装置漏气,可能出现什么现象?
天平偏向左边。
空气进入装置,使整体偏重。
天平偏向砝码一边。
装置内的物质逸出,导致整体偏轻。
思考:
1.实验探究——反应前后物质的质量关系
实验步骤:
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)用带有玻璃管的橡胶塞盖紧,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
1.实验探究——反应前后物质的质量关系
1.实验探究——反应前后物质的质量关系
Q5.若不等锥形瓶冷却,就将其放在天平上称量,可能出现什么现象?
天平偏向砝码一边。
因为气球受热膨胀会受到向上的空气浮力。
Q6.反应前后气球的体积是否会有不同?为什么?
红磷燃烧消耗氧气,生成五氧化二磷,使锥形瓶内气压小于外界大气压,在大气压的作用下,气球体积变小,小于反应前气球的体积。
Q7.为了保证实验结果的准确,你认为实验成功的关键在什么地方?
实验成功的关键是实验过程中装置气密性良好。
思考:
没有迅速用橡胶塞将锥形瓶塞紧 整体偏轻 装置内的物质逸出
装置漏气 整体偏重 空气进入装置
不等锥形瓶冷却,就将其放在天平上称量 整体偏轻 气球受热膨胀会受到向上的空气浮力
红磷不足 没有影响
红磷燃烧反应前后质量测定的误差分析
1.实验探究——反应前后物质的质量关系
探究反应前后物质的质量关系
反应原理:
实验目的:
实验方案:
铁钉与硫酸铜溶液反应前后质量的测定
实验装置:
(如图所示)
注意观察:
1.铁钉表面和溶液颜色的变化情况
2.化学反应前后质量的变化情况。
铁+硫酸铜 铜+硫酸亚铁
Fe CuSO4 Cu FeSO4
方案二 铁跟硫酸铜溶液反应前后质量的测定
1.实验探究——反应前后物质的质量关系
实验步骤:
1)在锥形瓶中加入适量的CuSO4溶液,塞好橡胶塞;
2)将几根铁钉用砂纸打磨干净,将盛有CuSO4溶液的锥形瓶和铁钉放在托盘天平上称量,记录所称质量m1;
3)将铁钉浸入CuSO4溶液中,观察现象;
4)待反应一段时间后溶液颜色改变时,将盛有CuSO4溶液和铁钉的锥形瓶放在托盘天平上称量,记录所称质量m2。
1.实验探究——反应前后物质的质量关系
实验结论:
实验现象:
铁钉表面有红色固体物质析出,溶液由蓝色逐渐变成浅绿色,反应前后的质量m1=m2。
参加反应的___和________的质量总和,等于反应后生成的____和__________的质量总和。
1.实验探究——反应前后物质的质量关系
铁
硫酸铜
铜
硫酸亚铁
m(Fe)+ m(CuSO4)= m(FeSO4) + m(Cu)
分析两个方案的实验结果,你得到什么结论?
思考:
参加化学反应的各物质的__________,等于反应后生成的各物质的____________。
质量守恒定律:
质量总和
质量总和
2.质量守恒定律
①质量
②化学反应
③参加
④总和
只强调“质量”,不包括“体积”
只适用于化学变化,不解释物理变化
反应物剩余、催化剂、杂质质量除外
不能漏掉气体物质
关键词:
[练习1]
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
质量守恒定律:
2.质量守恒定律
1. 通电分解水的体积一定等于生成的氢气和氧气的体积
1.质量守恒定律研究的仅是指“质量”,不能任意扩展到其他物理量。
X
[练习2]
1.下列哪些反应可用来证明质量守恒定律( )
A.石墨制成金刚石 B.10g水融化后变成10g冰
B.5g酒精与55g水形成60g酒精溶液 D.冰转化为干冰
2.质量守恒定律只适用于所有的化学反应,不适用于物理变化。
A
2.质量守恒定律
D
2.下列叙述完全符合质量守恒定律是( )
A.水结冰前后,质量保持不变,该变化遵守质量守恒定律
B.50ml水和50ml酒精混合后总体积<100ml
C.在100g过氧化氢溶液中,含有30g过氧化氢和70g水
D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
2.质量守恒定律
1.氢气和氧气形成的混合气体的质量一定等于其反应后生成的水的质量。
[练习3]
X
3.参加化学反应的各物质是指实际反应掉的,反应物中剩余的或不参加反应的物质的质量不能计算在内。
2.点燃ag氢气和bg氧气形成的混合气体生成的水的质量 (a+b)g。
[练习4]
4.“各物质质量总和”是指物质的总质量守恒,而非某一种或几种物质的质量守恒。参加反应的各种状态的反应物和生成物都计算在内,包括气液固,如沉淀、肉眼看不见的气体等。
1.agKClO3与bgMnO2混合加热最后剩cg固体,则下列说法正确的是( )
A.反应后得cgKCl B.产生氧气的质量为(a-c)g
B. MnO2的质量反应前后均为bg D.反应后所有物质的总质量为cg
C
2.bg石蜡在空气中充分燃烧,生成水和二氧化碳的质量之和 bg.
2.质量守恒定律
实验原理
实验目的
实验方案
实验装置
(如图所示)
验证质量守恒定律
盐酸+碳酸钠 氯化钠+水+二氧化碳
HCl + Na2CO3 →NaCl + H2O + CO2
盐酸与碳酸钠粉末反应前后质量的测定
注意观察:1.烧杯中盐酸与碳酸钠粉末反应的现象;
2.化学反应前后质量的变化情况。
实验现象
固体粉末溶解,产生大量气泡;天平向右倾斜
3.验证质量守恒定律
实验5-1 盐酸与碳酸钠粉末反应前后质量的测定
实验原理
实验目的
实验方案
验证质量守恒定律
镁 + 氧气 氧化镁
点燃
Mg O2 MgO
镁条燃烧前后质量的测定
注意观察:1.镁条燃烧的现象;
2.化学反应前后质量的变化情况。
实验现象
镁条剧烈燃烧,产生耀眼的白光,生成白色固体,同时还有白烟产生;天平向左倾斜。
3.验证质量守恒定律
实验5-2 镁条燃烧前后质量的测定
1.盐酸与碳酸钠粉末反应后质量为什么减轻了?是否违背质量守恒定律呢?
2.镁条燃烧后的质量为什么增加了?是否违背质量守恒定律呢?
3.镁条燃烧后的质量有没有可能不变或减小呢?
4.如果在燃着的镁条上方罩上罩,使生成物全部收集起来称量,会出现什么实验结果?
会发现天平保持平衡。
若选择有气体参加或有气体生成的化学反应来证明质量守恒定律,则反应一定要在密闭容器内进行。
反应有气体参加或生成。
2HCl + Na2CO3 = 2NaCl + H2O + CO2
2Mg + O2 = 2MgO
点燃
3.验证质量守恒定律
思考:
注意:
碳酸钠粉末
稀盐酸
盐酸与碳酸钠粉末反应前后质量的测定实验应当如何改进?
X
3.验证质量守恒定律
思考:
20.如图所示,康康设计了三个实验装置来验证质量守恒定律,请回答:(资料:NaOH溶液可吸收CO2)
(1)相关反应的化学方程式为 。
(2)图甲实验设计存在的问题是 。
(3)图乙实验设计存在的问题是 。
(4)图丙实验设计的优点是 。
反应在密闭容器中进行,二氧化碳被氢氧化钠吸收,不受浮力影响。
生成的二氧化碳气体会逸散到空气中
气球膨胀,使气球受到的浮力增大,使天平失去平衡
3.验证质量守恒定律
质量守恒定律的实验探究方法
3.验证质量守恒定律
①实验装置的选择
②药品的选择
③现象分析
④实验反思(天平失衡的原因)
对于有气体生成或参加的反应,要在密闭容器中进行。
需选择现象明显的反应,产生气泡、沉淀、变色、发光发热等。
①化学反应现象:通过实验现象,确认反应发生。
②天平平衡状况:通过天平是否平衡,说明质量变化情况。
①反应物或产物呈现不同状态,如气体质量没有计算在内
②反应装置气密性不好,部分物质进入或逸出
③用气球收集气体,受浮力影响
1.镁条燃烧后固体质量增加,不遵守质量守恒定律( )
2.蜡烛燃烧后质量减小,该反应不遵守质量守恒定律( )
H
H
O
H
H
O
水分子
H
H
H
H
O
O
氢原子
氧原子
分裂
O
O
H
H
H
H
氢分子
氧分子
结合
化学反应前后原子的 、 、 都不变。所以,化学反应前后各物质的质量总和必然相等。
数目
质量
种类
一切化学反应都遵守质量守恒定律。
注意:
H2O H2 + O2
化学反应遵守质量守恒的原因
4.质量守恒的原因
4.质量守恒的原因
两个可能变
两个一定变
六不变
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不
变
物质的种类
分子的种类
改变
可能
改变
分子数目
元素的化合价
宏观
化学变化中各种量的变化“622”
反应前后物质总质量
课本P98,T2
(1)在化学反应前后,肯定不会变化的是( )
①原子数目 ②分子数目 ③元素种类
④物质种类 ⑤原子种类 ⑥物质的总质量
A.①④⑥ B.①③⑤⑥ C.①②⑥ D.②③⑤
B
练习1 在化学变化中,下列说法正确的是( )
①原子的种类、元素的种类、分子的种类均不变
②原子的数目、分子的数目均不变
③原子的质量、元素的质量、物质的总质量均不变
④原子的种类、数量、质量均不变
A.①② B.①③ C.③④ D.②④
C
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
