化学人教版(2019)选择性必修1 3.1.《电离平衡》(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.1.《电离平衡》(共33张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-11 00:00:00 | ||
图片预览







文档简介
(共33张PPT)
1.了解强弱电解质的概念,区分强电解质和弱电解质的物质。
2.明确弱电解质的电离存在化学平衡状态,会书写电离方程式。
3.定量描述弱电解质电离——电离平衡常数
学习目标
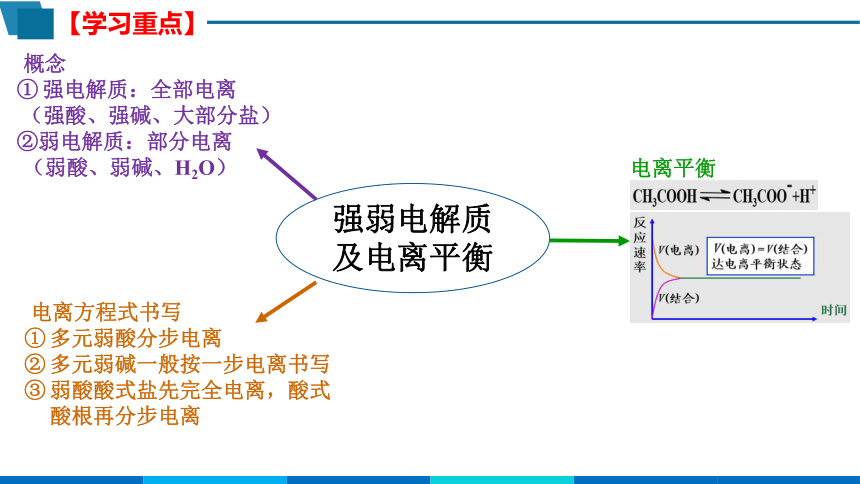
【学习重点】
强弱电解质及电离平衡
概念
强电解质:全部电离
(强酸、强碱、大部分盐)
②弱电解质:部分电离
(弱酸、弱碱、H2O)
电离方程式书写
多元弱酸分步电离
多元弱碱一般按一步电离书写
弱酸酸式盐先完全电离,酸式酸根再分步电离
电离平衡
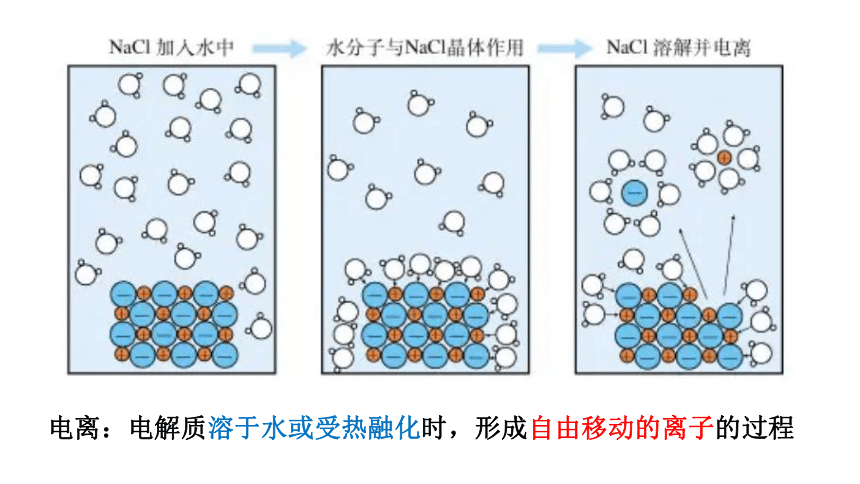
电离:电解质溶于水或受热融化时,形成自由移动的离子的过程
知识回顾
在水溶液中或熔融状态时能够导电的化合物。
包括酸、 碱、 盐、活泼金属氧化物、少数有机物、水
在水溶液中和熔融状态都不能导电的化合物。
包括大多数有机物、NH3、大部分非金属氧化物。
如:
(1)什么叫电解质?
(2)什么叫非电解质?
乙醇,甲烷,蔗糖分子/ NH3 / NO2、SO3、CO2
证据推理
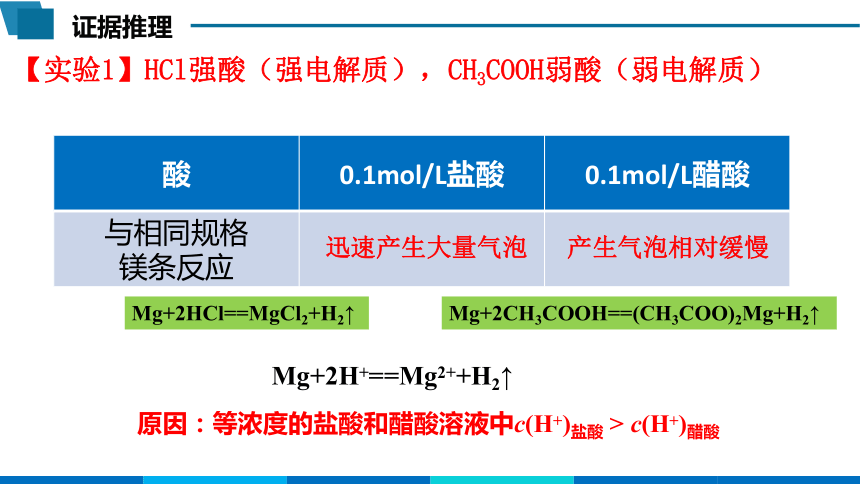
【实验1】HCl强酸(强电解质),CH3COOH弱酸(弱电解质)
酸 0.1mol/L盐酸 0.1mol/L醋酸
与相同规格 镁条反应
迅速产生大量气泡
产生气泡相对缓慢
Mg+2HCl==MgCl2+H2↑
Mg+2CH3COOH==(CH3COO)2Mg+H2↑
原因:等浓度的盐酸和醋酸溶液中c(H+)盐酸 > c(H+)醋酸
Mg+2H+==Mg2++H2↑
证据推理
【实验2】取相同体积、0.1mol/L的盐酸和醋酸,比较它们pH的大小
酸 0.1mol/L盐酸 0.1mol/L醋酸
与镁条反应 迅速产生大量气泡 产生气泡相对缓慢
pH
pH数据的含义
约为1
约为3
0.1mol/L盐酸中c(H+)=0.1mol/L
0.1mol/L醋酸中c(H+)=0.001mol/L
大约每100个CH3COOH只有1个CH3COOH发生电离
2.96
1.05
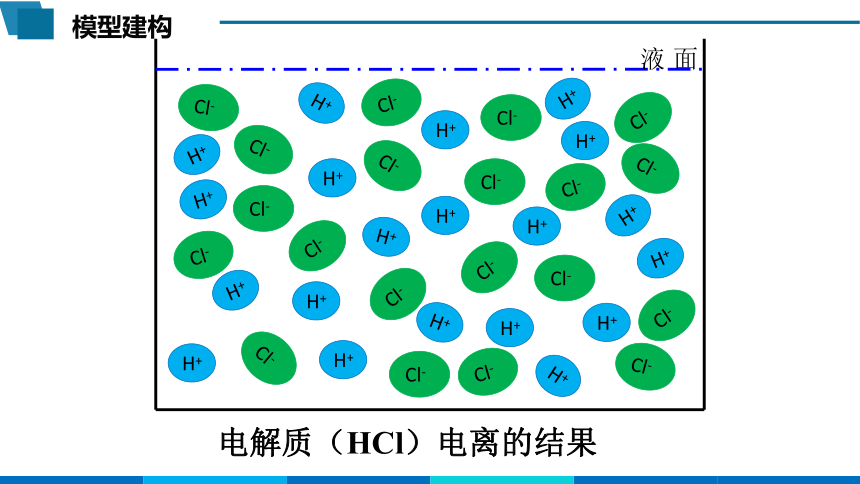
模型建构
Cl-
H+
液 面
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
电解质(HCl)电离的结果
模型建构
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
液 面
CH3COO-
H+
CH3COOH
CH3COOH
CH3COOH
CH3COOH
电解质(CH3COOH)电离的结果
CH3COOH
CH3COOH
CH3COOH
CH3COOH
大约每100个CH3COOH只有1个CH3COOH发生电离
在水溶液里只有部分电离成离子的电解质。
如:强酸、强碱、绝大多数盐类。
如:弱酸、弱碱、水,(CH3COO)2Pb。
一、 强电解质和弱电解质
在水溶液里全部电离成离子的电解质。
强电解质
1
弱电解质
2
分类依据:是否完全电离
常见的强电解质:
(1)强酸:HCl、HBr、HI、H2SO4、HNO3、HClO4等。
(2)强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。
(3)绝大多数盐:如NaCl、(NH4)2SO4、BaSO4等。
强弱电解质的类别
强电解质、弱电解质与其溶解性无关
一、 强电解质和弱电解质
常见的弱电解质:
①弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3 、CH3COOH等。
②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
③水:极弱的电解质。
强弱电解质的类别
一、 强电解质和弱电解质
符号表征
电离方程式的书写
CH3COOH CH3COO-+H+
HCl H++Cl-
强电解质用“ ” 代表完全电离
弱电解质用“ ” 代表微弱电离
弱电解质电离方程式注意事项
1.一元弱酸 、一元弱碱
1.NH3·H2O
2.HClO
NH4+ + OH-
H+ + ClO-
符号表征
H2CO3 H++HCO3- 、 HCO3- H++CO32-
Fe(OH)3 Fe3++3OH-
多元弱酸分步电离
NaHCO3 Na++HCO3- 、 HCO3- H++CO32-
多元弱碱一般按一步电离的形式书写
2.二元弱酸 H2CO3电离方程式书写
3.酸式盐的电离方程式书写
NaHSO4
Na+ + H++ SO42-
符号表征
【活动3】尝试写出以下物质在水溶液中的电离方程式
H2O
1.H2S
2.Al(OH)3
3.NaHSO3
4.NaHSO4
H+ + HS-
Al3+ + 3OH-
Na+ + HSO3-
HS- H++S2-
Na+ + H++ SO42-
HSO3- H++SO32-
1、写出下列物质在熔融状态时的电离方程式
Al2O3 NaHSO4
拓展练习
电解质的强弱与溶液的导电性:
溶液的导电性的影响因素:
①水溶液中自由移动的离子总浓度
②离子总浓度相同时,看离子所带的电荷数
(1)开始时,V电离 和 V结合怎样变化?
(2)当V电离 = V结合时,可逆过程达到一种什么样的状态?画出V~t图。
思考:在一定的条件下, 往一杯水中加进一定量的冰醋酸会发生如何的变化?
CH3COOH CH3COO - + H+
电离
结合
反应速率
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
弱电解质电离平衡状态建立示意图
时间
对于一元弱酸 HA H++A-,平衡时:
Ka=
c ( H+) .c( A-)
c(HA)
注意:弱电解质的电离常数表达式中
均为达到电离平衡后溶液中的浓度值。
在温度一定时,其电离常数就是一个定值。
表达式
五、电离平衡常数
例如
H3PO4 H+ + H2PO4-
H2PO4- H+ + HPO42-
HPO42- H+ + PO43-
五、电离平衡常数
(1)电离平衡常数与浓度无关,只与温度有关,升高温度,K 值增大。
(2)多元弱酸的各级电离常数逐渐减小。
多元弱酸各步电离常数大小比较:K1>>K2>>K3, 因此多元弱酸的酸性主要由第一步电离决定的(记住:分步进行,一步定性)。
特点
五、电离平衡常数
【课堂小结】
强弱电解质及电离平衡
概念
强电解质:全部电离
(强酸、强碱、大部分盐)
②弱电解质:部分电离
(弱酸、弱碱、H2O)
电离方程式书写
多元弱酸分步电离
多元弱碱一般按一步电离书写
弱酸酸式盐先完全电离,酸式酸根再分步电离
电离平衡
①一元弱酸、一元弱碱的电离常数
NH3·H2O NH4+ + OH-
②多元弱酸、多元弱碱的电离常数
多元弱酸的电离是分步进行的,每一步各有电离常数通常用K1 K2 K3等来分别表示。
例如:
CH3COOH CH3COO- + H+
五、电离平衡常数
五、电离平衡常数
电离常数的影响因素
(1)电离常数只受温度影响,由于电离是吸热的,因此升高温度,电离常数 。
增大
(2)电离常数与弱酸、弱碱的浓度无关。
六、电离平衡常数的意义
电离常数的意义
(1)电离常数常用于比较弱电解质的相对强弱
电离常数越大,弱电解质的电离程度越大,酸性越强。Ka用来比较弱酸酸性
H3PO4 H2SO3 HF HNO2 HCOOH
CH3COOH H2CO3 H2S HClO HCO3-
>
>
>
>
>
>
>
>
>
实验操作
实验现象 有 产生
实验结论 CH3COOH酸性大于碳酸
Ka大小比较 Ka(CH3COOH) Ka1(H2CO3)
实验探究:CH3COOH与H2CO3酸性强弱比较98例题6
气泡
大于
1
2.强酸制弱酸:酸性较强弱酸分子与弱酸酸根的盐反应
(3)加水稀释微粒比值变化:离子/分子=Ka/另一离子
离子/离子=极限法
(4)计算平衡溶液中的C(H+)或pH或电离度小本50
C2(H+)/C起始(CH3COOH)=Ka
六、电离平衡常数的意义
CH3COOH CH3COO- + H+
CH3COOH CH3COO- + H+
①温度:弱电解质的电离为吸热,升温促使电离平衡正向移动(越热越电离)
影响电离平衡的因素
④离子反应效应:加入能与弱电解质电离产生的某种离子反应的物质时,可以使电离 平衡向电离方向(正向)移动。
(1) 内因:电解质自身性质决定了其电离程度的大小
(2) 外因:
②浓度:加水稀释降低浓度,平衡向电离方向(正向)移动,电离度(转化率)增大,溶液中离子浓度减小(越稀越电离)
增大溶液浓度,平衡正向移动,但电离度(转化率)减小,各离子浓度增大
③同离子效应:加入与弱电解质具有相同离子的强电解质,将抑制弱电解质的电离, 即平衡逆向移动。
(以CH3COOH例)
四、电离平衡的影响因素
△H>0
(1)温度
【总结】由于电离过程吸热,升高温度,电离平衡向电离的方向移动,电离程度增大; 降低温度,电离平衡逆向移动,电离程度减小。
CH3COOH CH3COO- + H+
【思考】c(CH3COO-)和c(H+)怎样变化?
增大
0.1 mol/L CH3COOH溶液中:
△H>0
二、影响弱电解质电离平衡的因素
“越热越电离”
(2)浓度
平衡向电离方向移动,电离程度增大
CH3COOH CH3COO- + H+
①加水稀释:
c(CH3COO-)和c(H+)怎样变化?
【总结】加水稀释,促进电离,电离程度增大,但离子浓度减小。
减小
0.1 mol/L CH3COOH溶液中:
n(CH3COO-)和n(H+)怎样变化?
增大
二、影响弱电解质电离平衡的因素
“越稀越电离”
实验测得:用水稀释冰醋酸时氢离子浓度随加水量的变化曲线
电离平衡的影响因素
CH3COOH
H+ + CH3COO-
ΔH >0
NaOH固体
冰醋酸
H2O
CH3COONa固体
通入HCl气体
升高
温度
导电
能力
电离
程度
平衡常数 K值
平衡移动方向
c(CH3COO-)
c(H+)
c(CH3COOH)
外界干扰
体系变化
→
↘
↗
↗
↗
↗
↗
↗
←
↗
↘
不变
↘
↗
↗
←
↗
↘
不变
↘
↗
↘ ↘ ↘
不变
↗
→
↘
↗
↗
↗
→
不变
↘
↗
↘
→
↘
↗
不变
↗
↗
1.了解强弱电解质的概念,区分强电解质和弱电解质的物质。
2.明确弱电解质的电离存在化学平衡状态,会书写电离方程式。
3.定量描述弱电解质电离——电离平衡常数
学习目标
【学习重点】
强弱电解质及电离平衡
概念
强电解质:全部电离
(强酸、强碱、大部分盐)
②弱电解质:部分电离
(弱酸、弱碱、H2O)
电离方程式书写
多元弱酸分步电离
多元弱碱一般按一步电离书写
弱酸酸式盐先完全电离,酸式酸根再分步电离
电离平衡
电离:电解质溶于水或受热融化时,形成自由移动的离子的过程
知识回顾
在水溶液中或熔融状态时能够导电的化合物。
包括酸、 碱、 盐、活泼金属氧化物、少数有机物、水
在水溶液中和熔融状态都不能导电的化合物。
包括大多数有机物、NH3、大部分非金属氧化物。
如:
(1)什么叫电解质?
(2)什么叫非电解质?
乙醇,甲烷,蔗糖分子/ NH3 / NO2、SO3、CO2
证据推理
【实验1】HCl强酸(强电解质),CH3COOH弱酸(弱电解质)
酸 0.1mol/L盐酸 0.1mol/L醋酸
与相同规格 镁条反应
迅速产生大量气泡
产生气泡相对缓慢
Mg+2HCl==MgCl2+H2↑
Mg+2CH3COOH==(CH3COO)2Mg+H2↑
原因:等浓度的盐酸和醋酸溶液中c(H+)盐酸 > c(H+)醋酸
Mg+2H+==Mg2++H2↑
证据推理
【实验2】取相同体积、0.1mol/L的盐酸和醋酸,比较它们pH的大小
酸 0.1mol/L盐酸 0.1mol/L醋酸
与镁条反应 迅速产生大量气泡 产生气泡相对缓慢
pH
pH数据的含义
约为1
约为3
0.1mol/L盐酸中c(H+)=0.1mol/L
0.1mol/L醋酸中c(H+)=0.001mol/L
大约每100个CH3COOH只有1个CH3COOH发生电离
2.96
1.05
模型建构
Cl-
H+
液 面
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
电解质(HCl)电离的结果
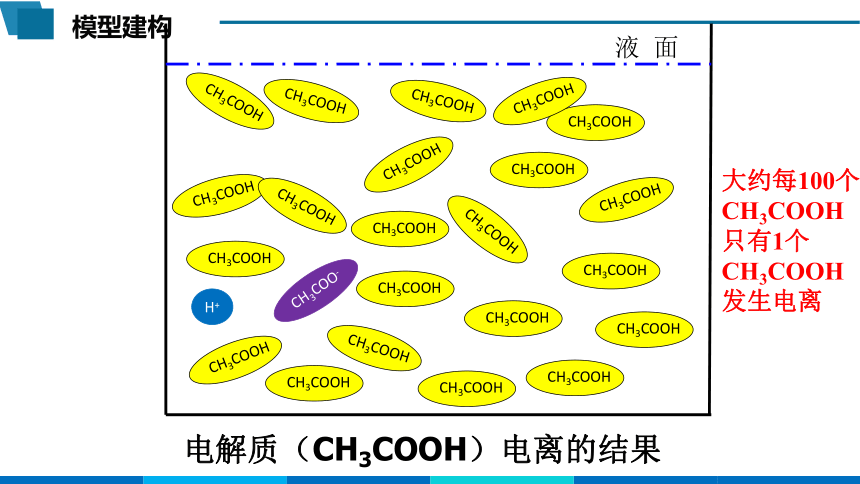
模型建构
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
液 面
CH3COO-
H+
CH3COOH
CH3COOH
CH3COOH
CH3COOH
电解质(CH3COOH)电离的结果
CH3COOH
CH3COOH
CH3COOH
CH3COOH
大约每100个CH3COOH只有1个CH3COOH发生电离
在水溶液里只有部分电离成离子的电解质。
如:强酸、强碱、绝大多数盐类。
如:弱酸、弱碱、水,(CH3COO)2Pb。
一、 强电解质和弱电解质
在水溶液里全部电离成离子的电解质。
强电解质
1
弱电解质
2
分类依据:是否完全电离
常见的强电解质:
(1)强酸:HCl、HBr、HI、H2SO4、HNO3、HClO4等。
(2)强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。
(3)绝大多数盐:如NaCl、(NH4)2SO4、BaSO4等。
强弱电解质的类别
强电解质、弱电解质与其溶解性无关
一、 强电解质和弱电解质
常见的弱电解质:
①弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3 、CH3COOH等。
②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
③水:极弱的电解质。
强弱电解质的类别
一、 强电解质和弱电解质
符号表征
电离方程式的书写
CH3COOH CH3COO-+H+
HCl H++Cl-
强电解质用“ ” 代表完全电离
弱电解质用“ ” 代表微弱电离
弱电解质电离方程式注意事项
1.一元弱酸 、一元弱碱
1.NH3·H2O
2.HClO
NH4+ + OH-
H+ + ClO-
符号表征
H2CO3 H++HCO3- 、 HCO3- H++CO32-
Fe(OH)3 Fe3++3OH-
多元弱酸分步电离
NaHCO3 Na++HCO3- 、 HCO3- H++CO32-
多元弱碱一般按一步电离的形式书写
2.二元弱酸 H2CO3电离方程式书写
3.酸式盐的电离方程式书写
NaHSO4
Na+ + H++ SO42-
符号表征
【活动3】尝试写出以下物质在水溶液中的电离方程式
H2O
1.H2S
2.Al(OH)3
3.NaHSO3
4.NaHSO4
H+ + HS-
Al3+ + 3OH-
Na+ + HSO3-
HS- H++S2-
Na+ + H++ SO42-
HSO3- H++SO32-
1、写出下列物质在熔融状态时的电离方程式
Al2O3 NaHSO4
拓展练习
电解质的强弱与溶液的导电性:
溶液的导电性的影响因素:
①水溶液中自由移动的离子总浓度
②离子总浓度相同时,看离子所带的电荷数
(1)开始时,V电离 和 V结合怎样变化?
(2)当V电离 = V结合时,可逆过程达到一种什么样的状态?画出V~t图。
思考:在一定的条件下, 往一杯水中加进一定量的冰醋酸会发生如何的变化?
CH3COOH CH3COO - + H+
电离
结合
反应速率
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
弱电解质电离平衡状态建立示意图
时间
对于一元弱酸 HA H++A-,平衡时:
Ka=
c ( H+) .c( A-)
c(HA)
注意:弱电解质的电离常数表达式中
均为达到电离平衡后溶液中的浓度值。
在温度一定时,其电离常数就是一个定值。
表达式
五、电离平衡常数
例如
H3PO4 H+ + H2PO4-
H2PO4- H+ + HPO42-
HPO42- H+ + PO43-
五、电离平衡常数
(1)电离平衡常数与浓度无关,只与温度有关,升高温度,K 值增大。
(2)多元弱酸的各级电离常数逐渐减小。
多元弱酸各步电离常数大小比较:K1>>K2>>K3, 因此多元弱酸的酸性主要由第一步电离决定的(记住:分步进行,一步定性)。
特点
五、电离平衡常数
【课堂小结】
强弱电解质及电离平衡
概念
强电解质:全部电离
(强酸、强碱、大部分盐)
②弱电解质:部分电离
(弱酸、弱碱、H2O)
电离方程式书写
多元弱酸分步电离
多元弱碱一般按一步电离书写
弱酸酸式盐先完全电离,酸式酸根再分步电离
电离平衡
①一元弱酸、一元弱碱的电离常数
NH3·H2O NH4+ + OH-
②多元弱酸、多元弱碱的电离常数
多元弱酸的电离是分步进行的,每一步各有电离常数通常用K1 K2 K3等来分别表示。
例如:
CH3COOH CH3COO- + H+
五、电离平衡常数
五、电离平衡常数
电离常数的影响因素
(1)电离常数只受温度影响,由于电离是吸热的,因此升高温度,电离常数 。
增大
(2)电离常数与弱酸、弱碱的浓度无关。
六、电离平衡常数的意义
电离常数的意义
(1)电离常数常用于比较弱电解质的相对强弱
电离常数越大,弱电解质的电离程度越大,酸性越强。Ka用来比较弱酸酸性
H3PO4 H2SO3 HF HNO2 HCOOH
CH3COOH H2CO3 H2S HClO HCO3-
>
>
>
>
>
>
>
>
>
实验操作
实验现象 有 产生
实验结论 CH3COOH酸性大于碳酸
Ka大小比较 Ka(CH3COOH) Ka1(H2CO3)
实验探究:CH3COOH与H2CO3酸性强弱比较98例题6
气泡
大于
1
2.强酸制弱酸:酸性较强弱酸分子与弱酸酸根的盐反应
(3)加水稀释微粒比值变化:离子/分子=Ka/另一离子
离子/离子=极限法
(4)计算平衡溶液中的C(H+)或pH或电离度小本50
C2(H+)/C起始(CH3COOH)=Ka
六、电离平衡常数的意义
CH3COOH CH3COO- + H+
CH3COOH CH3COO- + H+
①温度:弱电解质的电离为吸热,升温促使电离平衡正向移动(越热越电离)
影响电离平衡的因素
④离子反应效应:加入能与弱电解质电离产生的某种离子反应的物质时,可以使电离 平衡向电离方向(正向)移动。
(1) 内因:电解质自身性质决定了其电离程度的大小
(2) 外因:
②浓度:加水稀释降低浓度,平衡向电离方向(正向)移动,电离度(转化率)增大,溶液中离子浓度减小(越稀越电离)
增大溶液浓度,平衡正向移动,但电离度(转化率)减小,各离子浓度增大
③同离子效应:加入与弱电解质具有相同离子的强电解质,将抑制弱电解质的电离, 即平衡逆向移动。
(以CH3COOH例)
四、电离平衡的影响因素
△H>0
(1)温度
【总结】由于电离过程吸热,升高温度,电离平衡向电离的方向移动,电离程度增大; 降低温度,电离平衡逆向移动,电离程度减小。
CH3COOH CH3COO- + H+
【思考】c(CH3COO-)和c(H+)怎样变化?
增大
0.1 mol/L CH3COOH溶液中:
△H>0
二、影响弱电解质电离平衡的因素
“越热越电离”
(2)浓度
平衡向电离方向移动,电离程度增大
CH3COOH CH3COO- + H+
①加水稀释:
c(CH3COO-)和c(H+)怎样变化?
【总结】加水稀释,促进电离,电离程度增大,但离子浓度减小。
减小
0.1 mol/L CH3COOH溶液中:
n(CH3COO-)和n(H+)怎样变化?
增大
二、影响弱电解质电离平衡的因素
“越稀越电离”
实验测得:用水稀释冰醋酸时氢离子浓度随加水量的变化曲线
电离平衡的影响因素
CH3COOH
H+ + CH3COO-
ΔH >0
NaOH固体
冰醋酸
H2O
CH3COONa固体
通入HCl气体
升高
温度
导电
能力
电离
程度
平衡常数 K值
平衡移动方向
c(CH3COO-)
c(H+)
c(CH3COOH)
外界干扰
体系变化
→
↘
↗
↗
↗
↗
↗
↗
←
↗
↘
不变
↘
↗
↗
←
↗
↘
不变
↘
↗
↘ ↘ ↘
不变
↗
→
↘
↗
↗
↗
→
不变
↘
↗
↘
→
↘
↗
不变
↗
↗
