化学人教版(2019)必修一1.2.2 离子反应(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修一1.2.2 离子反应(共25张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-11 20:57:00 | ||
图片预览





文档简介
(共25张PPT)
第2课时
离子反应
人教版(2019)高中化学必修一第一章 第二节 离子反应
课时
安排
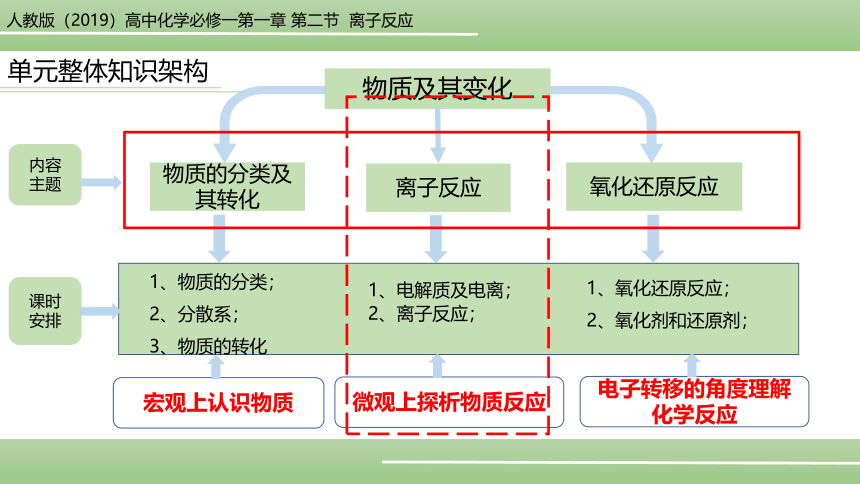
物质及其变化
单元整体知识架构
物质的分类及其转化
离子反应
氧化还原反应
内容
主题
1、物质的分类;
2、分散系;
3、物质的转化
1、电解质及电离;
2、离子反应;
1、氧化还原反应;
2、氧化剂和还原剂;
宏观上认识物质
微观上探析物质反应
电子转移的角度理解化学反应
学习目标
1.通过联系电解质的电离过程,了解新的化学概念:离子反应。
2.能够根据已有的化学知识体系,理解离子反应的本质。
第二节 离子反应
第2课时 离子反应
4.可以通过离子反应在物质的制备和分离、物质的提纯和鉴定、除污染物等方面的应用加以提升。
3.能够正确书写离子方程式。
环节一:创设情景,激发兴趣
【问题引入】三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑、腹痛、甚至死亡。
巧遇老叟指点迷津,饮用“安乐泉”,饮后可解“哑泉”之毒。
“哑泉致哑”、 “安乐泉解毒”
环节一:创设情景,激发兴趣
【过渡】电解质在水溶液中发生了电离,产生了能自由移动的离子,所以电解质在水溶液中发生的反应就必然有离子参加,这一节课我们就来学习离子反应及其发生的条件等内容。
环节二:离子反应过程的探析、离子方程式的书写
【实验探究】请各小组根据提供的实验仪器与药品,动手完成教材P16实验1-3(2),并将实验现象及结论填在下列表格中。
现象 分析
Na2SO4和BaCl2的的电离方程式 混合前两种溶液中的离子 混合后溶液中的离子
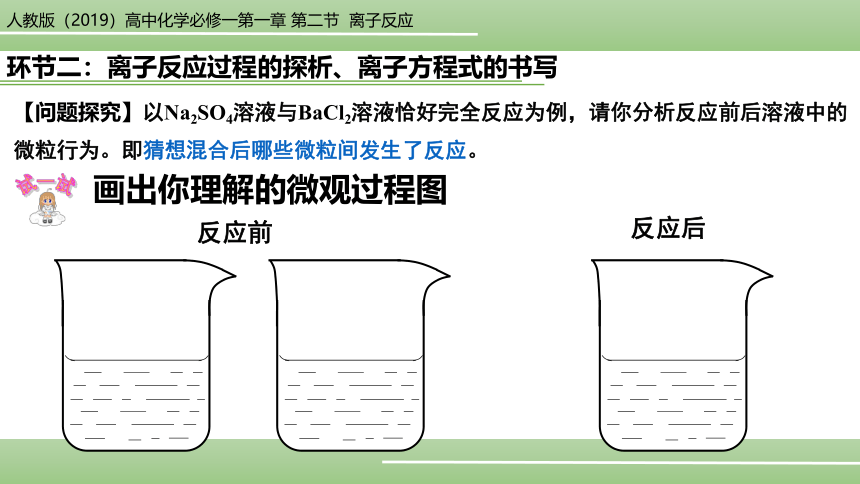
环节二:离子反应过程的探析、离子方程式的书写
【问题探究】以Na2SO4溶液与BaCl2溶液恰好完全反应为例,请你分析反应前后溶液中的微粒行为。即猜想混合后哪些微粒间发生了反应。
反应前
反应后
画出你理解的微观过程图
试一试
Na+
Na+
Na+
Na+
微观粒子变化情况
Na+
Na+
Na+
Na+
Ba2++SO42-=BaSO4↓
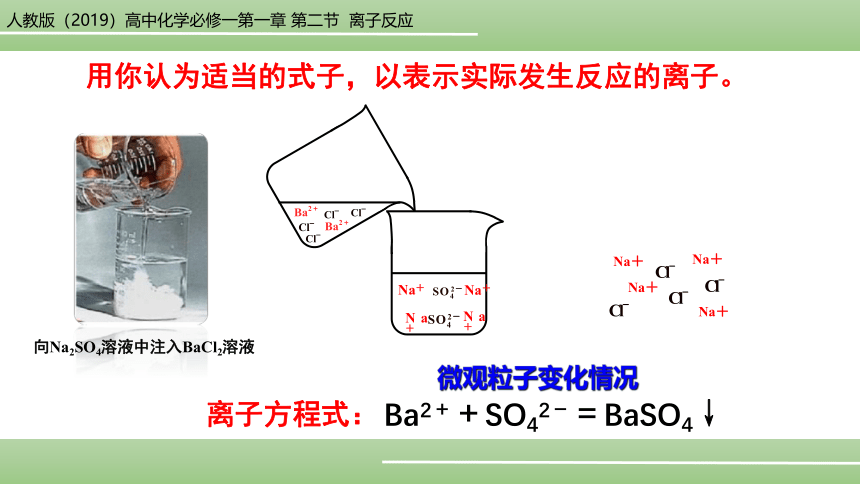
向Na2SO4溶液中注入BaCl2溶液
用你认为适当的式子,以表示实际发生反应的离子。
离子方程式:
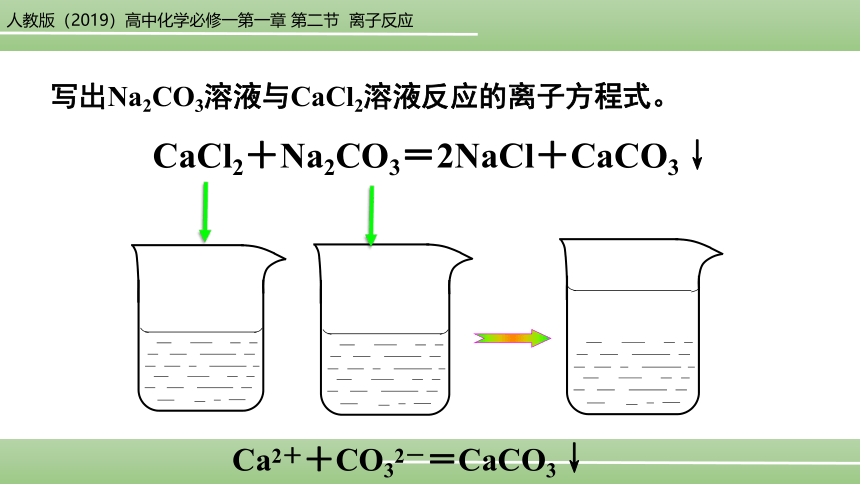
写出Na2CO3溶液与CaCl2溶液反应的离子方程式。
CaCl2+Na2CO3=2NaCl+CaCO3↓
Ca2++CO32-=CaCO3↓
环节二:离子反应过程的探析、离子方程式的书写
【问题2】根据上面实验可得出什么结论?
【结论】电解质在溶液中的反应实质是离子之间的反应。
环节二:离子反应过程的探析、离子方程式的书写
【问题3】溶液中,离子之间的反应可以通过离子方程式来表示。离子方程式的书写有一定的步骤,通过前面的学习,你认为哪一步最为关键,书写时有哪些规律?
【讲解1】书写离子方程式最关键的一步是“拆”。
要把易溶于水、易电离的物质拆成离子的形式,如酸常见的酸有盐酸、硝酸、稀硫酸、氢碘酸、氢溴酸、高氯酸强酸等 ;常见的碱有 NaOH、KOH、Ba(OH)2、Ca(OH)2(澄清)等强碱;常见的盐有 钾盐、钠盐、、铵盐、硝酸盐等可溶性盐。
1. 拆写法
写
拆
删
查
写出正确的化学方程式
CaCl2+Na2CO3=2NaCl+CaCO3↓
易溶于水易电离的物质写成离子形式,其他仍为化学式
删去方程式两边不参加反应的离子,并将其化为最简
Ca2+
+
2Cl-
+
2Na+
+
CO32-
=
2Na+
2Cl-
+
+
CaCO3↓
Ca2+
+
CO32-
=
CaCO3↓
检查方程式两边各原子个数和电荷数是否相等
拆:易溶易电离的物质
环节二:离子反应过程的探析、离子方程式的书写
2. 直写法
析
定
写
查
分析溶液中存在的微粒
确定参与反应的微粒及数量
写出实际参加反应的微粒
(即离子方程式)
检查二守恒
(原子个数守恒和电荷守恒)
环节二:离子反应过程的探析、离子方程式的书写
1.微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式,如石灰水和石灰乳,石灰水写成离子形式而石灰乳则写化学式。微溶物作为生成物,一般写化学式(标“↓”符号)。
2.一水合氨作反应物写NH3·H2O;作生成物,若有加热条件或浓度很大时,可写NH3(标“↑”符号)。
3.固体之间反应不能写离子方程式,如氯化铵与氢氧化钙的反应,浓硫酸与固体物质反应不能写离子方程式。
4.多元弱酸的酸式酸根离子,在离子方程式中不能拆开写,如NaHCO3不能拆写成“Na++H++CO32-”。
离子方程式书写步骤中,写是基础→拆是关键→删是途径→查是保证。
注意事项
考考你:离子方程式正误辨析
1.铜与稀盐酸:Cu + 2H+ = Cu2+ + H2↑
2.铁与稀硫酸:2Fe + 6H+ = 2Fe3+ + 3H2↑
3.铝与稀盐酸:Al + 2H+ = Al3+ + H2↑
Fe+2H+ = Fe2++H2↑
2Al+6H+ = 2Al3++3H2↑
4.碳酸钡和稀硝酸反应
CO32-+2H+ = H2O+CO2↑
BaCO3+2H+ = Ba2++H2O+CO2↑
实事求是
电荷守恒
拆不拆
5. 氧化铜与盐酸反应:O2- + 2H+ =H2O
CuO+2H+ = Cu2++H2O
环节三:问题驱动,离子反应及离子共存的条件探析
【任务】完成教材P17思考与讨论部分的表格内容填写,思考两种方程式在表示同一类反应时,表达的含以有什么不同,并在小组内讨论。
化学方程式表示一个具体反应,离子方程式表示同一类型反应。
H++OH-=H2O
【问题3】通过书写下面几个离子方程式,尝试归纳出离子反应的实质及发生条件是什么?
环节三: 问题驱动,离子反应及离子共存的条件探析
1. 写出K2CO3与CaCl2溶液反应的离子方程式。
Ca2++CO32-=CaCO3↓
2. 写出CaCO3与稀盐酸反应的离子方程式。
3. 写出铁与稀盐酸反应的离子方程式。
Zn + 2H+ = Zn2+ + H2↑
1.溶液中进行
2.有沉淀、气体、水生成(复分解条件)
3.或化合价发生变化
离子反应发生的条件:
离子反应的实质:两种电解质在溶液中相互交换离子的反应。
离子方程式的意义:①揭示了反应的实质;②不仅表示一定物质间的某一个反应,而且表示所有同一类型的反应。
环节二:离子反应过程的探析、离子方程式的书写
【问题2】写出BaCl2溶液与Na2SO4溶液反应的化学方程式,并从微观粒子的角度分析BaCl2溶液与Na2SO4溶液反应的实质?并试着说明KCl溶液与Na2SO4溶液不反应的原因。
化学方程式:BaCl2+Na2SO4===BaSO4↓+2NaCl,该反应的本质是Ba2++SO42-===BaSO4↓;
KCl溶液与Na2SO4溶液不反应的原因是因为混合前后离子的种类和数目均未改变。
环节三: 问题驱动,离子反应及离子共存的条件探析
离子之间能否发生反应,决定了离子能否大量共存,若离子能发生反应,则不能大量共存,若不发生反应,则离子就能大量共存。
1、离子共存问题
(1)离子间不发生化学反应就可以大量共存。
(即不生成沉淀、气体、难电离的物质)
(2)特殊条件:
无色透明
无色:不含带颜色离子,Cu2+、Fe3+、Fe2+、MnO4-
透明:无难溶物和微溶物,但并非无色
酸性
强酸性溶液
使石蕊试液变红的溶液
常温下pH<7的溶液
碱性
强碱性溶液
使酚酞试液变红、紫色石蕊试液变蓝的溶液
常温下pH>7的溶液
(3)常见离子不共存归纳:
环节三: 问题驱动,离子反应及离子共存的条件探析
1.离子间反应生成沉淀,凡是能在水溶液中相互结合生成难溶物或微溶物的离子不能大量共存,如Ca2+与CO42-,Ba2+与SO42-、Ag+与Cl-、Mg2+与OH-等之间能发生反应生成沉淀而不能大量共存。
2.离子间反应生成气体。凡是能在水溶液中相互作用生成气体的离子之间也不能大量共存。如H+与CO32-、H+与HCO3-等之间能发生反应生成气体而不能大量共存。
3.离子间反应有难电离的物质生成。若水溶液中的离子之间能发生反应生成难电离的物质,则不能大量共存。如HCO3-与OH-、NH4+与OH-、CH3COO-与H+等之间都不能大量共存。
注意事项
1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuSO4,“安乐泉”水质偏碱性。
“哑泉致哑”、 “安乐泉解毒”
用离子方程式解释解毒的原因。
化学与生活
胃液中含有盐酸,胃酸过量的人常有胃痛、烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,反应的离子方程式为_____________________________。
如果某病人同时患胃溃疡,此时最好服用胃舒平(主要成分为氢氧化铝),反应的离子方程式_____________________________。
化学与生活
第2课时
离子反应
人教版(2019)高中化学必修一第一章 第二节 离子反应
课时
安排
物质及其变化
单元整体知识架构
物质的分类及其转化
离子反应
氧化还原反应
内容
主题
1、物质的分类;
2、分散系;
3、物质的转化
1、电解质及电离;
2、离子反应;
1、氧化还原反应;
2、氧化剂和还原剂;
宏观上认识物质
微观上探析物质反应
电子转移的角度理解化学反应
学习目标
1.通过联系电解质的电离过程,了解新的化学概念:离子反应。
2.能够根据已有的化学知识体系,理解离子反应的本质。
第二节 离子反应
第2课时 离子反应
4.可以通过离子反应在物质的制备和分离、物质的提纯和鉴定、除污染物等方面的应用加以提升。
3.能够正确书写离子方程式。
环节一:创设情景,激发兴趣
【问题引入】三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑、腹痛、甚至死亡。
巧遇老叟指点迷津,饮用“安乐泉”,饮后可解“哑泉”之毒。
“哑泉致哑”、 “安乐泉解毒”
环节一:创设情景,激发兴趣
【过渡】电解质在水溶液中发生了电离,产生了能自由移动的离子,所以电解质在水溶液中发生的反应就必然有离子参加,这一节课我们就来学习离子反应及其发生的条件等内容。
环节二:离子反应过程的探析、离子方程式的书写
【实验探究】请各小组根据提供的实验仪器与药品,动手完成教材P16实验1-3(2),并将实验现象及结论填在下列表格中。
现象 分析
Na2SO4和BaCl2的的电离方程式 混合前两种溶液中的离子 混合后溶液中的离子
环节二:离子反应过程的探析、离子方程式的书写
【问题探究】以Na2SO4溶液与BaCl2溶液恰好完全反应为例,请你分析反应前后溶液中的微粒行为。即猜想混合后哪些微粒间发生了反应。
反应前
反应后
画出你理解的微观过程图
试一试
Na+
Na+
Na+
Na+
微观粒子变化情况
Na+
Na+
Na+
Na+
Ba2++SO42-=BaSO4↓
向Na2SO4溶液中注入BaCl2溶液
用你认为适当的式子,以表示实际发生反应的离子。
离子方程式:
写出Na2CO3溶液与CaCl2溶液反应的离子方程式。
CaCl2+Na2CO3=2NaCl+CaCO3↓
Ca2++CO32-=CaCO3↓
环节二:离子反应过程的探析、离子方程式的书写
【问题2】根据上面实验可得出什么结论?
【结论】电解质在溶液中的反应实质是离子之间的反应。
环节二:离子反应过程的探析、离子方程式的书写
【问题3】溶液中,离子之间的反应可以通过离子方程式来表示。离子方程式的书写有一定的步骤,通过前面的学习,你认为哪一步最为关键,书写时有哪些规律?
【讲解1】书写离子方程式最关键的一步是“拆”。
要把易溶于水、易电离的物质拆成离子的形式,如酸常见的酸有盐酸、硝酸、稀硫酸、氢碘酸、氢溴酸、高氯酸强酸等 ;常见的碱有 NaOH、KOH、Ba(OH)2、Ca(OH)2(澄清)等强碱;常见的盐有 钾盐、钠盐、、铵盐、硝酸盐等可溶性盐。
1. 拆写法
写
拆
删
查
写出正确的化学方程式
CaCl2+Na2CO3=2NaCl+CaCO3↓
易溶于水易电离的物质写成离子形式,其他仍为化学式
删去方程式两边不参加反应的离子,并将其化为最简
Ca2+
+
2Cl-
+
2Na+
+
CO32-
=
2Na+
2Cl-
+
+
CaCO3↓
Ca2+
+
CO32-
=
CaCO3↓
检查方程式两边各原子个数和电荷数是否相等
拆:易溶易电离的物质
环节二:离子反应过程的探析、离子方程式的书写
2. 直写法
析
定
写
查
分析溶液中存在的微粒
确定参与反应的微粒及数量
写出实际参加反应的微粒
(即离子方程式)
检查二守恒
(原子个数守恒和电荷守恒)
环节二:离子反应过程的探析、离子方程式的书写
1.微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式,如石灰水和石灰乳,石灰水写成离子形式而石灰乳则写化学式。微溶物作为生成物,一般写化学式(标“↓”符号)。
2.一水合氨作反应物写NH3·H2O;作生成物,若有加热条件或浓度很大时,可写NH3(标“↑”符号)。
3.固体之间反应不能写离子方程式,如氯化铵与氢氧化钙的反应,浓硫酸与固体物质反应不能写离子方程式。
4.多元弱酸的酸式酸根离子,在离子方程式中不能拆开写,如NaHCO3不能拆写成“Na++H++CO32-”。
离子方程式书写步骤中,写是基础→拆是关键→删是途径→查是保证。
注意事项
考考你:离子方程式正误辨析
1.铜与稀盐酸:Cu + 2H+ = Cu2+ + H2↑
2.铁与稀硫酸:2Fe + 6H+ = 2Fe3+ + 3H2↑
3.铝与稀盐酸:Al + 2H+ = Al3+ + H2↑
Fe+2H+ = Fe2++H2↑
2Al+6H+ = 2Al3++3H2↑
4.碳酸钡和稀硝酸反应
CO32-+2H+ = H2O+CO2↑
BaCO3+2H+ = Ba2++H2O+CO2↑
实事求是
电荷守恒
拆不拆
5. 氧化铜与盐酸反应:O2- + 2H+ =H2O
CuO+2H+ = Cu2++H2O
环节三:问题驱动,离子反应及离子共存的条件探析
【任务】完成教材P17思考与讨论部分的表格内容填写,思考两种方程式在表示同一类反应时,表达的含以有什么不同,并在小组内讨论。
化学方程式表示一个具体反应,离子方程式表示同一类型反应。
H++OH-=H2O
【问题3】通过书写下面几个离子方程式,尝试归纳出离子反应的实质及发生条件是什么?
环节三: 问题驱动,离子反应及离子共存的条件探析
1. 写出K2CO3与CaCl2溶液反应的离子方程式。
Ca2++CO32-=CaCO3↓
2. 写出CaCO3与稀盐酸反应的离子方程式。
3. 写出铁与稀盐酸反应的离子方程式。
Zn + 2H+ = Zn2+ + H2↑
1.溶液中进行
2.有沉淀、气体、水生成(复分解条件)
3.或化合价发生变化
离子反应发生的条件:
离子反应的实质:两种电解质在溶液中相互交换离子的反应。
离子方程式的意义:①揭示了反应的实质;②不仅表示一定物质间的某一个反应,而且表示所有同一类型的反应。
环节二:离子反应过程的探析、离子方程式的书写
【问题2】写出BaCl2溶液与Na2SO4溶液反应的化学方程式,并从微观粒子的角度分析BaCl2溶液与Na2SO4溶液反应的实质?并试着说明KCl溶液与Na2SO4溶液不反应的原因。
化学方程式:BaCl2+Na2SO4===BaSO4↓+2NaCl,该反应的本质是Ba2++SO42-===BaSO4↓;
KCl溶液与Na2SO4溶液不反应的原因是因为混合前后离子的种类和数目均未改变。
环节三: 问题驱动,离子反应及离子共存的条件探析
离子之间能否发生反应,决定了离子能否大量共存,若离子能发生反应,则不能大量共存,若不发生反应,则离子就能大量共存。
1、离子共存问题
(1)离子间不发生化学反应就可以大量共存。
(即不生成沉淀、气体、难电离的物质)
(2)特殊条件:
无色透明
无色:不含带颜色离子,Cu2+、Fe3+、Fe2+、MnO4-
透明:无难溶物和微溶物,但并非无色
酸性
强酸性溶液
使石蕊试液变红的溶液
常温下pH<7的溶液
碱性
强碱性溶液
使酚酞试液变红、紫色石蕊试液变蓝的溶液
常温下pH>7的溶液
(3)常见离子不共存归纳:
环节三: 问题驱动,离子反应及离子共存的条件探析
1.离子间反应生成沉淀,凡是能在水溶液中相互结合生成难溶物或微溶物的离子不能大量共存,如Ca2+与CO42-,Ba2+与SO42-、Ag+与Cl-、Mg2+与OH-等之间能发生反应生成沉淀而不能大量共存。
2.离子间反应生成气体。凡是能在水溶液中相互作用生成气体的离子之间也不能大量共存。如H+与CO32-、H+与HCO3-等之间能发生反应生成气体而不能大量共存。
3.离子间反应有难电离的物质生成。若水溶液中的离子之间能发生反应生成难电离的物质,则不能大量共存。如HCO3-与OH-、NH4+与OH-、CH3COO-与H+等之间都不能大量共存。
注意事项
1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuSO4,“安乐泉”水质偏碱性。
“哑泉致哑”、 “安乐泉解毒”
用离子方程式解释解毒的原因。
化学与生活
胃液中含有盐酸,胃酸过量的人常有胃痛、烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,反应的离子方程式为_____________________________。
如果某病人同时患胃溃疡,此时最好服用胃舒平(主要成分为氢氧化铝),反应的离子方程式_____________________________。
化学与生活
