第四章 生命之源——水 单元复习(课件49页)-2022-2023学年九年级化学上册同步精品课堂(科粤版)
文档属性
| 名称 | 第四章 生命之源——水 单元复习(课件49页)-2022-2023学年九年级化学上册同步精品课堂(科粤版) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-13 14:42:36 | ||
图片预览










文档简介
(共49张PPT)
化学(科粤版)
九年级 上册
第四章 生命之源——水
单元复习(课件)
知识框架
考点讲练
01
难点突破
趁热打铁
02
03
04
01
知识框架
知识框架
生命之源
水
我们的水资源
质量守恒定律
化学方程式
人类离不开水
珍惜水资源
水污染及其防治
水的净化与纯化
水的净化方法:沉淀法、过滤法、蒸馏法
自来水厂的净水过程
硬水与软水
水的组成(电解水)
实验现象
实验结论
微观解释
实验装置图
造成水污染的三个主要原因
水体污染的危害有
防治水体污染的办法
知识框架
生命之源
水
我们的水资源
质量守恒定律
化学方程式
水的组成(电解水)
质量守恒定律的内容
对质量守恒定律的解释
质量守恒定律的应用
六个“不变”
两个“一定变”
三个“可能变”
什么是化学方程式
化学方程式有什么意义
表示反应物、生成物、反应条件
表示反应物与生成物的粒子数之比
表示反应中各物质的质量比
化学方程式应如何读
怎样书写化学方程式
应遵循的原则
化学方程式的书写步骤:
写、配、标
怎样根据化学方程式进行计算
计算依据
计算的步骤
02
考点讲练
考点一:对水的综合考察
考点讲练
地球上水的总储量约有1.36×1018m3,但是能供人类饮用的淡水却少之又少,仅约占总储量的 ,主要是河水、淡水湖泊水和浅层地表水。我们一定要珍惜水资源,节约用水。
0.7%
题型特点:该类题目通常把珍惜水资源、水污染及其防治、水的净化和水的组成等知识综合在一起进行考查,知识点较零散。
一、珍惜水资源
国家节水标志
考点讲练
①生活中:注意水的 ;
二次利用
②农业上:采用 和 来灌溉作物
③工业上:用水 。
循环使用
喷灌
滴灌
节约用水的措施:
二、水污染及其防治
1.造成水污染的三个主要原因有:
①工业生产的 、 、 任意排放;
②生活污水的任意排放,城镇垃圾的随处堆积;
③农业上农药、化肥的 。
废渣
废液
废气
过量施用
考点讲练
被污染的水含有毒物质和细菌、病毒等,不能作饮用水,也不能用于灌溉。食用污染水域养殖的生物会使人 或 。
2.水体污染的危害有:
中毒
致病
3.防治水体污染的办法:
①工业上,通过应用 、 减少污染物的产生,同时对污染的水体作处理使之符合排放标准;
②农业上提倡使用 ,合理使用化肥和农药;
③生活污水也应逐步实现集中处理和排放。
新技术
新工艺
农家肥
考点讲练
三、水的净化与纯化
1.水的净化方法
(1)沉淀法——使水中 沉淀下来
难溶性杂质
明矾:明矾溶于水后生成胶状物,对杂质有 作用,使悬浮颗粒物沉降。
吸附
(2)过滤法——除去水中 的方法
难溶性杂质
过滤器中活性炭的作用: 。
除色素和异味
过滤后的水不是纯净物,含有 。检验含可溶性杂质的方法: 。
可溶性杂质
蒸发
考点讲练
①蒸发操作中玻璃棒的作用:
不断搅拌,使液体均匀受热,防止液体因局部过热而导致液滴飞溅。
②蒸发操作的注意事项:
(1)蒸发皿中液体的量不得超过其容积的 .
(2)当加热至 时,应停止加热利用余热蒸干.
(3)不能把热的蒸发皿直接放在实验台上,应垫上 .
(5)夹持蒸发皿要用 .
2/3
较多固体出现
坩埚钳
石棉网
考点讲练
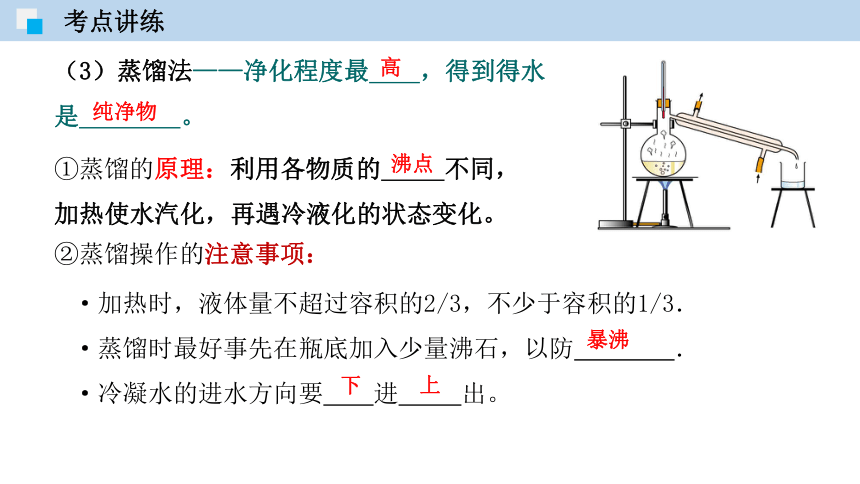
①蒸馏的原理:利用各物质的 不同,加热使水汽化,再遇冷液化的状态变化。
沸点
(3)蒸馏法——净化程度最 ,得到得水是 。
高
纯净物
②蒸馏操作的注意事项:
·加热时,液体量不超过容积的2/3,不少于容积的1/3.
·蒸馏时最好事先在瓶底加入少量沸石,以防 .
·冷凝水的进水方向要 进 出。
暴沸
下
上
考点讲练
2.硬水和软水
(2)软水:
(1)硬水:
(3)鉴别:
用 , 的是软水; 的是硬水。
(4)硬水软化方法
工业上:
生活中: ;
含有较多 的水。
不含或含较少 的水。
肥皂水
泡沫多
泡沫少,有沉淀析出
煮沸
蒸馏
可溶性钙、镁化合物
可溶性钙、镁化合物
四、水的组成——水的电解实验
1.化学方程式: ;
2H2O 2H2↑+O2↑
考点讲练
2.实验现象:
(1)接通直流电源后,电极上有 放出,连接正极的刻度管内的气体体积与连接负极的刻度管内的气体的体积比约为 ;
(2)断开电源后,正极产生的气体用带火星的木条检验,发现 ,说明该气体是 ;负极产生的气体能够燃烧,火焰呈 ,说明该气体是 。
气体
1:2
木条复燃
氧气
淡蓝色
氢气
考点讲练
3.实验结论:
①水电解产生 和 ,二者的体积比是 ;
②水是由 和 组成的
③每个水分子是由 和 构成。
1个氧原子
2个氢原子
氢元素
氧元素
氢气
氧气
2:1
4.误差分析:
在实验操作中两极产生的气体体积比往往小于1∶2的原因:① ;②氧气氧化性很强,有时在电极上就与电极发生了 反应。
氧气在水中溶解性比氢气稍大
氧化
5.注意事项:
电解水时通常在水中加入少量稀硫酸(或氢氧化钠)是为了 ,它们本身并未参加反应
增强水的导电性
考点讲练
1.(2022 荆州)水是生命之源,下列有关水的说法正确的是( )
A.地球上可利用的淡水资源取之不尽、用之不竭
B.保持水的化学性质的最小粒子是氢原子和氧原子
C.硬水中含有较多钙、镁化合物,提倡多喝硬水
D.水能溶解很多物质,是一种最常见的溶剂
D
2.(2022 南宁模拟)2021 年的爱水日主题为“珍惜水、爱护水”,下列做法不符合该主题的是( )
A.采用喷灌、滴灌浇灌农作物 B.革新工艺,循环利用工业用水
C.隔夜的白开水直接倒掉 D.为提高产量可以合理使用化肥农药
C
【巩固训练】
考点讲练
4.(2022 兴城市校级模拟)有关水的净化,下列说法错误的是( )
A.活性炭吸附色素和异味
B.自来水厂投入漂白粉进行杀菌消毒
C.煮沸可降低水的硬度
D.明矾除去水中所有不溶性杂质
D
3.(2022 娄底)下列物质能用于除去水中异味和色素的是( )
A.明矾 B.活性炭 C.小卵石 D.石英砂
B
考点讲练
5.(2022 新晃县模拟)如图是进行电解水的实验装置,下列说法正确的是( )
A.实验中反应的化学方程式为2H2O 2H2+O2
B.实验结束后,①②两管中的气压都小于外界大气压
C.实验可证明化学反应中分子可以再分,原子不能再分
D.①管与电源的正极相连,②管内产生的气体能支持燃烧
C
考点讲练
6.(昆明 中考) (1)实验室可通过电解水制得氢气和氧气。电解时需要接通 (填“交流”或“直流”)电源,有氢气生成的电极接电源的 (填“正”或“负”)极。待反应结束时,理论上生成氢气和氧气的体积比为 。
(2)可用 区分硬水和软水。蒸馏水是净化程度较高的水,实验室制取蒸馏水时,需要在烧瓶中加入几粒沸石,其作用是 。
(3)下列有利于保护水资源的是 (填标号)。
A.农业上提倡使用农家肥,禁止使用化肥和农药
B.城市生活废水经处理达标后排放
C.园林浇灌改大水漫灌为喷灌、滴灌
(4)下列各种物质中属于纯净物的是 (填标号)。
A.苏打水 B.稀盐酸 C.果汁 D.雨水 E.水
直流
负
2:1
肥皂水
防止暴沸
BC
E
考点二:质量守恒定律及其应用
考点讲练
题型特点:该考点常运用质量守恒定律的原理推断物质的元素组成或物质的化学式,有时也会结合图像或表格;或在密闭环境下探究或验证质量守恒定律。
1.质量守恒定律的内容:在化学反应里,____________的各物质的________,等于反应后生成的各物质的质量总和。
参加反应
质量总和
(1)适用于 “一切 ”,不适用于物理变化。
* 注意:
化学反应
(2)指“参加”反应的物质,未反应完的物质不计算在内。
考点讲练
(3)“生成的各物质的 ”,应当包括生成的所有物质,如沉淀、气体等。
(4)质量守恒定律的“守恒”指的是 ,其它方面如体积等不一定守恒。
质量总和
质量守恒
2.质量守恒定律的微观解释:物质发生化学反应时,只是原子重新组合,原子的_______和 都没有改变,因此,化学反应前后物质的总质量不变。
种类
数目
3.质量守恒定律中的六个“不变”
考点讲练
六个“不变” 两个“一定变” 三个“可能变”
宏观 ① ; ② ; ③ ; ; 元素的 ;物质的 。
微观 ① ; ② ; ③ ; 种类 .
元素的种类
元素的质量
物质的总质量
物质的种类
化合价
原子的种类
原子的数目
原子的质量
分子的
分子的数目
状态
4.质量守恒定律的应用:
·根据元素守恒,确定物质的元素组成
考点讲练
·利用质量守恒定律确定化学方程式中未知物质的化学式。
·计算化学反应中某物质的质量
5.质量守恒定律的验证实验
当有气体参加反应或有气体生成时,该反应必须在_________内进行,才能验证质量守恒定律。
密闭容器
考点讲练
【巩固训练】
7.(2022春 蓬莱市期末)下列有关质量守恒定律的认识,错误的是( )
A.质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关
B.通过化学变化,只能改变世界上物质的种类,不能改变物质的总质量
C.质量守恒定律为定量揭示化学变化的规律,提供了理论依据
D.随着科技的发展,精密仪器为我们定量研究化学变化创造了条件
A
考点讲练
8.(2021秋 临高县期末)某火力发电厂用石灰石浆来吸收二氧化硫,以防止污染环境,其反应的化学方程式为:2CaCO3+2SO2+O2=2CaSO4+2X,则X的化学式为( )
A.SO2 B.CO C.H2O D.CO2
D
9.(2021秋 梁平区期末)某物质与二氧化碳反应生成了碳酸钾和氧气。下列说法正确的是( )
A.某物质中只含有钾元素
B.某物质中一定含有钾、氧两种元素
C.某物质中只含有氧元素
D.某物质中一定含有钾元素,可能含有氧元素
D
考点讲练
10.(2022春 巨野县期末)在化学反应A+2B=C+3D中,已知2gA与4.1gB完全反应,生成5.6gC,生成D的质量是( )
A.6g B.5.6g C.4.5g D.0.5g
D
11.(2022 安徽模拟)刚装修好的房子里常含有甲醛,在催化剂的作用下,甲醛会发生如下反应。下列说法中正确的是( )
A.该反应中有三种氧化物 B.该反应属于置换反应
C.该反应生成的丙和丁的质量比为1:1 D.该反应可以有效消除甲醛
D
考点讲练
12.(2022·初三同步)如图所示,康康设计了三个实验装置来验证质量守恒定律,请回答:
(2)图甲实验设计存在的问题是 .
(3)图乙实验设计存在的问题是
.
(4)图丙实验设计的优点是 .
(1)相关反应的化学方程式为 (写1个).
Na2CO3+2HCl=2NaCl+H2O+CO2↑
产生的二氧化碳逸散到空气中,不能验证质量守恒定律
产生的二氧化碳造成锥形瓶内的压强增大,气球膨胀,产生浮力会影响实验结果
装置是密封的,测定结果准确
考点三:化学方程式
考点讲练
1.定义:用 表示 的式子叫做化学方程式。
化学反应
化学式
2.化学方程式的意义
②表示反应物、生成物之间微粒个数比。
③表示反应物和生成物质量比。
定性方面:
①表示反应物、生成物和反应条件。
定量方面:
3.化学方程式的读法:
C + O2 ==== CO2
点燃
①从物质角度:
碳和氧气在点燃的条件下反应生成二氧化碳
考点讲练
②从量的角度:
每12份质量的碳和32份质量的氧气在点燃的条件下反应生成44份质量的二氧化碳。
③从微观角度:
每一个碳原子恰好和1个氧分子完全反应生成1个二氧化碳分子
4.化学方程式的书写
①必须以科学实验的事实为根据;
(1)应遵循的原则:
②遵循质量守恒定律
(2)化学方程式的书写步骤
①根据实验事实,在左、右两边分别写出反应物和生成物的化学式,中间用“——”连接。
考点讲练
②配平化学方程式,即在有关化学式前面配上适当的系数,使反应前后各元素的原子个数相等,然后把“──”改成“──” 。
──
配平方法:
①最小公倍数法;
②奇数配偶数法:
③标明反应条件和生成物的状态。
④检查化学方程式中的化学式是否正确、有没有配平、反应条件是否遗漏、有没有漏标“↑”或“↓”。
5.根据化学方程式进行计算:
计算的步骤:
(1)设未知量
(2)写方程式
(4)列比例式
(5)求未知量
(6)回答问题
(3)找相关量,即列出跟计算
考点讲练
【巩固训练】
14.(2022 交城县期末)碳酸氢铵受热分解(NH4 HCO3 NH3↑+H2O↑+CO2↑)生成二氧化碳4.4g,同时生成氨气的质量是( )
A.7.9 g B.1.7 g C.1.8 g D.3.5 g
B
13.(2022春 沂源县期末)从化学方程式:2H2+O2 2H2O中获取的信息错误的是( )
A.在化学反应前后,原子的种类没有变化
B.氢气与氧气在点燃的条件下反应生成水
C.4g氢气与4g氧气充分反应,生成8g水
D.该反应说明水是由氢元素和氧元素组成的
C
考点讲练
15.(甘孜州 中考)下列化学方程式正确的是( )
A.Fe2O3+3H2SO4═Fe2(SO4)3+3H2O B.2Ag+Cu(NO3)2═Cu+2AgNO3 C.CuO+H2SO4═CuSO4+H2↑ D.2Fe+6HCl═2FeCl3+3H2↑
A
16.(2022春 呼兰区期末)为了测定实验室中高锰酸钾样品的纯度(杂质不参加反应),取16g该样品加热、完全反应后得到固体14.4g,则样品中高锰酸钾的质量分数为( )
A.80% B.90% C.95% D.98.75%
D
考点讲练
17.(北京 中考)二氧化氯(ClO2)是安全消毒剂,杀菌能力优于Cl2,可由NaClO2与Cl2反应制得。
(1)配平化学方程式: NaClO2+ Cl2═ ClO2+ NaCl。
(2)71g Cl2完全反应,理论上最多生成ClO2的质量为 g。
2
1
2
2
135
18.(2022 方城县模拟)能源、环境与人类的生活和社会的发展密切相关。二氧化碳不仅能灭火,有时也能助燃,若将点燃的镁条放入盛有二氧化碳的集气瓶中,镁条继续燃烧,发生置换反应,生成一种黑色单质和一种化合物,反应的化学方程式为 。
2Mg+CO2 2MgO+C
考点讲练
19.(2022·运城市期末)实验室加热高锰酸钾28.0g制取氧气,反应后剩余固体的质量为26.4g。请计算:
(1)生成氧气的质量。
(2)请判断剩余固体中有哪些物质,各有多少克?
解:(1)根据质量守恒定律可知,生成氧气的质量为28.0g﹣26.4g=1.6g;
(2)设生成MnO2的质量为x,K2MnO4的质量为y,
2KMnO4 K2MnO4+MnO2+O2↑
197 87 32
y x 1.6g
解得x=4.35g,y=9.85g,
4.35g+9.85g=14.2g<26.4g
说明高锰酸钾没有完全反应,含有高锰酸钾为26.4g﹣14.2g=12.2g
答:(1)生成氧气的质量为1.6g;(2)剩余固体中有高锰酸钾、锰酸钾和二氧化锰,质量分别为12.2g、9.85g和4.35g。
03
难点突破
难点突破
难点一 关于质量守恒定律的图像、表格问题
【难点梳理】
1.解题依据:
化学反应前后物质的总质量不变;元素的种类和质量也不变。
图像题和表格题一般在题干中不给出纯物质的质量,需要对坐标曲线和表格数据进行分析。其中图像类试题要多留意拐点对应的横坐标或纵坐标的值;表格类题型则需比较分析数据,在数据的变化规律中找出实际参加反应的物质或某生成物的纯量。
2.思路分析:
难点突破
【典型例题1】(盐城 中考)将一定质量的甲醇(CH3OH)和氧气(O2)置于密闭容器中点燃,一段时间后反应停止,冷却、测得反应后各物质的质量,相关数据如下表所示。下列说法不符合事实的是( )
物质 CH3OH O2 H2O CO2 X
反应前质量/g m 12.8 0 0 0
反应后质量/g 0 0 10.8 8.8 n
A.m>n C.无法判断X中是否含有氧元素
B.X中一定含有碳元素 D.生成物中C、H两种元素的质量比为3:1
C
难点突破
【典型例题2】(黑龙江 中考)四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示,则有关说法中不正确的是( )
A.丁一定是化合物
B.乙可能是这个反应的催化剂
C.生成的甲、丙两物质的质量比为8:1
D.参加反应的丁的质量一定等于生成甲和丙的质量之和
C
难点突破
难点二 有关微观示意图的解题思路
解微观示意图类题目的思路:
①先找到反应物和生成物,看反应前后是否有一样的微粒,若有则说明未完全反应,把反应前后一样的微粒删去;
②根据提示信息写出各微粒的化学式,反应物写在左侧,生成物在右侧,中间用“---”连接:
③配平化学方程式,标注反应条件,并把短线改为等号;
④根据化学方程式进行简单计算。
【难点梳理】
难点突破
D
12.(2022 常州)在催化剂作用下,N2和H2比反应生成NH3的微观过程示意如下:
下列说法正确的是( )
A.过程中原子种类不断发生变化
B.过程中H原子数不断减少
C.反应前后分子数未改变
D.NH3不具有N2和H2的化学性质
04
趁热打铁
趁热打铁
1.(2022 新抚区模拟)2022年世界水日的主题是“珍惜地下水、珍视隐藏的资源”。下列说法正确的是( )
A.地下水是取之不尽的淡水资源 B.煮沸可降低水的硬度
C.生活污水直接排放不会污染地下水
D.明矾用于自来水杀菌、消毒
B
2.(2022 江西模拟)宜春县级以上城市集中式饮用水水源地水质达标率为100%,自然界水净化的单一操作中,程度最高的是( )
A.静置沉淀 B.过滤 C.吸附 D.蒸馏
D
3.(2022 沈河区二模)电解水实验如图所示。下列说法正确的是( )
趁热打铁
D
A.a管收集的气体能使带火星的木条复燃
B.b玻璃管中的电极与直流电源的负极相连
C.电解时产生的H2和O2的质量比约为2:1
D.实验说明水由氢元素和氧元素组成
4.(2022 亭湖区校级二模)潜艇供氧的一种反应原理为2X+2CO2=2Na2CO3+O2,其中X的化学式是( )
A.Na B.Na2O C.Na2O2 D.NaOH
C
趁热打铁
5.(2022春 乳山市期末)3.2g某有机物在氧气中完全燃烧,生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列判断:①一定含有C、H元素 ②一定不含O元素 ③一定含有O元素 ④可能含有O元素 ⑤分子中C、H原子个数比为1:2 ⑥分子中C、H原子个数比为1:4.其中正确的是( )
A.①②③ B.①②⑥ C.①④⑤ D.①③⑥
D
趁热打铁
6.(2022春 初三同步练习)配平下列化学方程式:
2 1 2
2 2 1
1 2 1 1
3 1 2 3
4 1 3 4
趁热打铁
7.(淄博 中考)水与人类的生产生活密切相关,请回答下列问题。
(1)“宏观辨识与微观探析”是化学学科核心素养之一。从微观角度分析,地球表面的“水循环”主要由 运动引起的。目前从海水中获取淡水是解决淡水危机的一种途径,下列方法不能用于海水淡化的是 (填写字母)。
A.蒸发 B.过滤 C.膜法 D.多级闪急蒸馏法
(2)“宏观一微观一符号”相结合是化学学科的思维方式。如图实验装置是反应进行一段时间后的状态,请回答:水通电分解时没有发生变化的是 (填写序号)。
①水分子的能量 ②水分子的组成和结构 ③水的化学性质
④构成水分子的原子种类
点燃a注射器中的气体,写出反应的化学方程式 。
水分子
B
④
2H2+O2 2H2O
8.(2022·清河区模拟)在煤中加入适量的生石灰制成供居民采暖用的“环保煤”,以减少二氧化硫的排放,减弱二氧化硫对空气的污染环保煤”燃烧时生石灰吸收二氧化硫的化学方程式为:2CaO+mSO2+O2 nCaSO4.请回答下列问题:
(1)m、n的值是 ;
(2)若煤厂一次共加入含氧化钙80%的生石灰70吨,则理论上最大可吸收二氧化硫多少吨?
趁热打铁
2;2
趁热打铁
解:设理论上最大可吸收二氧化硫的质量为x
2CaO+2SO2+O2 2CaSO4
112 128
70t×80% x
x=64t
答:理论上最大可吸收二氧化硫64吨。
=
化学(科粤版)
九年级 上册
第四章 生命之源——水
单元复习(课件)
知识框架
考点讲练
01
难点突破
趁热打铁
02
03
04
01
知识框架
知识框架
生命之源
水
我们的水资源
质量守恒定律
化学方程式
人类离不开水
珍惜水资源
水污染及其防治
水的净化与纯化
水的净化方法:沉淀法、过滤法、蒸馏法
自来水厂的净水过程
硬水与软水
水的组成(电解水)
实验现象
实验结论
微观解释
实验装置图
造成水污染的三个主要原因
水体污染的危害有
防治水体污染的办法
知识框架
生命之源
水
我们的水资源
质量守恒定律
化学方程式
水的组成(电解水)
质量守恒定律的内容
对质量守恒定律的解释
质量守恒定律的应用
六个“不变”
两个“一定变”
三个“可能变”
什么是化学方程式
化学方程式有什么意义
表示反应物、生成物、反应条件
表示反应物与生成物的粒子数之比
表示反应中各物质的质量比
化学方程式应如何读
怎样书写化学方程式
应遵循的原则
化学方程式的书写步骤:
写、配、标
怎样根据化学方程式进行计算
计算依据
计算的步骤
02
考点讲练
考点一:对水的综合考察
考点讲练
地球上水的总储量约有1.36×1018m3,但是能供人类饮用的淡水却少之又少,仅约占总储量的 ,主要是河水、淡水湖泊水和浅层地表水。我们一定要珍惜水资源,节约用水。
0.7%
题型特点:该类题目通常把珍惜水资源、水污染及其防治、水的净化和水的组成等知识综合在一起进行考查,知识点较零散。
一、珍惜水资源
国家节水标志
考点讲练
①生活中:注意水的 ;
二次利用
②农业上:采用 和 来灌溉作物
③工业上:用水 。
循环使用
喷灌
滴灌
节约用水的措施:
二、水污染及其防治
1.造成水污染的三个主要原因有:
①工业生产的 、 、 任意排放;
②生活污水的任意排放,城镇垃圾的随处堆积;
③农业上农药、化肥的 。
废渣
废液
废气
过量施用
考点讲练
被污染的水含有毒物质和细菌、病毒等,不能作饮用水,也不能用于灌溉。食用污染水域养殖的生物会使人 或 。
2.水体污染的危害有:
中毒
致病
3.防治水体污染的办法:
①工业上,通过应用 、 减少污染物的产生,同时对污染的水体作处理使之符合排放标准;
②农业上提倡使用 ,合理使用化肥和农药;
③生活污水也应逐步实现集中处理和排放。
新技术
新工艺
农家肥
考点讲练
三、水的净化与纯化
1.水的净化方法
(1)沉淀法——使水中 沉淀下来
难溶性杂质
明矾:明矾溶于水后生成胶状物,对杂质有 作用,使悬浮颗粒物沉降。
吸附
(2)过滤法——除去水中 的方法
难溶性杂质
过滤器中活性炭的作用: 。
除色素和异味
过滤后的水不是纯净物,含有 。检验含可溶性杂质的方法: 。
可溶性杂质
蒸发
考点讲练
①蒸发操作中玻璃棒的作用:
不断搅拌,使液体均匀受热,防止液体因局部过热而导致液滴飞溅。
②蒸发操作的注意事项:
(1)蒸发皿中液体的量不得超过其容积的 .
(2)当加热至 时,应停止加热利用余热蒸干.
(3)不能把热的蒸发皿直接放在实验台上,应垫上 .
(5)夹持蒸发皿要用 .
2/3
较多固体出现
坩埚钳
石棉网
考点讲练
①蒸馏的原理:利用各物质的 不同,加热使水汽化,再遇冷液化的状态变化。
沸点
(3)蒸馏法——净化程度最 ,得到得水是 。
高
纯净物
②蒸馏操作的注意事项:
·加热时,液体量不超过容积的2/3,不少于容积的1/3.
·蒸馏时最好事先在瓶底加入少量沸石,以防 .
·冷凝水的进水方向要 进 出。
暴沸
下
上
考点讲练
2.硬水和软水
(2)软水:
(1)硬水:
(3)鉴别:
用 , 的是软水; 的是硬水。
(4)硬水软化方法
工业上:
生活中: ;
含有较多 的水。
不含或含较少 的水。
肥皂水
泡沫多
泡沫少,有沉淀析出
煮沸
蒸馏
可溶性钙、镁化合物
可溶性钙、镁化合物
四、水的组成——水的电解实验
1.化学方程式: ;
2H2O 2H2↑+O2↑
考点讲练
2.实验现象:
(1)接通直流电源后,电极上有 放出,连接正极的刻度管内的气体体积与连接负极的刻度管内的气体的体积比约为 ;
(2)断开电源后,正极产生的气体用带火星的木条检验,发现 ,说明该气体是 ;负极产生的气体能够燃烧,火焰呈 ,说明该气体是 。
气体
1:2
木条复燃
氧气
淡蓝色
氢气
考点讲练
3.实验结论:
①水电解产生 和 ,二者的体积比是 ;
②水是由 和 组成的
③每个水分子是由 和 构成。
1个氧原子
2个氢原子
氢元素
氧元素
氢气
氧气
2:1
4.误差分析:
在实验操作中两极产生的气体体积比往往小于1∶2的原因:① ;②氧气氧化性很强,有时在电极上就与电极发生了 反应。
氧气在水中溶解性比氢气稍大
氧化
5.注意事项:
电解水时通常在水中加入少量稀硫酸(或氢氧化钠)是为了 ,它们本身并未参加反应
增强水的导电性
考点讲练
1.(2022 荆州)水是生命之源,下列有关水的说法正确的是( )
A.地球上可利用的淡水资源取之不尽、用之不竭
B.保持水的化学性质的最小粒子是氢原子和氧原子
C.硬水中含有较多钙、镁化合物,提倡多喝硬水
D.水能溶解很多物质,是一种最常见的溶剂
D
2.(2022 南宁模拟)2021 年的爱水日主题为“珍惜水、爱护水”,下列做法不符合该主题的是( )
A.采用喷灌、滴灌浇灌农作物 B.革新工艺,循环利用工业用水
C.隔夜的白开水直接倒掉 D.为提高产量可以合理使用化肥农药
C
【巩固训练】
考点讲练
4.(2022 兴城市校级模拟)有关水的净化,下列说法错误的是( )
A.活性炭吸附色素和异味
B.自来水厂投入漂白粉进行杀菌消毒
C.煮沸可降低水的硬度
D.明矾除去水中所有不溶性杂质
D
3.(2022 娄底)下列物质能用于除去水中异味和色素的是( )
A.明矾 B.活性炭 C.小卵石 D.石英砂
B
考点讲练
5.(2022 新晃县模拟)如图是进行电解水的实验装置,下列说法正确的是( )
A.实验中反应的化学方程式为2H2O 2H2+O2
B.实验结束后,①②两管中的气压都小于外界大气压
C.实验可证明化学反应中分子可以再分,原子不能再分
D.①管与电源的正极相连,②管内产生的气体能支持燃烧
C
考点讲练
6.(昆明 中考) (1)实验室可通过电解水制得氢气和氧气。电解时需要接通 (填“交流”或“直流”)电源,有氢气生成的电极接电源的 (填“正”或“负”)极。待反应结束时,理论上生成氢气和氧气的体积比为 。
(2)可用 区分硬水和软水。蒸馏水是净化程度较高的水,实验室制取蒸馏水时,需要在烧瓶中加入几粒沸石,其作用是 。
(3)下列有利于保护水资源的是 (填标号)。
A.农业上提倡使用农家肥,禁止使用化肥和农药
B.城市生活废水经处理达标后排放
C.园林浇灌改大水漫灌为喷灌、滴灌
(4)下列各种物质中属于纯净物的是 (填标号)。
A.苏打水 B.稀盐酸 C.果汁 D.雨水 E.水
直流
负
2:1
肥皂水
防止暴沸
BC
E
考点二:质量守恒定律及其应用
考点讲练
题型特点:该考点常运用质量守恒定律的原理推断物质的元素组成或物质的化学式,有时也会结合图像或表格;或在密闭环境下探究或验证质量守恒定律。
1.质量守恒定律的内容:在化学反应里,____________的各物质的________,等于反应后生成的各物质的质量总和。
参加反应
质量总和
(1)适用于 “一切 ”,不适用于物理变化。
* 注意:
化学反应
(2)指“参加”反应的物质,未反应完的物质不计算在内。
考点讲练
(3)“生成的各物质的 ”,应当包括生成的所有物质,如沉淀、气体等。
(4)质量守恒定律的“守恒”指的是 ,其它方面如体积等不一定守恒。
质量总和
质量守恒
2.质量守恒定律的微观解释:物质发生化学反应时,只是原子重新组合,原子的_______和 都没有改变,因此,化学反应前后物质的总质量不变。
种类
数目
3.质量守恒定律中的六个“不变”
考点讲练
六个“不变” 两个“一定变” 三个“可能变”
宏观 ① ; ② ; ③ ; ; 元素的 ;物质的 。
微观 ① ; ② ; ③ ; 种类 .
元素的种类
元素的质量
物质的总质量
物质的种类
化合价
原子的种类
原子的数目
原子的质量
分子的
分子的数目
状态
4.质量守恒定律的应用:
·根据元素守恒,确定物质的元素组成
考点讲练
·利用质量守恒定律确定化学方程式中未知物质的化学式。
·计算化学反应中某物质的质量
5.质量守恒定律的验证实验
当有气体参加反应或有气体生成时,该反应必须在_________内进行,才能验证质量守恒定律。
密闭容器
考点讲练
【巩固训练】
7.(2022春 蓬莱市期末)下列有关质量守恒定律的认识,错误的是( )
A.质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关
B.通过化学变化,只能改变世界上物质的种类,不能改变物质的总质量
C.质量守恒定律为定量揭示化学变化的规律,提供了理论依据
D.随着科技的发展,精密仪器为我们定量研究化学变化创造了条件
A
考点讲练
8.(2021秋 临高县期末)某火力发电厂用石灰石浆来吸收二氧化硫,以防止污染环境,其反应的化学方程式为:2CaCO3+2SO2+O2=2CaSO4+2X,则X的化学式为( )
A.SO2 B.CO C.H2O D.CO2
D
9.(2021秋 梁平区期末)某物质与二氧化碳反应生成了碳酸钾和氧气。下列说法正确的是( )
A.某物质中只含有钾元素
B.某物质中一定含有钾、氧两种元素
C.某物质中只含有氧元素
D.某物质中一定含有钾元素,可能含有氧元素
D
考点讲练
10.(2022春 巨野县期末)在化学反应A+2B=C+3D中,已知2gA与4.1gB完全反应,生成5.6gC,生成D的质量是( )
A.6g B.5.6g C.4.5g D.0.5g
D
11.(2022 安徽模拟)刚装修好的房子里常含有甲醛,在催化剂的作用下,甲醛会发生如下反应。下列说法中正确的是( )
A.该反应中有三种氧化物 B.该反应属于置换反应
C.该反应生成的丙和丁的质量比为1:1 D.该反应可以有效消除甲醛
D
考点讲练
12.(2022·初三同步)如图所示,康康设计了三个实验装置来验证质量守恒定律,请回答:
(2)图甲实验设计存在的问题是 .
(3)图乙实验设计存在的问题是
.
(4)图丙实验设计的优点是 .
(1)相关反应的化学方程式为 (写1个).
Na2CO3+2HCl=2NaCl+H2O+CO2↑
产生的二氧化碳逸散到空气中,不能验证质量守恒定律
产生的二氧化碳造成锥形瓶内的压强增大,气球膨胀,产生浮力会影响实验结果
装置是密封的,测定结果准确
考点三:化学方程式
考点讲练
1.定义:用 表示 的式子叫做化学方程式。
化学反应
化学式
2.化学方程式的意义
②表示反应物、生成物之间微粒个数比。
③表示反应物和生成物质量比。
定性方面:
①表示反应物、生成物和反应条件。
定量方面:
3.化学方程式的读法:
C + O2 ==== CO2
点燃
①从物质角度:
碳和氧气在点燃的条件下反应生成二氧化碳
考点讲练
②从量的角度:
每12份质量的碳和32份质量的氧气在点燃的条件下反应生成44份质量的二氧化碳。
③从微观角度:
每一个碳原子恰好和1个氧分子完全反应生成1个二氧化碳分子
4.化学方程式的书写
①必须以科学实验的事实为根据;
(1)应遵循的原则:
②遵循质量守恒定律
(2)化学方程式的书写步骤
①根据实验事实,在左、右两边分别写出反应物和生成物的化学式,中间用“——”连接。
考点讲练
②配平化学方程式,即在有关化学式前面配上适当的系数,使反应前后各元素的原子个数相等,然后把“──”改成“──” 。
──
配平方法:
①最小公倍数法;
②奇数配偶数法:
③标明反应条件和生成物的状态。
④检查化学方程式中的化学式是否正确、有没有配平、反应条件是否遗漏、有没有漏标“↑”或“↓”。
5.根据化学方程式进行计算:
计算的步骤:
(1)设未知量
(2)写方程式
(4)列比例式
(5)求未知量
(6)回答问题
(3)找相关量,即列出跟计算
考点讲练
【巩固训练】
14.(2022 交城县期末)碳酸氢铵受热分解(NH4 HCO3 NH3↑+H2O↑+CO2↑)生成二氧化碳4.4g,同时生成氨气的质量是( )
A.7.9 g B.1.7 g C.1.8 g D.3.5 g
B
13.(2022春 沂源县期末)从化学方程式:2H2+O2 2H2O中获取的信息错误的是( )
A.在化学反应前后,原子的种类没有变化
B.氢气与氧气在点燃的条件下反应生成水
C.4g氢气与4g氧气充分反应,生成8g水
D.该反应说明水是由氢元素和氧元素组成的
C
考点讲练
15.(甘孜州 中考)下列化学方程式正确的是( )
A.Fe2O3+3H2SO4═Fe2(SO4)3+3H2O B.2Ag+Cu(NO3)2═Cu+2AgNO3 C.CuO+H2SO4═CuSO4+H2↑ D.2Fe+6HCl═2FeCl3+3H2↑
A
16.(2022春 呼兰区期末)为了测定实验室中高锰酸钾样品的纯度(杂质不参加反应),取16g该样品加热、完全反应后得到固体14.4g,则样品中高锰酸钾的质量分数为( )
A.80% B.90% C.95% D.98.75%
D
考点讲练
17.(北京 中考)二氧化氯(ClO2)是安全消毒剂,杀菌能力优于Cl2,可由NaClO2与Cl2反应制得。
(1)配平化学方程式: NaClO2+ Cl2═ ClO2+ NaCl。
(2)71g Cl2完全反应,理论上最多生成ClO2的质量为 g。
2
1
2
2
135
18.(2022 方城县模拟)能源、环境与人类的生活和社会的发展密切相关。二氧化碳不仅能灭火,有时也能助燃,若将点燃的镁条放入盛有二氧化碳的集气瓶中,镁条继续燃烧,发生置换反应,生成一种黑色单质和一种化合物,反应的化学方程式为 。
2Mg+CO2 2MgO+C
考点讲练
19.(2022·运城市期末)实验室加热高锰酸钾28.0g制取氧气,反应后剩余固体的质量为26.4g。请计算:
(1)生成氧气的质量。
(2)请判断剩余固体中有哪些物质,各有多少克?
解:(1)根据质量守恒定律可知,生成氧气的质量为28.0g﹣26.4g=1.6g;
(2)设生成MnO2的质量为x,K2MnO4的质量为y,
2KMnO4 K2MnO4+MnO2+O2↑
197 87 32
y x 1.6g
解得x=4.35g,y=9.85g,
4.35g+9.85g=14.2g<26.4g
说明高锰酸钾没有完全反应,含有高锰酸钾为26.4g﹣14.2g=12.2g
答:(1)生成氧气的质量为1.6g;(2)剩余固体中有高锰酸钾、锰酸钾和二氧化锰,质量分别为12.2g、9.85g和4.35g。
03
难点突破
难点突破
难点一 关于质量守恒定律的图像、表格问题
【难点梳理】
1.解题依据:
化学反应前后物质的总质量不变;元素的种类和质量也不变。
图像题和表格题一般在题干中不给出纯物质的质量,需要对坐标曲线和表格数据进行分析。其中图像类试题要多留意拐点对应的横坐标或纵坐标的值;表格类题型则需比较分析数据,在数据的变化规律中找出实际参加反应的物质或某生成物的纯量。
2.思路分析:
难点突破
【典型例题1】(盐城 中考)将一定质量的甲醇(CH3OH)和氧气(O2)置于密闭容器中点燃,一段时间后反应停止,冷却、测得反应后各物质的质量,相关数据如下表所示。下列说法不符合事实的是( )
物质 CH3OH O2 H2O CO2 X
反应前质量/g m 12.8 0 0 0
反应后质量/g 0 0 10.8 8.8 n
A.m>n C.无法判断X中是否含有氧元素
B.X中一定含有碳元素 D.生成物中C、H两种元素的质量比为3:1
C
难点突破
【典型例题2】(黑龙江 中考)四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示,则有关说法中不正确的是( )
A.丁一定是化合物
B.乙可能是这个反应的催化剂
C.生成的甲、丙两物质的质量比为8:1
D.参加反应的丁的质量一定等于生成甲和丙的质量之和
C
难点突破
难点二 有关微观示意图的解题思路
解微观示意图类题目的思路:
①先找到反应物和生成物,看反应前后是否有一样的微粒,若有则说明未完全反应,把反应前后一样的微粒删去;
②根据提示信息写出各微粒的化学式,反应物写在左侧,生成物在右侧,中间用“---”连接:
③配平化学方程式,标注反应条件,并把短线改为等号;
④根据化学方程式进行简单计算。
【难点梳理】
难点突破
D
12.(2022 常州)在催化剂作用下,N2和H2比反应生成NH3的微观过程示意如下:
下列说法正确的是( )
A.过程中原子种类不断发生变化
B.过程中H原子数不断减少
C.反应前后分子数未改变
D.NH3不具有N2和H2的化学性质
04
趁热打铁
趁热打铁
1.(2022 新抚区模拟)2022年世界水日的主题是“珍惜地下水、珍视隐藏的资源”。下列说法正确的是( )
A.地下水是取之不尽的淡水资源 B.煮沸可降低水的硬度
C.生活污水直接排放不会污染地下水
D.明矾用于自来水杀菌、消毒
B
2.(2022 江西模拟)宜春县级以上城市集中式饮用水水源地水质达标率为100%,自然界水净化的单一操作中,程度最高的是( )
A.静置沉淀 B.过滤 C.吸附 D.蒸馏
D
3.(2022 沈河区二模)电解水实验如图所示。下列说法正确的是( )
趁热打铁
D
A.a管收集的气体能使带火星的木条复燃
B.b玻璃管中的电极与直流电源的负极相连
C.电解时产生的H2和O2的质量比约为2:1
D.实验说明水由氢元素和氧元素组成
4.(2022 亭湖区校级二模)潜艇供氧的一种反应原理为2X+2CO2=2Na2CO3+O2,其中X的化学式是( )
A.Na B.Na2O C.Na2O2 D.NaOH
C
趁热打铁
5.(2022春 乳山市期末)3.2g某有机物在氧气中完全燃烧,生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列判断:①一定含有C、H元素 ②一定不含O元素 ③一定含有O元素 ④可能含有O元素 ⑤分子中C、H原子个数比为1:2 ⑥分子中C、H原子个数比为1:4.其中正确的是( )
A.①②③ B.①②⑥ C.①④⑤ D.①③⑥
D
趁热打铁
6.(2022春 初三同步练习)配平下列化学方程式:
2 1 2
2 2 1
1 2 1 1
3 1 2 3
4 1 3 4
趁热打铁
7.(淄博 中考)水与人类的生产生活密切相关,请回答下列问题。
(1)“宏观辨识与微观探析”是化学学科核心素养之一。从微观角度分析,地球表面的“水循环”主要由 运动引起的。目前从海水中获取淡水是解决淡水危机的一种途径,下列方法不能用于海水淡化的是 (填写字母)。
A.蒸发 B.过滤 C.膜法 D.多级闪急蒸馏法
(2)“宏观一微观一符号”相结合是化学学科的思维方式。如图实验装置是反应进行一段时间后的状态,请回答:水通电分解时没有发生变化的是 (填写序号)。
①水分子的能量 ②水分子的组成和结构 ③水的化学性质
④构成水分子的原子种类
点燃a注射器中的气体,写出反应的化学方程式 。
水分子
B
④
2H2+O2 2H2O
8.(2022·清河区模拟)在煤中加入适量的生石灰制成供居民采暖用的“环保煤”,以减少二氧化硫的排放,减弱二氧化硫对空气的污染环保煤”燃烧时生石灰吸收二氧化硫的化学方程式为:2CaO+mSO2+O2 nCaSO4.请回答下列问题:
(1)m、n的值是 ;
(2)若煤厂一次共加入含氧化钙80%的生石灰70吨,则理论上最大可吸收二氧化硫多少吨?
趁热打铁
2;2
趁热打铁
解:设理论上最大可吸收二氧化硫的质量为x
2CaO+2SO2+O2 2CaSO4
112 128
70t×80% x
x=64t
答:理论上最大可吸收二氧化硫64吨。
=
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
