第四单元 盐 化肥 复习题 2022-2023学年九年级化学人教版(五四学制)全一册(有答案)
文档属性
| 名称 | 第四单元 盐 化肥 复习题 2022-2023学年九年级化学人教版(五四学制)全一册(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 89.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-11 22:19:00 | ||
图片预览

文档简介
第四单元盐 化肥复习题2022-2023学年九年级化学人教版(五四学制)全一册
一、单选题
1.小玲家的水稻出现了倒伏现象,急需施用的化肥是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.K2SO4 D.NH4Cl
2.某同学总结的的化学性质如图,下列说法错误的是( )
A.反应①甲一定是碳酸钠
B.反应②为中和反应
C.反应③可用于检验气体
D.反应④向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
3.与氢氧化钙混合研磨能产生刺激性气味气体的化肥是( )
A.尿素[CO(NH2)2]
B.草木灰(主要成分是K2CO3)
C.氯化铵(NH4Cl)
D.磷酸钙[Ca3(PO4)2]
4.下列四种化肥样品中,分别加入熟石灰混合,研磨后能闻到刺激性气味的是( )
A.尿素 B.磷矿粉 C.氯化铵 D.硝酸钾
5.下列有关叙述对应的化学方程式,所属基本反应类型都正确的是
A.用碳酸氢钠治疗胃酸过多 复分解反应
B.细铁丝在氧气中燃烧 氧化反应
C.铝与硫酸铜溶液反应 置换反应
D.二氧化碳与澄清石灰水 中和反应
6.下列说法不正确的是( )
A.细铁丝在氧气中燃烧时,火星四射,生成黑色固体
B.红磷在空气中燃烧产生大量的白雾
C.硫在氧气中燃烧生成有刺激性气味的气体
D.少量氯化铵与少量熟石灰粉末混合、研磨,放出刺激性气味气体
7.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是
A.HNO3和FeCl3 B.NaOH和HCl
C.BaCl2和Na2SO4 D.KOH和CuSO4
8.下列各组物质在水溶液中能大量共存,且能形成无色溶液的是( )
A.CuSO4 H2SO4 B.NaNO3 KCl
C.HCl Na2CO3 D.H2SO4 Ba(NO3)2
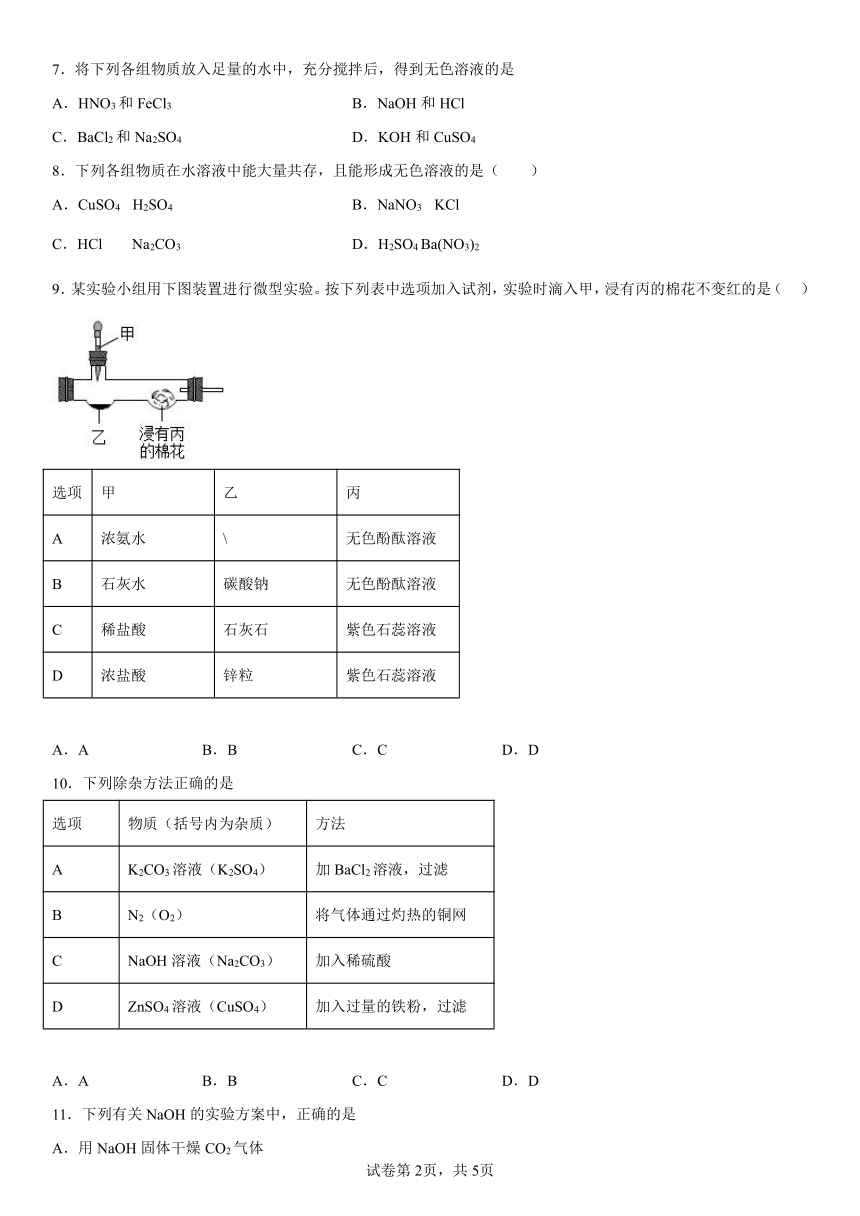
9.某实验小组用下图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 \ 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 锌粒 紫色石蕊溶液
A.A B.B C.C D.D
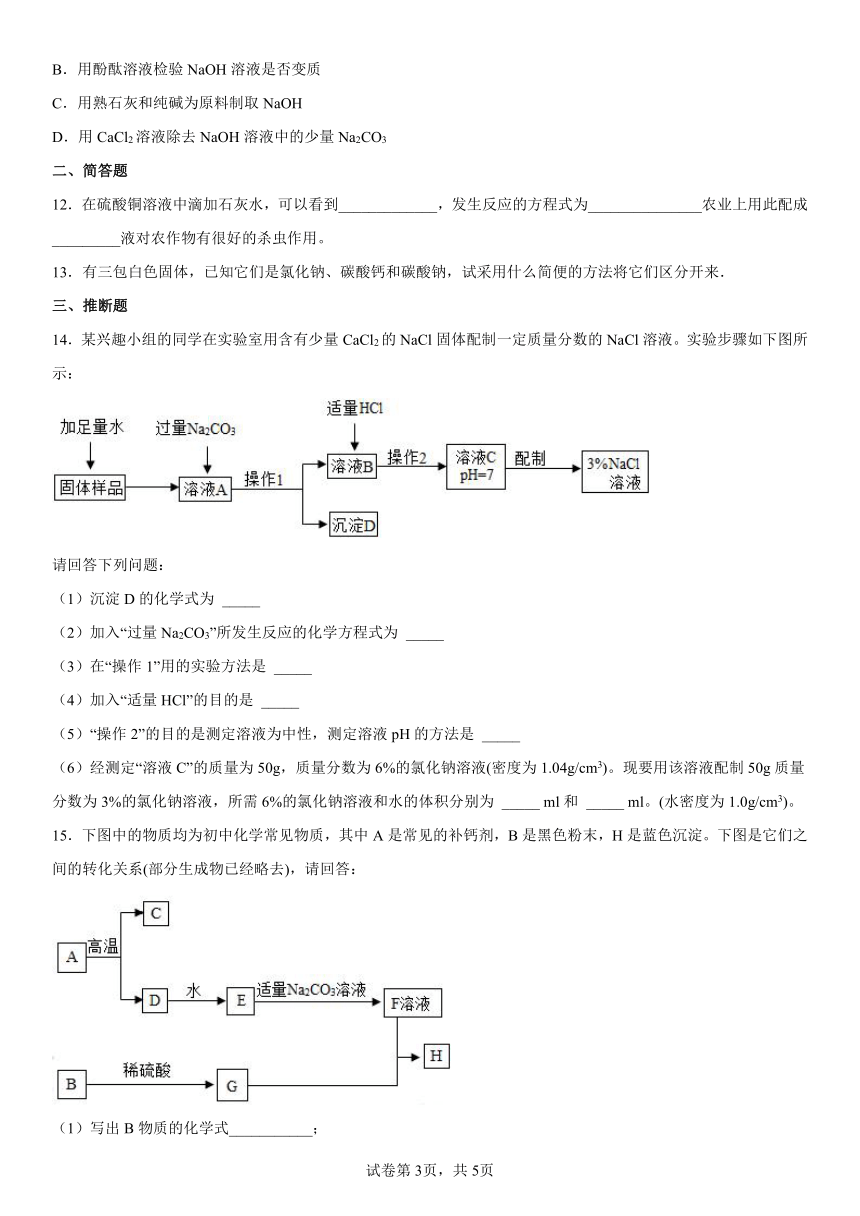
10.下列除杂方法正确的是
选项 物质(括号内为杂质) 方法
A K2CO3溶液(K2SO4) 加BaCl2溶液,过滤
B N2(O2) 将气体通过灼热的铜网
C NaOH溶液(Na2CO3) 加入稀硫酸
D ZnSO4溶液(CuSO4) 加入过量的铁粉,过滤
A.A B.B C.C D.D
11.下列有关NaOH的实验方案中,正确的是
A.用NaOH固体干燥CO2气体
B.用酚酞溶液检验NaOH溶液是否变质
C.用熟石灰和纯碱为原料制取NaOH
D.用CaCl2溶液除去NaOH溶液中的少量Na2CO3
二、简答题
12.在硫酸铜溶液中滴加石灰水,可以看到_____________,发生反应的方程式为_______________农业上用此配成_________液对农作物有很好的杀虫作用。
13.有三包白色固体,已知它们是氯化钠、碳酸钙和碳酸钠,试采用什么简便的方法将它们区分开来.
三、推断题
14.某兴趣小组的同学在实验室用含有少量CaCl2的NaCl固体配制一定质量分数的NaCl溶液。实验步骤如下图所示:
请回答下列问题:
(1)沉淀D的化学式为 _____
(2)加入“过量Na2CO3”所发生反应的化学方程式为 _____
(3)在“操作1”用的实验方法是 _____
(4)加入“适量HCl”的目的是 _____
(5)“操作2”的目的是测定溶液为中性,测定溶液pH的方法是 _____
(6)经测定“溶液C”的质量为50g,质量分数为6%的氯化钠溶液(密度为1.04g/cm3)。现要用该溶液配制50g质量分数为3%的氯化钠溶液,所需6%的氯化钠溶液和水的体积分别为 _____ ml和 _____ ml。(水密度为1.0g/cm3)。
15.下图中的物质均为初中化学常见物质,其中A是常见的补钙剂,B是黑色粉末,H是蓝色沉淀。下图是它们之间的转化关系(部分生成物已经略去),请回答:
(1)写出B物质的化学式___________;
(2)写出F+G→H的化学方程式__________________;
(3)写出物质E的用途_________________。(一种即可)
四、实验题
16.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
17.兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行如下实验。
(1)若A溶液是Ba(OH)2溶液,现象a为产生白色沉淀,现象b为溶液变红色。
①写出产生白色沉淀的化学方程式。__________
②该实验能否说明样品中含有NaOH,并说明理由。__________
(2)请你再设计一种实验方案,检验固体样品中是否含有氢氧化钠,写出实验步骤、现象及结论。______
五、计算题
18.某化学小组进行硫酸铜溶液和氢氧化钠溶液相混合的实验实验过程及数据如下图所示:[反应原理为]。
计算氢氧化钠溶液中溶质的质量分数。
19.为测定实验室中某硫酸铜样品中硫酸铜的质量分数(所含杂质溶于水,但不参与反应),进行了图所示的实验。请计算:
(1)a=______。
(2)该样品中硫酸铜的质量分数。
20.碳酸钠和碳酸氢钠的混合物共20.0克加热到到质量不再减少,冷却后称量固体质量为16.9克。(已知碳酸氢钠加热分解得到碳酸钠和两种氧化物)
(1)碳酸氢钠俗称______,常用治疗胃酸过多;
(2)求原混合物中碳酸氢钠的质量?(请写出化学方程式和必要的过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.C
4.C
5.A
6.B
7.B
8.B
9.B
10.B
11.C
12. 蓝色沉淀生成 CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4 波尔多
13.取样分别放入三支试管中加水溶解,不能溶于水的为碳酸钙,易溶于水的为氯化钠或碳酸钠,继续滴加稀盐酸,有气泡产生的为碳酸钠,否则为氯化钠.
14. CaCO3 CaCl2+Na2CO3=CaCO3↓+2NaCl 过滤 反应掉过量的Na2CO3 用玻璃棒蘸取待测液,贴上干燥的pH试纸上,再与标准比色卡对比 24.0 25.0
15. CuO 2NaOH+CuSO4= Na2SO4+Cu(OH)2↓ 改良酸性土壤(合理即可)
16. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
17. Ba(OH)2+Na2CO3 === 2NaOH+BaCO3↓ 不能,因为氢氧化钡和碳酸钠反应生成的氢氧化钠也能使无色酚酞溶液变红。 取少量无色溶液,加入足量CaCl2溶液,静置,取上层清液,向其中滴加无色酚酞溶液,若溶液变红,则样品中含有NaOH; 否则不含NaOH。(合理即可)
18.解:设参加反应的氢氧化钠质量为x。
x=4g
×100%=8%
答:氢氧化钠溶液中溶质的质量分数为8%。
19.(1)10
(2)96%
解:由题意知,硫酸铜样品中所含杂质溶于水,所以滤渣的质量为氢氧化铜的质量,
设参加反应的硫酸铜质量为x,
样品中硫酸铜的质量分数为×100%=96%;
答:样品中硫酸铜的质量分数为96%。
20.(1)小苏打(2)碳酸氢钠加热分解得到碳酸钠和两种氧化物,根据质量守恒定律可知,碳酸氢钠加热分解生成碳酸钠、水和二氧化碳,设原混合物中碳酸氢钠的质量为x,
解得x=8.4g;
答:原混合物中碳酸氢钠的质量8.4g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.小玲家的水稻出现了倒伏现象,急需施用的化肥是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.K2SO4 D.NH4Cl
2.某同学总结的的化学性质如图,下列说法错误的是( )
A.反应①甲一定是碳酸钠
B.反应②为中和反应
C.反应③可用于检验气体
D.反应④向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
3.与氢氧化钙混合研磨能产生刺激性气味气体的化肥是( )
A.尿素[CO(NH2)2]
B.草木灰(主要成分是K2CO3)
C.氯化铵(NH4Cl)
D.磷酸钙[Ca3(PO4)2]
4.下列四种化肥样品中,分别加入熟石灰混合,研磨后能闻到刺激性气味的是( )
A.尿素 B.磷矿粉 C.氯化铵 D.硝酸钾
5.下列有关叙述对应的化学方程式,所属基本反应类型都正确的是
A.用碳酸氢钠治疗胃酸过多 复分解反应
B.细铁丝在氧气中燃烧 氧化反应
C.铝与硫酸铜溶液反应 置换反应
D.二氧化碳与澄清石灰水 中和反应
6.下列说法不正确的是( )
A.细铁丝在氧气中燃烧时,火星四射,生成黑色固体
B.红磷在空气中燃烧产生大量的白雾
C.硫在氧气中燃烧生成有刺激性气味的气体
D.少量氯化铵与少量熟石灰粉末混合、研磨,放出刺激性气味气体
7.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是
A.HNO3和FeCl3 B.NaOH和HCl
C.BaCl2和Na2SO4 D.KOH和CuSO4
8.下列各组物质在水溶液中能大量共存,且能形成无色溶液的是( )
A.CuSO4 H2SO4 B.NaNO3 KCl
C.HCl Na2CO3 D.H2SO4 Ba(NO3)2
9.某实验小组用下图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 \ 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 锌粒 紫色石蕊溶液
A.A B.B C.C D.D
10.下列除杂方法正确的是
选项 物质(括号内为杂质) 方法
A K2CO3溶液(K2SO4) 加BaCl2溶液,过滤
B N2(O2) 将气体通过灼热的铜网
C NaOH溶液(Na2CO3) 加入稀硫酸
D ZnSO4溶液(CuSO4) 加入过量的铁粉,过滤
A.A B.B C.C D.D
11.下列有关NaOH的实验方案中,正确的是
A.用NaOH固体干燥CO2气体
B.用酚酞溶液检验NaOH溶液是否变质
C.用熟石灰和纯碱为原料制取NaOH
D.用CaCl2溶液除去NaOH溶液中的少量Na2CO3
二、简答题
12.在硫酸铜溶液中滴加石灰水,可以看到_____________,发生反应的方程式为_______________农业上用此配成_________液对农作物有很好的杀虫作用。
13.有三包白色固体,已知它们是氯化钠、碳酸钙和碳酸钠,试采用什么简便的方法将它们区分开来.
三、推断题
14.某兴趣小组的同学在实验室用含有少量CaCl2的NaCl固体配制一定质量分数的NaCl溶液。实验步骤如下图所示:
请回答下列问题:
(1)沉淀D的化学式为 _____
(2)加入“过量Na2CO3”所发生反应的化学方程式为 _____
(3)在“操作1”用的实验方法是 _____
(4)加入“适量HCl”的目的是 _____
(5)“操作2”的目的是测定溶液为中性,测定溶液pH的方法是 _____
(6)经测定“溶液C”的质量为50g,质量分数为6%的氯化钠溶液(密度为1.04g/cm3)。现要用该溶液配制50g质量分数为3%的氯化钠溶液,所需6%的氯化钠溶液和水的体积分别为 _____ ml和 _____ ml。(水密度为1.0g/cm3)。
15.下图中的物质均为初中化学常见物质,其中A是常见的补钙剂,B是黑色粉末,H是蓝色沉淀。下图是它们之间的转化关系(部分生成物已经略去),请回答:
(1)写出B物质的化学式___________;
(2)写出F+G→H的化学方程式__________________;
(3)写出物质E的用途_________________。(一种即可)
四、实验题
16.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
17.兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行如下实验。
(1)若A溶液是Ba(OH)2溶液,现象a为产生白色沉淀,现象b为溶液变红色。
①写出产生白色沉淀的化学方程式。__________
②该实验能否说明样品中含有NaOH,并说明理由。__________
(2)请你再设计一种实验方案,检验固体样品中是否含有氢氧化钠,写出实验步骤、现象及结论。______
五、计算题
18.某化学小组进行硫酸铜溶液和氢氧化钠溶液相混合的实验实验过程及数据如下图所示:[反应原理为]。
计算氢氧化钠溶液中溶质的质量分数。
19.为测定实验室中某硫酸铜样品中硫酸铜的质量分数(所含杂质溶于水,但不参与反应),进行了图所示的实验。请计算:
(1)a=______。
(2)该样品中硫酸铜的质量分数。
20.碳酸钠和碳酸氢钠的混合物共20.0克加热到到质量不再减少,冷却后称量固体质量为16.9克。(已知碳酸氢钠加热分解得到碳酸钠和两种氧化物)
(1)碳酸氢钠俗称______,常用治疗胃酸过多;
(2)求原混合物中碳酸氢钠的质量?(请写出化学方程式和必要的过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.C
4.C
5.A
6.B
7.B
8.B
9.B
10.B
11.C
12. 蓝色沉淀生成 CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4 波尔多
13.取样分别放入三支试管中加水溶解,不能溶于水的为碳酸钙,易溶于水的为氯化钠或碳酸钠,继续滴加稀盐酸,有气泡产生的为碳酸钠,否则为氯化钠.
14. CaCO3 CaCl2+Na2CO3=CaCO3↓+2NaCl 过滤 反应掉过量的Na2CO3 用玻璃棒蘸取待测液,贴上干燥的pH试纸上,再与标准比色卡对比 24.0 25.0
15. CuO 2NaOH+CuSO4= Na2SO4+Cu(OH)2↓ 改良酸性土壤(合理即可)
16. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
17. Ba(OH)2+Na2CO3 === 2NaOH+BaCO3↓ 不能,因为氢氧化钡和碳酸钠反应生成的氢氧化钠也能使无色酚酞溶液变红。 取少量无色溶液,加入足量CaCl2溶液,静置,取上层清液,向其中滴加无色酚酞溶液,若溶液变红,则样品中含有NaOH; 否则不含NaOH。(合理即可)
18.解:设参加反应的氢氧化钠质量为x。
x=4g
×100%=8%
答:氢氧化钠溶液中溶质的质量分数为8%。
19.(1)10
(2)96%
解:由题意知,硫酸铜样品中所含杂质溶于水,所以滤渣的质量为氢氧化铜的质量,
设参加反应的硫酸铜质量为x,
样品中硫酸铜的质量分数为×100%=96%;
答:样品中硫酸铜的质量分数为96%。
20.(1)小苏打(2)碳酸氢钠加热分解得到碳酸钠和两种氧化物,根据质量守恒定律可知,碳酸氢钠加热分解生成碳酸钠、水和二氧化碳,设原混合物中碳酸氢钠的质量为x,
解得x=8.4g;
答:原混合物中碳酸氢钠的质量8.4g。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
