1.2 反应热的计算 第1课时 盖斯定律 课件(共14张PPT) 2022-2023学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.2 反应热的计算 第1课时 盖斯定律 课件(共14张PPT) 2022-2023学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 801.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 00:00:00 | ||
图片预览





文档简介
(共14张PPT)
盖斯定律
1.2:反应热的计算
天然气燃烧
完全燃烧
不完全燃烧
点燃
点燃
甲烷完全燃烧和不完全燃烧,其反应热之差有多大呢?
能否定量测定呢?
天然气燃烧
完全燃烧
不完全燃烧
点燃
点燃
一个化学反应,不管是一步完成的还是分几步完成,其反应热是相同的。
盖斯定律
盖斯
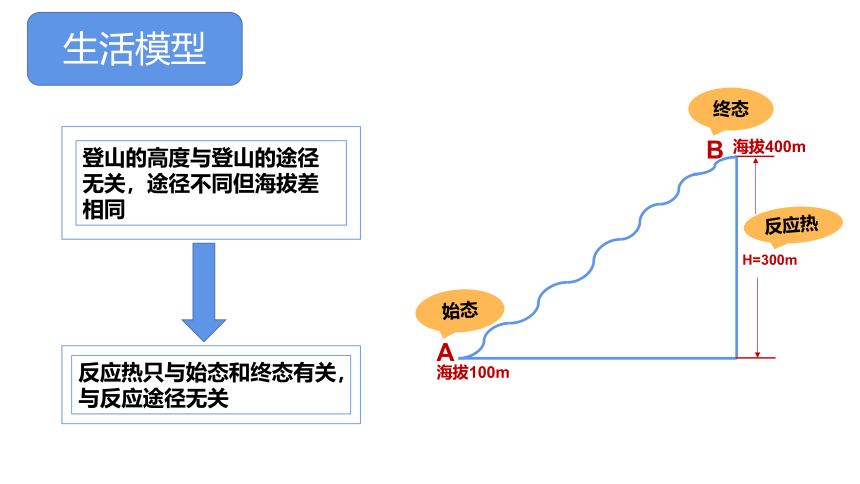
生活模型
A
B
海拔100m
H=300m
海拔400m
登山的高度与登山的途径无关,途径不同但海拔差相同
反应热只与始态和终态有关,与反应途径无关
始态
终态
反应热
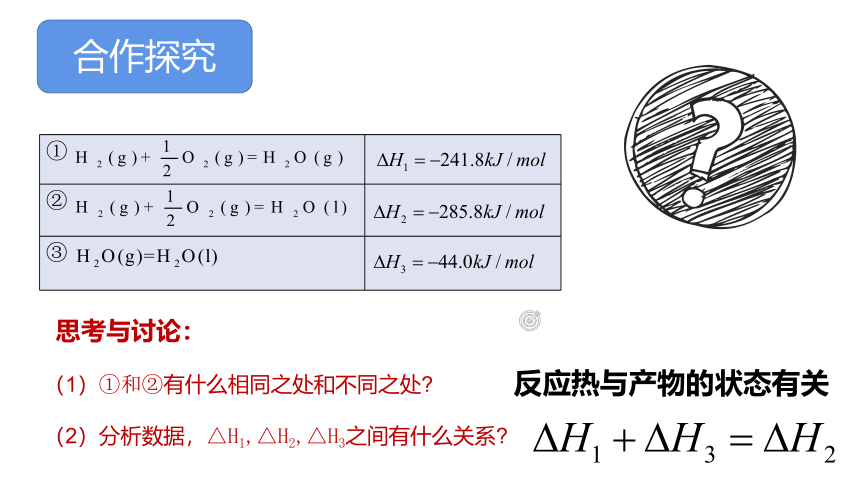
合作探究
①
②
③
思考与讨论:
(1)①和②有什么相同之处和不同之处
(2)分析数据,△H1,△H2,△H3之间有什么关系
反应热与产物的状态有关
合作探究
热化学方程式可以像代数式一样进行加减运算
①+③=②
始态
终态
化学模型
设计途径,由已知反应的反应热计算未知反应的反应热
应用
已知:
求:
天然气燃烧
完全燃烧
不完全燃烧
点燃
点燃
尝试应用盖斯定律解决甲烷不完全燃烧生成CO的反应热问题
应用
请尝试利用盖斯定律设计合理的“路径”计算甲烷不完全燃烧生成CO的反应热
?
已知
应用
小结
盖斯定律的计算要注意:
①确定待求的反应方程式;
②找出待求方程式中各物质出现在已知方程式的什么位置;
③根据未知方程式中各物质计量数和位置的需要对已知方程式进行处理,或调整计量数,或调整反应方向;
④实施叠加并检验上述分析的正确与否。
盖斯定律
1.2:反应热的计算
天然气燃烧
完全燃烧
不完全燃烧
点燃
点燃
甲烷完全燃烧和不完全燃烧,其反应热之差有多大呢?
能否定量测定呢?
天然气燃烧
完全燃烧
不完全燃烧
点燃
点燃
一个化学反应,不管是一步完成的还是分几步完成,其反应热是相同的。
盖斯定律
盖斯
生活模型
A
B
海拔100m
H=300m
海拔400m
登山的高度与登山的途径无关,途径不同但海拔差相同
反应热只与始态和终态有关,与反应途径无关
始态
终态
反应热
合作探究
①
②
③
思考与讨论:
(1)①和②有什么相同之处和不同之处
(2)分析数据,△H1,△H2,△H3之间有什么关系
反应热与产物的状态有关
合作探究
热化学方程式可以像代数式一样进行加减运算
①+③=②
始态
终态
化学模型
设计途径,由已知反应的反应热计算未知反应的反应热
应用
已知:
求:
天然气燃烧
完全燃烧
不完全燃烧
点燃
点燃
尝试应用盖斯定律解决甲烷不完全燃烧生成CO的反应热问题
应用
请尝试利用盖斯定律设计合理的“路径”计算甲烷不完全燃烧生成CO的反应热
?
已知
应用
小结
盖斯定律的计算要注意:
①确定待求的反应方程式;
②找出待求方程式中各物质出现在已知方程式的什么位置;
③根据未知方程式中各物质计量数和位置的需要对已知方程式进行处理,或调整计量数,或调整反应方向;
④实施叠加并检验上述分析的正确与否。
