2.2.3氯离子的检验 课件 2022-2023学年高一上学期化学人教版(2019)必修第一册(15张ppt)
文档属性
| 名称 | 2.2.3氯离子的检验 课件 2022-2023学年高一上学期化学人教版(2019)必修第一册(15张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-12 15:21:16 | ||
图片预览




文档简介
(共15张PPT)
第二章 海水中的重要元素—钠和氯
第二节 氯及其化合物
第Ⅳ课时 氯离子的检验
掌握Cl-、Br-、I-三种卤素离子的检验方法;
掌握常见物质检验、分离和提纯的方法;
掌握常见离子的检验。
1. 如何检验溶液中的氯离子?
2. 常见物质检验、分离和提纯的方法有哪些?
3. 常见离子的检验方法有哪些?
HCl
NaCl
Na2CO3
AgNO3溶液
AgNO3溶液
AgNO3溶液
HNO3溶液
HNO3溶液
HNO3溶液
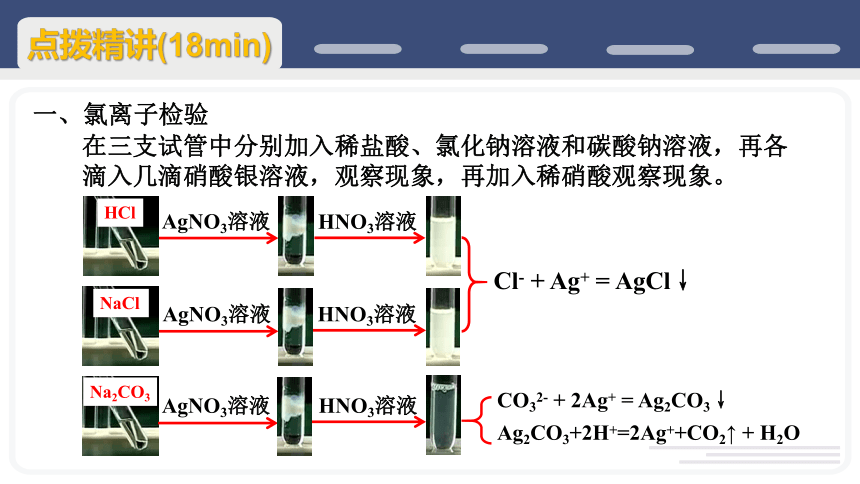
Cl- + Ag+ = AgCl↓
CO32- + 2Ag+ = Ag2CO3↓
Ag2CO3+2H+=2Ag++CO2↑ + H2O
在三支试管中分别加入稀盐酸、氯化钠溶液和碳酸钠溶液,再各滴入几滴硝酸银溶液,观察现象,再加入稀硝酸观察现象。
一、氯离子检验
AgNO3溶液
稀硝酸
白色沉淀
不溶解
氯离子检验:取少量待测液于试管中,加入硝酸酸化的硝酸银溶液,若产生白色沉淀,证明原溶液中含有Cl-。
加入稀HNO3:
排除生成Ag2CO3影响结果
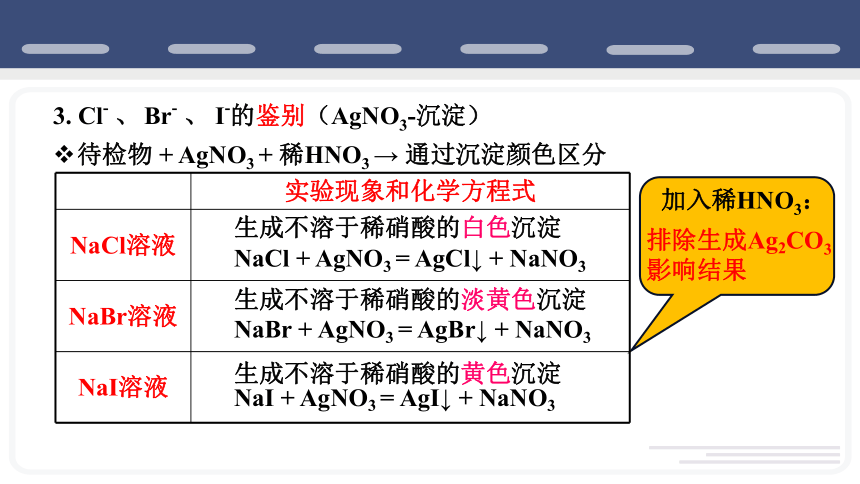
3. Cl- 、 Br- 、 I-的鉴别(AgNO3-沉淀)
待检物 + AgNO3 + 稀HNO3 → 通过沉淀颜色区分
实验现象和化学方程式
NaCl溶液
NaBr溶液
NaI溶液
生成不溶于稀硝酸的白色沉淀
生成不溶于稀硝酸的淡黄色沉淀
生成不溶于稀硝酸的黄色沉淀
NaCl + AgNO3 = AgCl↓ + NaNO3
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓ + NaNO3
例1:有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:①溶于水,得无色溶液;②在所得溶液中滴入AgNO3溶液,生成白色沉淀(注:Ag2CO3为白色沉淀);③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡产生。
根据上述现象判断:
(1)白色固体一定含有的成分是_______________,可能含有的成分是___________。
(2)请写出上述实验中有关反应的离子方程式:
_________________________________________________________
_________________________________________________________
KCl、K2CO3
KNO3
Ag+ + Cl- == AgCl↓
2Ag+ + CO32- == Ag2CO3↓
Ag2CO3 + 2H+ == 2Ag+ + H2O + CO2
二、鉴别物质的四种常见方法
(1)溶解法:如BaCO3和Na2CO3。
(2)加试剂法:如用Ba(NO3)2可鉴别(NH4)2SO4和NH4Cl。
(3)顺序滴加法:如鉴别Na2CO3与盐酸、
(4)两两混合法:如鉴别Na2CO3、HCl、NaCl、Ba(NO3)2四种溶液。
(1)常见阴离子的检验
①利用酸碱指示剂检验
三、物质的检验
②利用盐酸和其他试剂检验
(2)常见阳离子的检验
H+→滴入紫色石蕊试液,溶液变红色
例2:有一瓶溶液,可能含Na+、Ba2+、H+、Cl-、CO32-、SO42-、OH-中的几种,现进行如下实验:①取试样溶液加入试管中,滴入过量BaCl2溶液,有白色沉淀产生,过滤;②在滤液中滴入酚酞试液,溶液呈红色;③在沉淀中加入稀硝酸,白色沉淀全部溶解,并产生气泡。
(1)溶液中一定含有的离子是__________________;一定没有的离子是__________________。
(2)步骤③沉淀溶解离子方程式:_______________________________。
(3)该溶液中可能含有的离子是_____。证明溶液中是否含有该离子:另取试样溶液,为排除溶液中的____________离子对实验的干扰,先加入足量的________,再滴入________溶液,若有现象:_________产生,证明溶液中含有该离子;否则证明溶液中不含有该离子。
Na+、CO32-、OH-
Ba2+、H+、SO42-
BaCO3 + 2H+ == Ba2+ + H2O + CO2↑
Cl-
OH-和CO32-
稀硝酸
AgNO3
白色沉淀
1. Cl-、Br-、I-三种卤素离子的检验方法
2.常见物质检验、分离和提纯的方法
3.常见离子的检验
1. 自来水厂常用氯气对生活用水进行杀菌消毒。市场上有些不法商贩为牟取暴利,用这样的自来水冒充纯净水(离子浓度非常低)出售,给人们的生活造成了一定的不良影响。在下列化学试剂中,可以用于鉴别这种自来水和纯净水的是
A. 酚酞溶液 B. 氯化钡溶液
C. 氢氧化钠溶液 D. 硝酸银溶液
2. 能证明某溶液中含有NaCl的是
A. 焰色试验是黄色 B. 溶液有咸味
C. 取少量溶液于试管,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D. 焰色试验是黄色,又能与硝酸酸化的硝酸银溶液反应生成白色沉淀
4. 溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:
IBr+H2O=HBr+HIO,下列有关IBr的叙述中,不正确的是
A. 在很多反应中IBr是强氧化剂
B. IBr与水反应时既作氧化剂,又作还原剂
C. IBr与AgNO3溶液反应会生成AgBr沉淀
D. IBr与NaOH溶液反应时,生成NaBr和NaIO
3. 方志敏烈士生前在狱中曾用米汤(内含淀粉)给鲁迅先生写信,鲁迅先生收到后,为了看清信中的内容,使用的化学试剂是
A. 碘化钾 B. 碘酒 C. 溴水 D. 碘化钾淀粉试液
【答案】DDBB
Thank you!
第二章 海水中的重要元素—钠和氯
第二节 氯及其化合物
第Ⅳ课时 氯离子的检验
掌握Cl-、Br-、I-三种卤素离子的检验方法;
掌握常见物质检验、分离和提纯的方法;
掌握常见离子的检验。
1. 如何检验溶液中的氯离子?
2. 常见物质检验、分离和提纯的方法有哪些?
3. 常见离子的检验方法有哪些?
HCl
NaCl
Na2CO3
AgNO3溶液
AgNO3溶液
AgNO3溶液
HNO3溶液
HNO3溶液
HNO3溶液
Cl- + Ag+ = AgCl↓
CO32- + 2Ag+ = Ag2CO3↓
Ag2CO3+2H+=2Ag++CO2↑ + H2O
在三支试管中分别加入稀盐酸、氯化钠溶液和碳酸钠溶液,再各滴入几滴硝酸银溶液,观察现象,再加入稀硝酸观察现象。
一、氯离子检验
AgNO3溶液
稀硝酸
白色沉淀
不溶解
氯离子检验:取少量待测液于试管中,加入硝酸酸化的硝酸银溶液,若产生白色沉淀,证明原溶液中含有Cl-。
加入稀HNO3:
排除生成Ag2CO3影响结果
3. Cl- 、 Br- 、 I-的鉴别(AgNO3-沉淀)
待检物 + AgNO3 + 稀HNO3 → 通过沉淀颜色区分
实验现象和化学方程式
NaCl溶液
NaBr溶液
NaI溶液
生成不溶于稀硝酸的白色沉淀
生成不溶于稀硝酸的淡黄色沉淀
生成不溶于稀硝酸的黄色沉淀
NaCl + AgNO3 = AgCl↓ + NaNO3
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓ + NaNO3
例1:有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:①溶于水,得无色溶液;②在所得溶液中滴入AgNO3溶液,生成白色沉淀(注:Ag2CO3为白色沉淀);③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡产生。
根据上述现象判断:
(1)白色固体一定含有的成分是_______________,可能含有的成分是___________。
(2)请写出上述实验中有关反应的离子方程式:
_________________________________________________________
_________________________________________________________
KCl、K2CO3
KNO3
Ag+ + Cl- == AgCl↓
2Ag+ + CO32- == Ag2CO3↓
Ag2CO3 + 2H+ == 2Ag+ + H2O + CO2
二、鉴别物质的四种常见方法
(1)溶解法:如BaCO3和Na2CO3。
(2)加试剂法:如用Ba(NO3)2可鉴别(NH4)2SO4和NH4Cl。
(3)顺序滴加法:如鉴别Na2CO3与盐酸、
(4)两两混合法:如鉴别Na2CO3、HCl、NaCl、Ba(NO3)2四种溶液。
(1)常见阴离子的检验
①利用酸碱指示剂检验
三、物质的检验
②利用盐酸和其他试剂检验
(2)常见阳离子的检验
H+→滴入紫色石蕊试液,溶液变红色
例2:有一瓶溶液,可能含Na+、Ba2+、H+、Cl-、CO32-、SO42-、OH-中的几种,现进行如下实验:①取试样溶液加入试管中,滴入过量BaCl2溶液,有白色沉淀产生,过滤;②在滤液中滴入酚酞试液,溶液呈红色;③在沉淀中加入稀硝酸,白色沉淀全部溶解,并产生气泡。
(1)溶液中一定含有的离子是__________________;一定没有的离子是__________________。
(2)步骤③沉淀溶解离子方程式:_______________________________。
(3)该溶液中可能含有的离子是_____。证明溶液中是否含有该离子:另取试样溶液,为排除溶液中的____________离子对实验的干扰,先加入足量的________,再滴入________溶液,若有现象:_________产生,证明溶液中含有该离子;否则证明溶液中不含有该离子。
Na+、CO32-、OH-
Ba2+、H+、SO42-
BaCO3 + 2H+ == Ba2+ + H2O + CO2↑
Cl-
OH-和CO32-
稀硝酸
AgNO3
白色沉淀
1. Cl-、Br-、I-三种卤素离子的检验方法
2.常见物质检验、分离和提纯的方法
3.常见离子的检验
1. 自来水厂常用氯气对生活用水进行杀菌消毒。市场上有些不法商贩为牟取暴利,用这样的自来水冒充纯净水(离子浓度非常低)出售,给人们的生活造成了一定的不良影响。在下列化学试剂中,可以用于鉴别这种自来水和纯净水的是
A. 酚酞溶液 B. 氯化钡溶液
C. 氢氧化钠溶液 D. 硝酸银溶液
2. 能证明某溶液中含有NaCl的是
A. 焰色试验是黄色 B. 溶液有咸味
C. 取少量溶液于试管,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D. 焰色试验是黄色,又能与硝酸酸化的硝酸银溶液反应生成白色沉淀
4. 溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:
IBr+H2O=HBr+HIO,下列有关IBr的叙述中,不正确的是
A. 在很多反应中IBr是强氧化剂
B. IBr与水反应时既作氧化剂,又作还原剂
C. IBr与AgNO3溶液反应会生成AgBr沉淀
D. IBr与NaOH溶液反应时,生成NaBr和NaIO
3. 方志敏烈士生前在狱中曾用米汤(内含淀粉)给鲁迅先生写信,鲁迅先生收到后,为了看清信中的内容,使用的化学试剂是
A. 碘化钾 B. 碘酒 C. 溴水 D. 碘化钾淀粉试液
【答案】DDBB
Thank you!
