化学人教版(2019)选择性必修1 3.4.1难溶电解质的沉淀溶解平衡(共16张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.4.1难溶电解质的沉淀溶解平衡(共16张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 389.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-12 15:43:59 | ||
图片预览





文档简介
(共16张PPT)
DIYIKESHI
难溶电解质的沉淀溶解平衡 / 溶度积常数 / 课时对点练
难溶电解质的沉淀溶解平衡
第三章
第1课时
1.能描述沉淀溶解平衡,知道溶解平衡的特征。
2.根据化学平衡理论,分析影响沉淀溶解平衡的因素。
3.了解离子积与Ksp的相对大小跟沉淀溶解平衡的关系。
课程目标
25 ℃时,溶解性与溶解度的关系
溶解性 易溶 可溶 微溶 难溶
溶解度 >10 g 1~10 g 0.01~1 g <_______
0.01 g
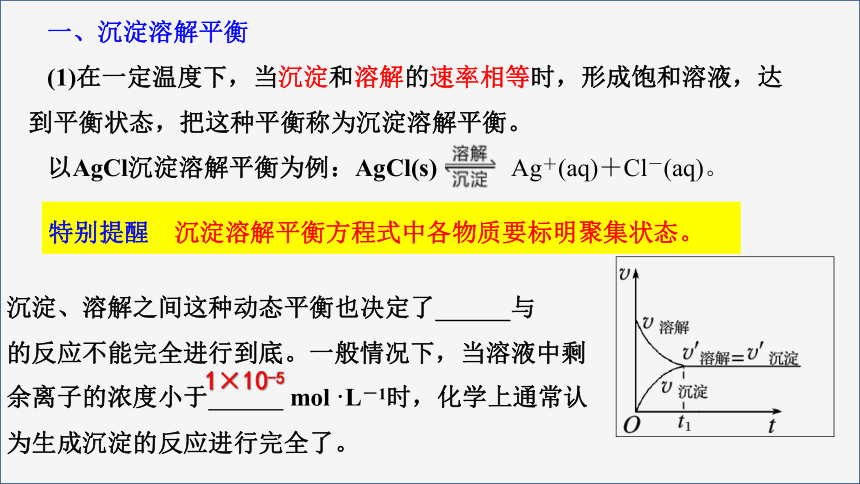
一、沉淀溶解平衡
(1)在一定温度下,当沉淀和溶解的速率相等时,形成饱和溶液,达到平衡状态,把这种平衡称为沉淀溶解平衡。
以AgCl沉淀溶解平衡为例:AgCl(s) Ag+(aq)+Cl-(aq)。
沉淀、溶解之间这种动态平衡也决定了 与 的反应不能完全进行到底。一般情况下,当溶液中剩余离子的浓度小于 mol·L-1时,化学上通常认为生成沉淀的反应进行完全了。
特别提醒 沉淀溶解平衡方程式中各物质要标明聚集状态。
1×10-5
(2)沉淀溶解平衡的特征
不等于0
相等
保持不变
发生移动
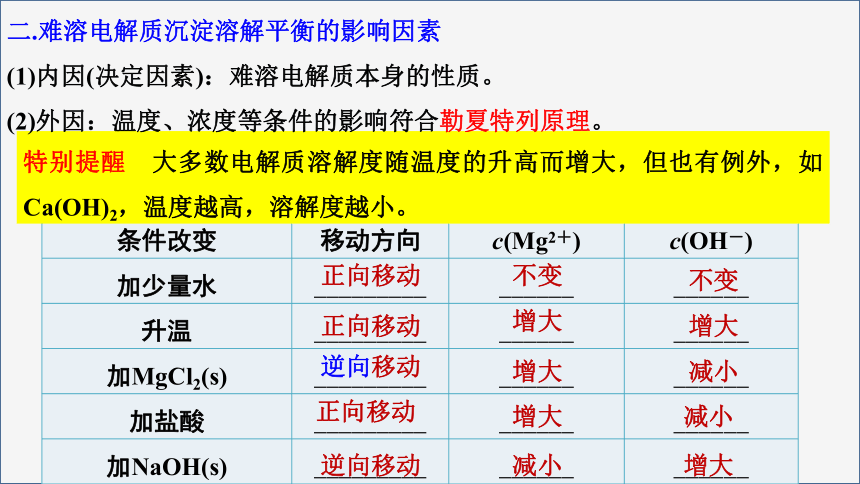
条件改变 移动方向 c(Mg2+) c(OH-)
加少量水 _________ ______ ______
升温 _________ ______ ______
加MgCl2(s) _________ ______ ______
加盐酸 _________ ______ ______
加NaOH(s) _________ ______ ______
正向移动
不变
不变
正向移动
增大
增大
逆向移动
增大
减小
正向移动
增大
减小
逆向移动
减小
增大
特别提醒 大多数电解质溶解度随温度的升高而增大,但也有例外,如Ca(OH)2,温度越高,溶解度越小。
二.难溶电解质沉淀溶解平衡的影响因素
(1)内因(决定因素):难溶电解质本身的性质。
(2)外因:温度、浓度等条件的影响符合勒夏特列原理。
(1)难溶电解质的沉淀溶解平衡是动态平衡,即溶解和沉淀仍然同时进行着,只是v溶解=v沉淀( )
正误判断
(3)当溶液中某离子浓度小于1×10-5 mol·L-1时,可视为该离子沉淀完全
( )
√
√
√
深度思考
应用体验
A.AgCl沉淀的生成和溶解同时在不断进行,且速率相等
B.等物质的量的AgNO3和NaCl溶于水后,溶液中不存在Ag+和Cl-
C.只要向含有AgCl的饱和溶液中加入盐酸,一定会有沉淀生成
√
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
√
Ksp=_______________。
cm(An+)·cn(Bm-)
1.概念
难溶电解质的沉淀溶解平衡也存在__________,称为___________,简称溶度积,符号为____。
平衡常数
溶度积常数
Ksp
溶度积常数
3.影响因素 溶度积Ksp只与___________的性质和_____有关。
难溶电解质
温度
一般温度升高,Ksp增大,但Ca(OH)2相反
4.Ksp的意义
反映了难溶电解质在水中的溶解能力。
(1)对于阴、阳离子个数比相同的难溶电解质,Ksp越大,说明难溶电解质在水中的溶解能力越大。
如:Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI),则溶解度:S (AgCl) > S (AgBr) > S (AgI)。
(2)对于阴、阳离子个数比不同的电解质,Ksp小的电解质的溶解度不一定比Ksp大的溶解度小,如Ksp(Ag2CrO4)5.应用
定量判断给定条件下有无沉淀生成。
(1)Q>Ksp,溶液过饱和,有_____析出,直至溶液______,达到新的平衡。
(2)Q=Ksp,溶液饱和,沉淀与溶解处于_________。
(3)Q沉淀
饱和
平衡状态
沉淀
溶解
饱和
正误判断
(1)溶度积是沉淀溶解平衡时难溶电解质在溶液中的各离子浓度的乘积( )
(2)溶度积受离子浓度大小的影响( )
(3)Ksp小的难溶电解质的溶解度一定小于Ksp大的难溶电解质的溶解度( )
(4)改变外界条件使沉淀溶解平衡正向移动,Ksp一定增大( )
(5)可利用溶液混合后的Q与Ksp的相对大小来判断溶液混合后是否有沉淀生成( )
×
√
×
×
×
深度思考
请思考下列问题:
(1)25 ℃时AgCl(s)、AgBr(s)、AgI(s)溶于水形成的饱和溶液中,c(Ag+)大小关系能否直接判断?三种物质的溶解能力由大到小排序如何?
提示 能。溶解能力由大到小:AgCl>AgBr>AgI。
化学式 Ksp
AgCl 1.8×10-10
AgBr 5.4×10-13
AgI 8.5×10-17
深度思考
(2)AgCl、Mg(OH)2哪个更难溶?
提示 Ksp(AgCl)=c(Ag+)·c(Cl-)=c2(Ag+)=1.8×10-10,c(Ag+)≈1.34×
10-5 mol·L-1,即AgCl的溶解浓度为1.34×10-5 mol·L-1;
Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)=4c3(Mg2+)=5.6×10-12,
c(Mg2+)≈1.12×10-4 mol·L-1,即Mg(OH)2的溶解浓度为1.12×10-4 mol·L-1,则AgCl更难溶。
化学式 Ksp
AgCl 1.8×10-10
Mg(OH)2 5.6×10-12
DIYIKESHI
难溶电解质的沉淀溶解平衡 / 溶度积常数 / 课时对点练
难溶电解质的沉淀溶解平衡
第三章
第1课时
1.能描述沉淀溶解平衡,知道溶解平衡的特征。
2.根据化学平衡理论,分析影响沉淀溶解平衡的因素。
3.了解离子积与Ksp的相对大小跟沉淀溶解平衡的关系。
课程目标
25 ℃时,溶解性与溶解度的关系
溶解性 易溶 可溶 微溶 难溶
溶解度 >10 g 1~10 g 0.01~1 g <_______
0.01 g
一、沉淀溶解平衡
(1)在一定温度下,当沉淀和溶解的速率相等时,形成饱和溶液,达到平衡状态,把这种平衡称为沉淀溶解平衡。
以AgCl沉淀溶解平衡为例:AgCl(s) Ag+(aq)+Cl-(aq)。
沉淀、溶解之间这种动态平衡也决定了 与 的反应不能完全进行到底。一般情况下,当溶液中剩余离子的浓度小于 mol·L-1时,化学上通常认为生成沉淀的反应进行完全了。
特别提醒 沉淀溶解平衡方程式中各物质要标明聚集状态。
1×10-5
(2)沉淀溶解平衡的特征
不等于0
相等
保持不变
发生移动
条件改变 移动方向 c(Mg2+) c(OH-)
加少量水 _________ ______ ______
升温 _________ ______ ______
加MgCl2(s) _________ ______ ______
加盐酸 _________ ______ ______
加NaOH(s) _________ ______ ______
正向移动
不变
不变
正向移动
增大
增大
逆向移动
增大
减小
正向移动
增大
减小
逆向移动
减小
增大
特别提醒 大多数电解质溶解度随温度的升高而增大,但也有例外,如Ca(OH)2,温度越高,溶解度越小。
二.难溶电解质沉淀溶解平衡的影响因素
(1)内因(决定因素):难溶电解质本身的性质。
(2)外因:温度、浓度等条件的影响符合勒夏特列原理。
(1)难溶电解质的沉淀溶解平衡是动态平衡,即溶解和沉淀仍然同时进行着,只是v溶解=v沉淀( )
正误判断
(3)当溶液中某离子浓度小于1×10-5 mol·L-1时,可视为该离子沉淀完全
( )
√
√
√
深度思考
应用体验
A.AgCl沉淀的生成和溶解同时在不断进行,且速率相等
B.等物质的量的AgNO3和NaCl溶于水后,溶液中不存在Ag+和Cl-
C.只要向含有AgCl的饱和溶液中加入盐酸,一定会有沉淀生成
√
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
√
Ksp=_______________。
cm(An+)·cn(Bm-)
1.概念
难溶电解质的沉淀溶解平衡也存在__________,称为___________,简称溶度积,符号为____。
平衡常数
溶度积常数
Ksp
溶度积常数
3.影响因素 溶度积Ksp只与___________的性质和_____有关。
难溶电解质
温度
一般温度升高,Ksp增大,但Ca(OH)2相反
4.Ksp的意义
反映了难溶电解质在水中的溶解能力。
(1)对于阴、阳离子个数比相同的难溶电解质,Ksp越大,说明难溶电解质在水中的溶解能力越大。
如:Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI),则溶解度:S (AgCl) > S (AgBr) > S (AgI)。
(2)对于阴、阳离子个数比不同的电解质,Ksp小的电解质的溶解度不一定比Ksp大的溶解度小,如Ksp(Ag2CrO4)
定量判断给定条件下有无沉淀生成。
(1)Q>Ksp,溶液过饱和,有_____析出,直至溶液______,达到新的平衡。
(2)Q=Ksp,溶液饱和,沉淀与溶解处于_________。
(3)Q
饱和
平衡状态
沉淀
溶解
饱和
正误判断
(1)溶度积是沉淀溶解平衡时难溶电解质在溶液中的各离子浓度的乘积( )
(2)溶度积受离子浓度大小的影响( )
(3)Ksp小的难溶电解质的溶解度一定小于Ksp大的难溶电解质的溶解度( )
(4)改变外界条件使沉淀溶解平衡正向移动,Ksp一定增大( )
(5)可利用溶液混合后的Q与Ksp的相对大小来判断溶液混合后是否有沉淀生成( )
×
√
×
×
×
深度思考
请思考下列问题:
(1)25 ℃时AgCl(s)、AgBr(s)、AgI(s)溶于水形成的饱和溶液中,c(Ag+)大小关系能否直接判断?三种物质的溶解能力由大到小排序如何?
提示 能。溶解能力由大到小:AgCl>AgBr>AgI。
化学式 Ksp
AgCl 1.8×10-10
AgBr 5.4×10-13
AgI 8.5×10-17
深度思考
(2)AgCl、Mg(OH)2哪个更难溶?
提示 Ksp(AgCl)=c(Ag+)·c(Cl-)=c2(Ag+)=1.8×10-10,c(Ag+)≈1.34×
10-5 mol·L-1,即AgCl的溶解浓度为1.34×10-5 mol·L-1;
Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)=4c3(Mg2+)=5.6×10-12,
c(Mg2+)≈1.12×10-4 mol·L-1,即Mg(OH)2的溶解浓度为1.12×10-4 mol·L-1,则AgCl更难溶。
化学式 Ksp
AgCl 1.8×10-10
Mg(OH)2 5.6×10-12
