第6章常用的金属和盐同步练习2022-2023学年九年级化学沪教版(上海)第二学期(有答案)
文档属性
| 名称 | 第6章常用的金属和盐同步练习2022-2023学年九年级化学沪教版(上海)第二学期(有答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 274.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-12 13:41:24 | ||
图片预览


文档简介
第6章常用的金属和盐同步练习2022-2023学年九年级化学沪教版(上海)第二学期
一、单选题
1.下列物质中,属于合金的是
A.不锈钢 B.氧化铁 C.铜 D.石墨
2.生活中遇到的问题,常常涉及化学知识。下列说法不正确的是
A.“绿色食品”、“白色污染”、“赤潮” 主要都不是在说颜色
B.生活污水、农药和难分解的有机物等会造成水体污染
C.约占空气体积21%的氧气能支持燃烧,说明氧气是一种高能燃料
D.许多合金比组成合金的纯金属强度和硬度更高、抗腐蚀性能更好
3.从《中国成语大会》到《中国诗词大会》,中国传统文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理。下列叙述错误的是
A.“迟日江山丽,春风花草香”说明分子在不断运动
B.“真金不怕火炼”说明黄金的化学性质非常稳定
C.“釜底抽薪”与“钻木取火”都说明燃烧需要达到可燃物的着火点
D.“熬胆矾铁釜,久之亦化为铜”说明铁的活动性比铜强
4.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
5.化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
6.小深同学用思维导图梳理了Na2CO3 的相关知识,其中描述错误的是( )
A.A B.B C.C D.D
7.下列关于金属的说法中,不正确的是
A.铜有良好的导电性,常用于制作导线
B.所有的金属都能与稀盐酸反应
C.铁制品在干燥的空气中不易生锈
D.不锈钢具有较强的耐腐蚀性,可用于制作医疗器械
8.某农技站货架上待售的化肥有NH4NO3、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
9.下列物质间的转化一步就能实现的是
A.CaCO3→Na2CO3 B. C.CO2→O2 D.H2O2→H2
10.下列物质既能跟硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.①②③④ B.①和③ C.③和④ D.①和④
11.下列有关金属材料的说法错误的是
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
12.在托盘天平的两端各放一个盛有相同质量、相同浓度盐酸的烧杯,并使天平保持平衡,在左、右两个烧杯中分别放入等质量的两种金属(保持盐酸过量),完全反应后发现左盘升高、右盘下降,则左右两个烧杯中分别放入的金属可能是,
A.镁和铝 B.锌和镁 C.锌和铜 D.铜和铁
二、简答题
13.小美在蛋糕包装中发现了一包脱氧保鲜剂,打开后发现其中的铁粉已经变为红棕色,铁粉变色的原因是_____。
14.苏泊尔是中国唯一一家炊具类的大型上市公司,以生产不锈钢锅具为主业,近日曝光旗下200元以下的不锈钢锅具低于国家卫生标准。则回答问题:
(1)不锈钢属于一种_____材料,其主要合金元素中镍和铬的含量分别是18%和8%,主要起到_______作用,请举例说明不锈钢的主要用途有_________。
(2)如果不锈钢产品中的锰含量超标,镍含量不达标,可能严重影响相关产品的使用效果和寿命,锰是一种过渡性金属,经研究显示锰在成人每千克每日摄入量不能超过0.1mg,请你说出锰含量超标的危害还有哪些?____________。
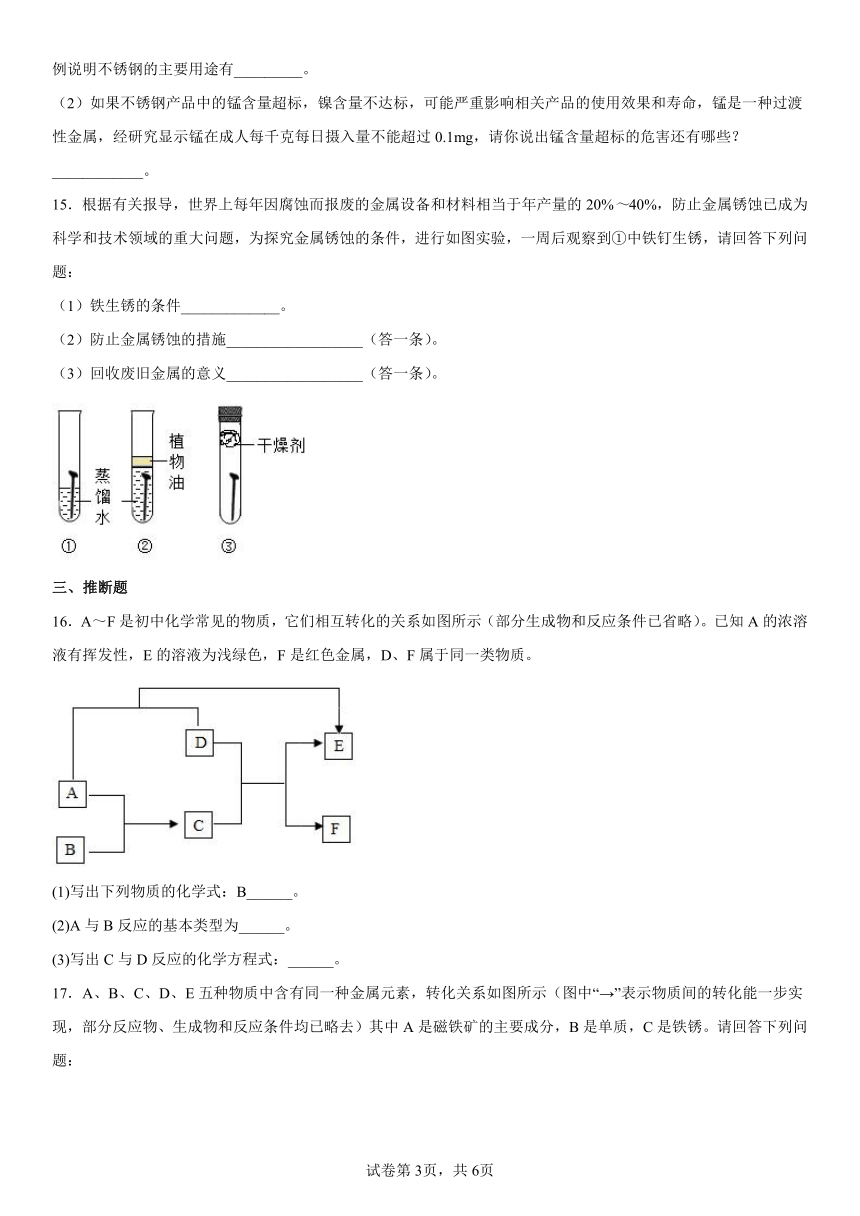
15.根据有关报导,世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%~40%,防止金属锈蚀已成为科学和技术领域的重大问题,为探究金属锈蚀的条件,进行如图实验,一周后观察到①中铁钉生锈,请回答下列问题:
(1)铁生锈的条件_____________。
(2)防止金属锈蚀的措施__________________(答一条)。
(3)回收废旧金属的意义__________________(答一条)。
三、推断题
16.A~F是初中化学常见的物质,它们相互转化的关系如图所示(部分生成物和反应条件已省略)。已知A的浓溶液有挥发性,E的溶液为浅绿色,F是红色金属,D、F属于同一类物质。
(1)写出下列物质的化学式:B______。
(2)A与B反应的基本类型为______。
(3)写出C与D反应的化学方程式:______。
17.A、B、C、D、E五种物质中含有同一种金属元素,转化关系如图所示(图中“→”表示物质间的转化能一步实现,部分反应物、生成物和反应条件均已略去)其中A是磁铁矿的主要成分,B是单质,C是铁锈。请回答下列问题:
(1)若A与一种氧化物反应生成单质B,则反应的化学方程式为_____。
(2)当B作为金属材料制成金属制品时,防止其可能转化为C的方法是_____(写一种)。
(3)当D→E为化合反应时,化学反应方程式为______。
(4)若B与某盐溶液发生置换反应生成E,其化学反应方程式为______。
四、实验题
18.下列是初中化学中的一些常见实验,请回答下列问题:
(1)A实验说明燃烧的条件之一是______________________。
(2)B实验操作中玻璃棒不断搅拌的目的是_________________________。
(3)C实验中两种物质研磨时发生反应的化学方程式是_________________________。
(4)D实验测定结果偏小的原因可能是_________________________。(答出一点即可)
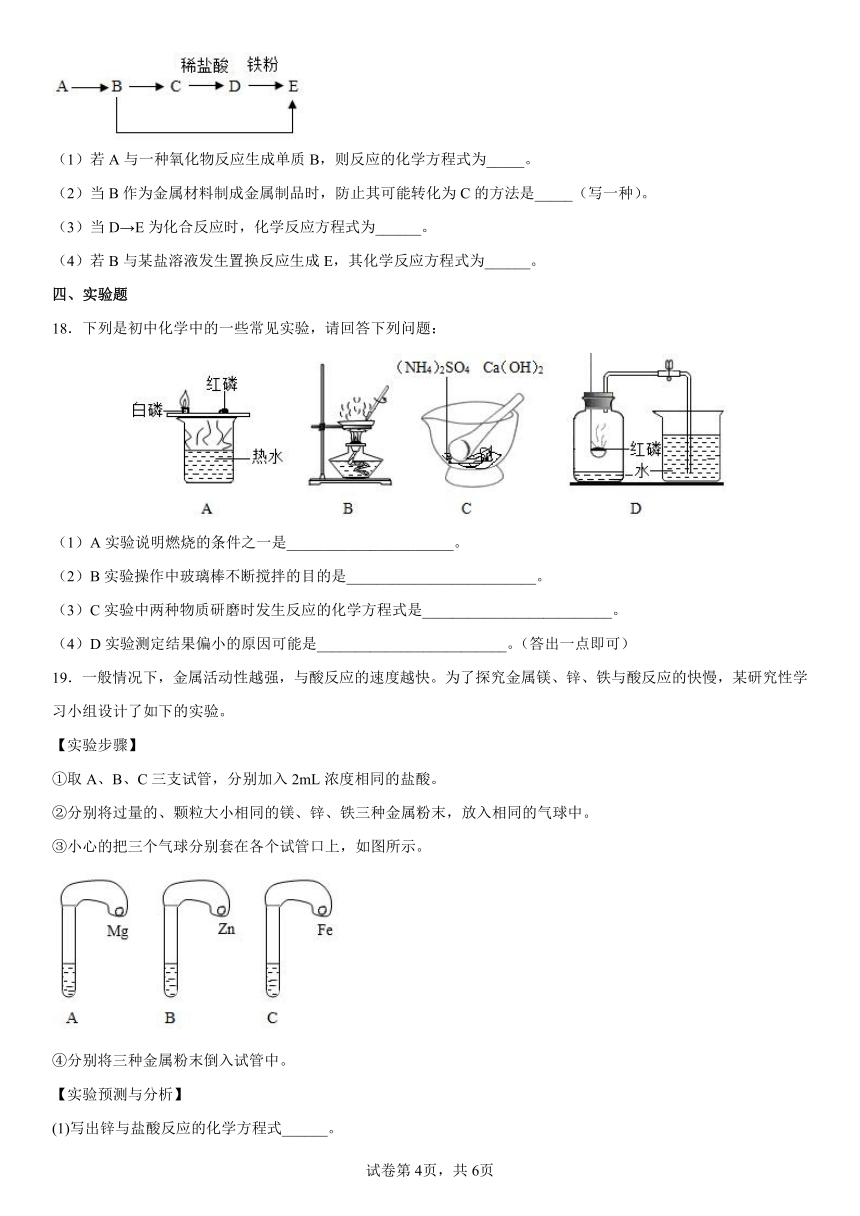
19.一般情况下,金属活动性越强,与酸反应的速度越快。为了探究金属镁、锌、铁与酸反应的快慢,某研究性学习小组设计了如下的实验。
【实验步骤】
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸。
②分别将过量的、颗粒大小相同的镁、锌、铁三种金属粉末,放入相同的气球中。
③小心的把三个气球分别套在各个试管口上,如图所示。
④分别将三种金属粉末倒入试管中。
【实验预测与分析】
(1)写出锌与盐酸反应的化学方程式______。
(2)气球膨胀最快的是_____。(填“A或B或C”)
(3)铁粉与盐酸反应的现象是_____。
(4)步骤④是实验获得成功的关键,你认为该操作应该注意的是:______。
五、计算题
20.金属在生产生活中有着广泛的应用据有关报道每年因锈蚀而报废的铁制品约占年产量的20%-40%铁制品生锈的条件是铁与_____接触.如生产含杂质5%的生铁,理论上需要含70%的的赤铁矿_____t(保留一位小数)
21.为测定实验室中某硫酸铜样品中硫酸铜的质量分数(所含杂质溶于水,但不参与反应),进行了图所示的实验。请计算:
(1)a=______。
(2)该样品中硫酸铜的质量分数。
22.为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如右表:根据实验及有关数据进行分析与计算:
第Ⅰ组 第Ⅱ组 第Ⅲ组
稀硫酸的质量/g 50 100 150
溶解固体的质量/g 10 16 16
(1)20g样品中含氧化铜的质量为______g。
(2)根据第I组数据计算所用稀硫酸的溶质质量分数是多少?(写出计算过程)
(3)求第I组实验所得溶液中溶质的质量分数______(精确到0.1%)。
(4)将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,在图中画出滤液中加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.C
4.A
5.C
6.A
7.B
8.C
9.C
10.A
11.C
12.C
13.铁粉和空气中氧气、水共同作用生成铁锈变为红棕色
14. 金属 抗氧化性和耐腐蚀 可制作医疗器具和炊具等 对人体有害,损害神经系统功能,不能用于防锈等
15. 铁与氧气和水共同接触; 在金属表面形成保护膜如喷漆等(或保持金属表面洁净干燥)(合理即可); 节约金属资源(或减少环境污染、节约能源、降低生产成本)(合理即可)
16.(1)CuO或Cu(OH)2
(2)复分解反应
(3)
17. 刷漆
18. 温度要达到可燃物的着火点以上 防止局部温度过高造成液滴飞溅
Ca(OH)2+(NH4)2SO4=CaSO4+2NH3↑+2H2O 红磷的量不足(或装置漏气或未冷却至室温就打开弹簧夹)
19. Zn+2HCl=ZnCl2+H2↑ A 黑色固体表面冒气泡,固体逐渐减少(但不消失),放热,溶液由无色变为浅绿色 同时将三种金属粉末倒入试管中
20.(1)O2和H2O(2)38.8t
21.(1)10
(2)96%
解:由题意知,硫酸铜样品中所含杂质溶于水,所以滤渣的质量为氢氧化铜的质量,
设参加反应的硫酸铜质量为x,
样品中硫酸铜的质量分数为×100%=96%;
答:样品中硫酸铜的质量分数为96%。
22.(1)16
(2)解:由第I组合第II组实验数据可知,第I组实验中硫酸完全反应
设50g稀硫酸中H2SO4的质量为x,生成硫酸铜的质量为y
= x=12.25g
= y=20g
稀硫酸的溶质质量分数=×100%=24.5%
答:稀硫酸的溶质质量分数为24.5%。
(3)解:反应后溶液的质量=50g+10g=60g
反应后所得溶液中溶质的质量分数=×100%≈33.3%
答:反应后所得溶液中溶质的质量分数为33.3%。
(4)解:设和16g氧化铜反应的硫酸的质量为x,生成硫酸铜的质量为y
= x=19.6g
= y=32g
第Ⅱ组实验后溶液中剩余硫酸的质量=100g×24.5% 19.6g=4.9g
设与溶液中剩余的硫酸反应的氢氧化钠溶液的质量为z
= z=40g
设与32g硫酸铜反应的氢氧化钠溶液的质量为m,生成氢氧化铜沉淀的质量为n
= m=160g
= n=19.6g
所以将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图画为
答:将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图画为。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质中,属于合金的是
A.不锈钢 B.氧化铁 C.铜 D.石墨
2.生活中遇到的问题,常常涉及化学知识。下列说法不正确的是
A.“绿色食品”、“白色污染”、“赤潮” 主要都不是在说颜色
B.生活污水、农药和难分解的有机物等会造成水体污染
C.约占空气体积21%的氧气能支持燃烧,说明氧气是一种高能燃料
D.许多合金比组成合金的纯金属强度和硬度更高、抗腐蚀性能更好
3.从《中国成语大会》到《中国诗词大会》,中国传统文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理。下列叙述错误的是
A.“迟日江山丽,春风花草香”说明分子在不断运动
B.“真金不怕火炼”说明黄金的化学性质非常稳定
C.“釜底抽薪”与“钻木取火”都说明燃烧需要达到可燃物的着火点
D.“熬胆矾铁釜,久之亦化为铜”说明铁的活动性比铜强
4.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
5.化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
6.小深同学用思维导图梳理了Na2CO3 的相关知识,其中描述错误的是( )
A.A B.B C.C D.D
7.下列关于金属的说法中,不正确的是
A.铜有良好的导电性,常用于制作导线
B.所有的金属都能与稀盐酸反应
C.铁制品在干燥的空气中不易生锈
D.不锈钢具有较强的耐腐蚀性,可用于制作医疗器械
8.某农技站货架上待售的化肥有NH4NO3、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
9.下列物质间的转化一步就能实现的是
A.CaCO3→Na2CO3 B. C.CO2→O2 D.H2O2→H2
10.下列物质既能跟硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.①②③④ B.①和③ C.③和④ D.①和④
11.下列有关金属材料的说法错误的是
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
12.在托盘天平的两端各放一个盛有相同质量、相同浓度盐酸的烧杯,并使天平保持平衡,在左、右两个烧杯中分别放入等质量的两种金属(保持盐酸过量),完全反应后发现左盘升高、右盘下降,则左右两个烧杯中分别放入的金属可能是,
A.镁和铝 B.锌和镁 C.锌和铜 D.铜和铁
二、简答题
13.小美在蛋糕包装中发现了一包脱氧保鲜剂,打开后发现其中的铁粉已经变为红棕色,铁粉变色的原因是_____。
14.苏泊尔是中国唯一一家炊具类的大型上市公司,以生产不锈钢锅具为主业,近日曝光旗下200元以下的不锈钢锅具低于国家卫生标准。则回答问题:
(1)不锈钢属于一种_____材料,其主要合金元素中镍和铬的含量分别是18%和8%,主要起到_______作用,请举例说明不锈钢的主要用途有_________。
(2)如果不锈钢产品中的锰含量超标,镍含量不达标,可能严重影响相关产品的使用效果和寿命,锰是一种过渡性金属,经研究显示锰在成人每千克每日摄入量不能超过0.1mg,请你说出锰含量超标的危害还有哪些?____________。
15.根据有关报导,世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%~40%,防止金属锈蚀已成为科学和技术领域的重大问题,为探究金属锈蚀的条件,进行如图实验,一周后观察到①中铁钉生锈,请回答下列问题:
(1)铁生锈的条件_____________。
(2)防止金属锈蚀的措施__________________(答一条)。
(3)回收废旧金属的意义__________________(答一条)。
三、推断题
16.A~F是初中化学常见的物质,它们相互转化的关系如图所示(部分生成物和反应条件已省略)。已知A的浓溶液有挥发性,E的溶液为浅绿色,F是红色金属,D、F属于同一类物质。
(1)写出下列物质的化学式:B______。
(2)A与B反应的基本类型为______。
(3)写出C与D反应的化学方程式:______。
17.A、B、C、D、E五种物质中含有同一种金属元素,转化关系如图所示(图中“→”表示物质间的转化能一步实现,部分反应物、生成物和反应条件均已略去)其中A是磁铁矿的主要成分,B是单质,C是铁锈。请回答下列问题:
(1)若A与一种氧化物反应生成单质B,则反应的化学方程式为_____。
(2)当B作为金属材料制成金属制品时,防止其可能转化为C的方法是_____(写一种)。
(3)当D→E为化合反应时,化学反应方程式为______。
(4)若B与某盐溶液发生置换反应生成E,其化学反应方程式为______。
四、实验题
18.下列是初中化学中的一些常见实验,请回答下列问题:
(1)A实验说明燃烧的条件之一是______________________。
(2)B实验操作中玻璃棒不断搅拌的目的是_________________________。
(3)C实验中两种物质研磨时发生反应的化学方程式是_________________________。
(4)D实验测定结果偏小的原因可能是_________________________。(答出一点即可)
19.一般情况下,金属活动性越强,与酸反应的速度越快。为了探究金属镁、锌、铁与酸反应的快慢,某研究性学习小组设计了如下的实验。
【实验步骤】
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸。
②分别将过量的、颗粒大小相同的镁、锌、铁三种金属粉末,放入相同的气球中。
③小心的把三个气球分别套在各个试管口上,如图所示。
④分别将三种金属粉末倒入试管中。
【实验预测与分析】
(1)写出锌与盐酸反应的化学方程式______。
(2)气球膨胀最快的是_____。(填“A或B或C”)
(3)铁粉与盐酸反应的现象是_____。
(4)步骤④是实验获得成功的关键,你认为该操作应该注意的是:______。
五、计算题
20.金属在生产生活中有着广泛的应用据有关报道每年因锈蚀而报废的铁制品约占年产量的20%-40%铁制品生锈的条件是铁与_____接触.如生产含杂质5%的生铁,理论上需要含70%的的赤铁矿_____t(保留一位小数)
21.为测定实验室中某硫酸铜样品中硫酸铜的质量分数(所含杂质溶于水,但不参与反应),进行了图所示的实验。请计算:
(1)a=______。
(2)该样品中硫酸铜的质量分数。
22.为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如右表:根据实验及有关数据进行分析与计算:
第Ⅰ组 第Ⅱ组 第Ⅲ组
稀硫酸的质量/g 50 100 150
溶解固体的质量/g 10 16 16
(1)20g样品中含氧化铜的质量为______g。
(2)根据第I组数据计算所用稀硫酸的溶质质量分数是多少?(写出计算过程)
(3)求第I组实验所得溶液中溶质的质量分数______(精确到0.1%)。
(4)将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,在图中画出滤液中加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.C
4.A
5.C
6.A
7.B
8.C
9.C
10.A
11.C
12.C
13.铁粉和空气中氧气、水共同作用生成铁锈变为红棕色
14. 金属 抗氧化性和耐腐蚀 可制作医疗器具和炊具等 对人体有害,损害神经系统功能,不能用于防锈等
15. 铁与氧气和水共同接触; 在金属表面形成保护膜如喷漆等(或保持金属表面洁净干燥)(合理即可); 节约金属资源(或减少环境污染、节约能源、降低生产成本)(合理即可)
16.(1)CuO或Cu(OH)2
(2)复分解反应
(3)
17. 刷漆
18. 温度要达到可燃物的着火点以上 防止局部温度过高造成液滴飞溅
Ca(OH)2+(NH4)2SO4=CaSO4+2NH3↑+2H2O 红磷的量不足(或装置漏气或未冷却至室温就打开弹簧夹)
19. Zn+2HCl=ZnCl2+H2↑ A 黑色固体表面冒气泡,固体逐渐减少(但不消失),放热,溶液由无色变为浅绿色 同时将三种金属粉末倒入试管中
20.(1)O2和H2O(2)38.8t
21.(1)10
(2)96%
解:由题意知,硫酸铜样品中所含杂质溶于水,所以滤渣的质量为氢氧化铜的质量,
设参加反应的硫酸铜质量为x,
样品中硫酸铜的质量分数为×100%=96%;
答:样品中硫酸铜的质量分数为96%。
22.(1)16
(2)解:由第I组合第II组实验数据可知,第I组实验中硫酸完全反应
设50g稀硫酸中H2SO4的质量为x,生成硫酸铜的质量为y
= x=12.25g
= y=20g
稀硫酸的溶质质量分数=×100%=24.5%
答:稀硫酸的溶质质量分数为24.5%。
(3)解:反应后溶液的质量=50g+10g=60g
反应后所得溶液中溶质的质量分数=×100%≈33.3%
答:反应后所得溶液中溶质的质量分数为33.3%。
(4)解:设和16g氧化铜反应的硫酸的质量为x,生成硫酸铜的质量为y
= x=19.6g
= y=32g
第Ⅱ组实验后溶液中剩余硫酸的质量=100g×24.5% 19.6g=4.9g
设与溶液中剩余的硫酸反应的氢氧化钠溶液的质量为z
= z=40g
设与32g硫酸铜反应的氢氧化钠溶液的质量为m,生成氢氧化铜沉淀的质量为n
= m=160g
= n=19.6g
所以将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图画为
答:将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图画为。
答案第1页,共2页
答案第1页,共2页
