化学人教版2019必修第一册4.2.1 元素性质的周期性变化规律(共30张ppt)
文档属性
| 名称 | 化学人教版2019必修第一册4.2.1 元素性质的周期性变化规律(共30张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-13 10:17:08 | ||
图片预览




文档简介
(共30张PPT)
走进奇妙的化学世界
必修第一册
第四章
物质结构 元素周期律
第二节
元素周期律
镓的故事
布瓦博德朗
门捷列夫
1875年发现一种新元素,将其命名为镓(纪念法国)
并公布了所测镓的主要性质
比重为4.70
您所说的镓就是我四年前所预言的“类铝”
它的比重应该为5.9左右
请您再测一下吧
镓的比重是 5.94
思考:门捷列夫是依靠什么规律神奇的预言镓的性质吗?
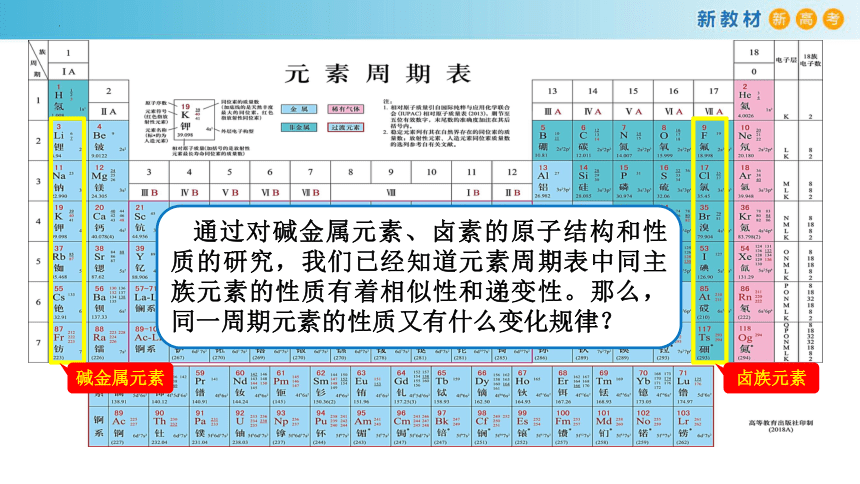
碱金属元素
卤族元素
通过对碱金属元素、卤素的原子结构和性质的研究,我们已经知道元素周期表中同主族元素的性质有着相似性和递变性。那么,同一周期元素的性质又有什么变化规律?
学习
目标
PART
01
PART
02
第1课时
元素性质的周期性变化规律
结合有关数据和实验事实,认识原子核外电子排布、原子半径、主要化合价等随元素原子序数递增而呈现周期性变化的规律。
以第三周期元素为例,认识同周期元素的金属性、非金属性随元素原子序数递增而呈现周期性变化的规律,构建元素周期律。
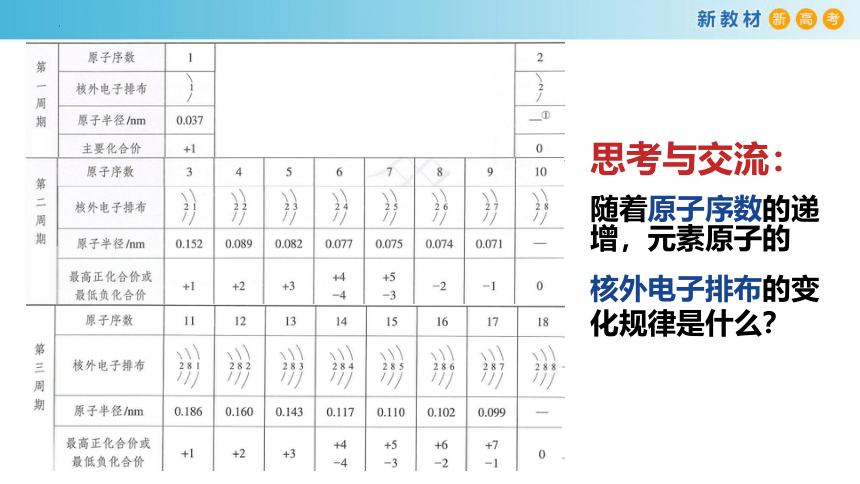
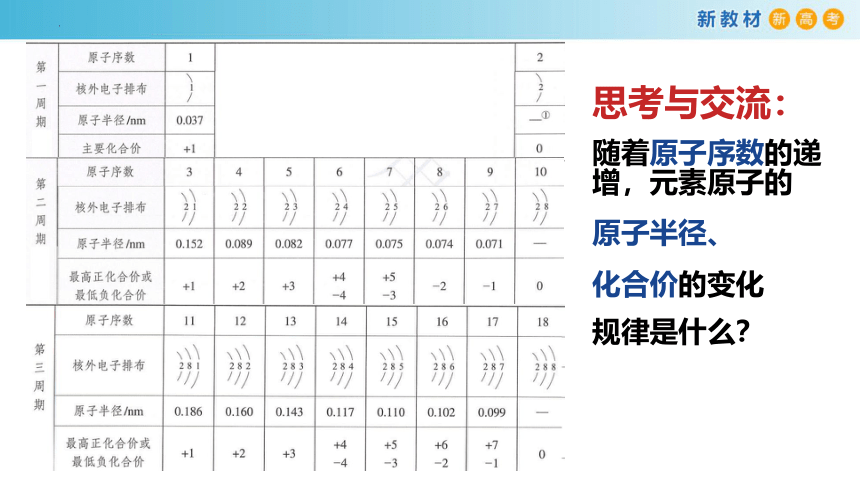
思考与交流:
随着原子序数的递增,元素原子的
核外电子排布的变化规律是什么?
核外电子排布的规律:
最外层电子数1→2
最外层电子数1→8
最外层电子数1→8
同周期由左向右元素的原子最外层电子数逐渐增加(1→8)
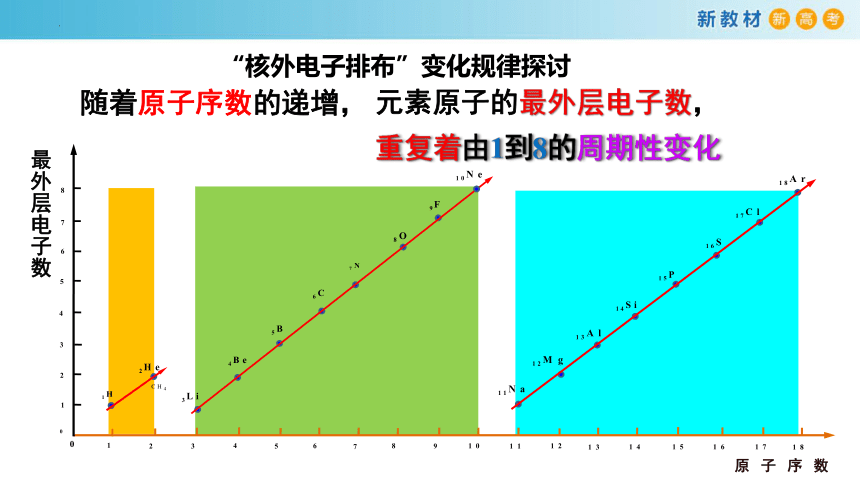
“核外电子排布”变化规律探讨
最外层电子数
随着原子序数的递增,
元素原子的最外层电子数,
重复着由1到8的周期性变化
【分析引入】
结构
性质
决定
反应
原子半径
主要化合价
金属性和非金属性
最外层电子数
呈现周期性变化
思考与交流:
随着原子序数的递增,元素原子的
原子半径、
化合价的变化
规律是什么?
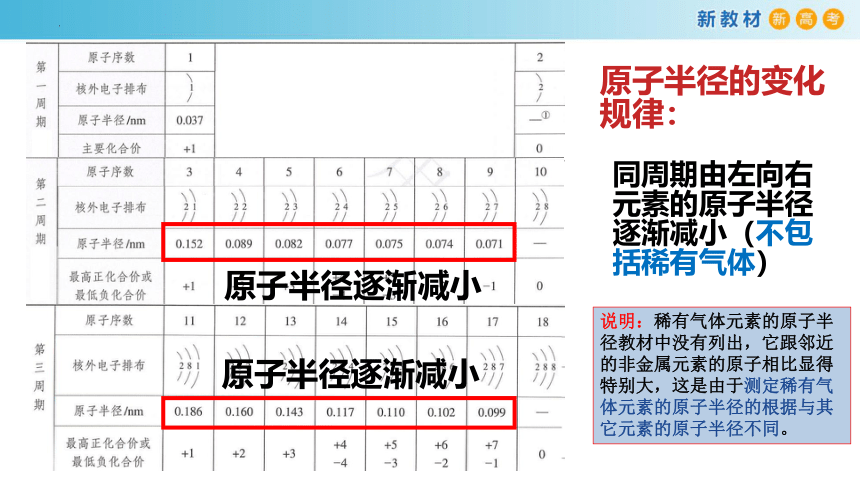
原子半径的变化规律:
原子半径逐渐减小
原子半径逐渐减小
同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)
说明:稀有气体元素的原子半径教材中没有列出,它跟邻近的非金属元素的原子相比显得特别大,这是由于测定稀有气体元素的原子半径的根据与其它元素的原子半径不同。
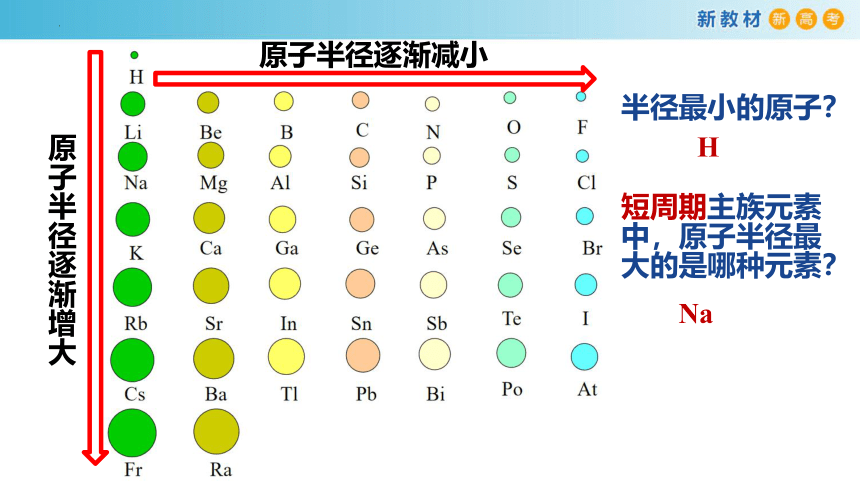
原子半径逐渐增大
原子半径逐渐减小
半径最小的原子?
短周期主族元素中,原子半径最大的是哪种元素?
Na
H
1 H
0.037
2 He
3 Li
0.134
4 Be
0.090
5 B
0.082
6 C
0.077
7 N
0.075
8 O
0.073
9 F
0.071
10 Ne
11 Na
0.154
12 Mg
0.130
13 Al
0.118
14 Si
0.111
15 P
0.106
16 S
0.102
17 Cl
0.099
18 Ar
原子序数
原
子
半
径
元素
原子半径
/nm
原子序数与原子半径线状图
_
_
-
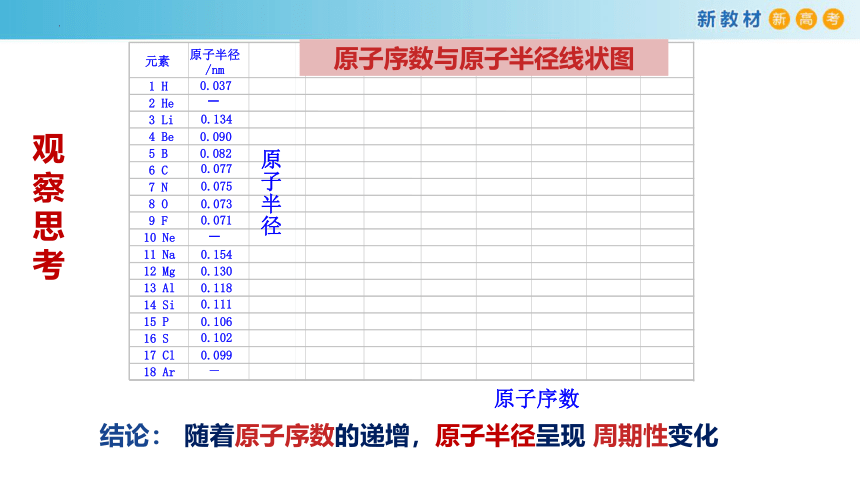
结论:
观察思考
随着原子序数的递增,原子半径呈现 周期性变化
原子序数与原子半径的关系
以原子序数为横坐标,原子半径为纵坐标,制作成折线图。请同学们从点(同主族元素)、线(同周期元素)、面(不同周期的变化趋势)三个层次进行数据分析,归纳规律 。
元素(除稀有气体外)的原子半径,
重复着由大到小的周期性变化
“原子半径”变化规律探讨
原子核对核外电子吸引力
(电子层数相同)
质子数
原子半径
弱
强
小
大
小
大
“原子半径”变化规律探讨
原子半径逐渐增大
原子半径逐渐减小
半径最小的原子是?
短周期主族元素中,原子半径最大的是哪种元素?
Na
H
稀有气体除外
粒子半径大小的比较
1、比较 Na 与 Cl、Na 与 F 的原子半径大小?
r(Na)>r(Cl)
r(Na)>r(F)
2、比较 Na+ 与 Cl 、Na+ 与 F 的半径大小?
r(Na+)r(Na+)3、比较 Na 与 Na+、Cl 与 Cl 的半径大小?
r(Na)>r(Na+)
r(Cl)同电子层结构:序大径小
电子层数
核电荷数
核外电子数
元素化合价的变化规律:
正价:+1→+5,负价:-4 →-1
正价:+1→+7,负价:-4 →-1
同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);
元素的最低负价由ⅣA族的-4价逐渐升高至ⅦA族的-1价
“元素主要化合价”变化规律探讨
主族元素的最高正化合价,重复着由+1到+7的周期性变化
随着原子序数的递增(除氢、稀有气体),
“元素主要化合价”变化规律探讨
主族元素的最高正化合价,重复着由+1到+7,
随着原子序数的递增(除氢、稀有气体),
最低负化合价重复着由-4到-1的周期性变化
原子序数与最外层电子数、化合价的关系
结论1:随着原子序数的递增,原子的最外层电子数重复出现从___到___周期性变化。
1
8
H、He除外
结论2:随着核电荷数的递增,元素的主要化合价呈周期性变化。
最高正价由____到____递增,最低负价由____到____递增。
+1
+7
4
1
O、F 除外
结论3:元素最高正价=最外层电子数=主族序数。
O、F 除外
结论4:金属元素无负价;稀有气体元素化合价为0;非金属元素的最高正价+|最低负价|=8。
H B O F 除外
Ⅳ A Ⅴ A Ⅵ A Ⅶ A
氢化物 RH4 RH3 H2R HR
最高价含氧酸 H2RO3 H3RO4 或 HRO3 H2RO4 HRO4
随着原子序数的递增
原子的核外电子排布
原子半径
化合价
呈现周期性的变化
随着原子序数的增加,元素原子的半径、元素的主要化合价为什么呈现周期性变化?出现这种变化的根本原因是什么?
随着元素原子序数的递增,
原子核外电子排布呈周期性变化。
一、元素周期律
(实质、根本原因)
①主族非金属除H:丨最高正价丨+丨最低负价丨=8
② F无正价,O无最高正价
二、微粒半径的比较
思考:粒子半径受哪些因素制约?
①电子层数:
电子层数越多,原子半径越大
原子半径的变化规律
同周期: 从左→右,原子半径逐渐减小
同主族: 从上→下,原子半径逐渐增大
②核电荷数:
当电子层数相同时,核电荷数越大,半径越小
(序大径小)
③核外电子数:
当电子层数和核电荷数相同时,
核外电子数越多,半径越大。
注意:第二周期的Li比第三周期的S、Cl等原子半径大。
2.比较Na与Mg、Al的原子半径大小
1.比较O和S的半径大小
3.比较Na+、O2-、Mg2+的半径大小
Na>Mg>Al
OO2->Na+>Mg2+
4.比较Na和Na+、 O和O2-半径大小
Na>Na+
O最外层电子相同;硫的电子层数多
电子层数相同,核电荷数依次增大
核外电子排布相同,核电荷数依次增大
电子层数不同,核电荷数相同
核电荷数电、电子层数均相同,最外层电子不同
①同主族:序大径大
②同周期:序大径小
③同元素:价高径小
④同结构:价高径小
“三看”法比较简单粒子半径大小
(1)r(F) r(Cl)
(4)r(Cl-) r(S2-)
(2)r(Cl) r( S) r( P)
(3)r(Al3+) r(Mg2+) r(Na+) r(F-) r(O2-)
<
<
<
<
<
<
<
<
1.比较下列微粒半径的大小
2.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P
AB
3.下列粒子半径大小的比较中,正确的是( )
A.Na+Cl->Na+>Al3+
C.NaRb>K>Na
BD
4.下列各组微粒半径大小比较中,不正确的是( )
A. r(K)>r(Na)>r(Li) B. r(Mg2+)>r(Na+)>r(F-)
C. r( Na+)>r(Mg2+)>r(Al3+) D. r(Cl-)>r(F-)>r(F)
B
小结:
元素性质的周期性变化规律
随着原子序数的递增,原子的核外电子排布、原子半径和化合价各呈现什么规律性的变化?
原子 序数 电子 层数 最外层 电子数 原子半径的变化 (不考虑稀有气体元素) 最高或最低化合价的变化
1~2 1 1 → 2 — +1 → 0
3~10 0.152 nm → 0.071 nm 大 → 小 +1 +2 +3 +4 +5
4 3 2 1 0
11~18
结论:
2
1 → 8
3
1 → 8
0.186 nm → 0.099 nm
大 → 小
+1 +2 +3 +4 +5 +6 +7
4 3 2 1 0
随着原子序数的递增,元素原子的核外电子排布、原子半径、元素化合价呈周期性变化。
练习1:判断正误:
(1)第二周期元素从左至右,最高正价从+1递增到+7( )
(2)原子半径最小的元素是氢元素( )
(3)同周期元素最外层电子数都是从1递增到8( )
(4)氢元素除了有+1价外,也可以有 1价,如NaH( )
×
√
×
√
练习2:下图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示( )
A.电子层数 B.最外层电子数
C.最高化合价 D.原子半径
B
练习3:A、B、C为三种短周期元素,A、B同周期,A、C的简单阴离子半径:A2 >C ,B2+与C 具有相同的电子层结构,下列比较不正确的是( )
A.原子序数:A>B>C B.原子半径:C>B>A
C.离子半径:A2 >C >B2+ D.原子核外最外层电子数:C>A>B
B
练习4:元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是七种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 A B C D E F G
原子半径/nm 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要化合价 +1 +2 +3 +6、 2 +7、 1 2 +5、 3
(1)C元素在元素周期表中的位置是第____周期_____族;B的原子结构示意图为________。
(2)D、E气态氢化物的稳定性强弱顺序为__________(填化学式)。
(3)上述七种元素的最高价氧化物对应水化物中酸性最强的是_______(填化学式)。
三
ⅢA
+12 2 8 1
HCl>H2S
HClO4
练习6:已知元素X能形成H2X和XO2化合物,则X的最外层电子数为____。
已知R元素氢化物的分子式为H2R,该元素的最高价氧化物对应水化物的化学式为_______。
6
H2RO4
谢谢欣赏
走进奇妙的化学世界
必修第一册
第四章
物质结构 元素周期律
第二节
元素周期律
镓的故事
布瓦博德朗
门捷列夫
1875年发现一种新元素,将其命名为镓(纪念法国)
并公布了所测镓的主要性质
比重为4.70
您所说的镓就是我四年前所预言的“类铝”
它的比重应该为5.9左右
请您再测一下吧
镓的比重是 5.94
思考:门捷列夫是依靠什么规律神奇的预言镓的性质吗?
碱金属元素
卤族元素
通过对碱金属元素、卤素的原子结构和性质的研究,我们已经知道元素周期表中同主族元素的性质有着相似性和递变性。那么,同一周期元素的性质又有什么变化规律?
学习
目标
PART
01
PART
02
第1课时
元素性质的周期性变化规律
结合有关数据和实验事实,认识原子核外电子排布、原子半径、主要化合价等随元素原子序数递增而呈现周期性变化的规律。
以第三周期元素为例,认识同周期元素的金属性、非金属性随元素原子序数递增而呈现周期性变化的规律,构建元素周期律。
思考与交流:
随着原子序数的递增,元素原子的
核外电子排布的变化规律是什么?
核外电子排布的规律:
最外层电子数1→2
最外层电子数1→8
最外层电子数1→8
同周期由左向右元素的原子最外层电子数逐渐增加(1→8)
“核外电子排布”变化规律探讨
最外层电子数
随着原子序数的递增,
元素原子的最外层电子数,
重复着由1到8的周期性变化
【分析引入】
结构
性质
决定
反应
原子半径
主要化合价
金属性和非金属性
最外层电子数
呈现周期性变化
思考与交流:
随着原子序数的递增,元素原子的
原子半径、
化合价的变化
规律是什么?
原子半径的变化规律:
原子半径逐渐减小
原子半径逐渐减小
同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)
说明:稀有气体元素的原子半径教材中没有列出,它跟邻近的非金属元素的原子相比显得特别大,这是由于测定稀有气体元素的原子半径的根据与其它元素的原子半径不同。
原子半径逐渐增大
原子半径逐渐减小
半径最小的原子?
短周期主族元素中,原子半径最大的是哪种元素?
Na
H
1 H
0.037
2 He
3 Li
0.134
4 Be
0.090
5 B
0.082
6 C
0.077
7 N
0.075
8 O
0.073
9 F
0.071
10 Ne
11 Na
0.154
12 Mg
0.130
13 Al
0.118
14 Si
0.111
15 P
0.106
16 S
0.102
17 Cl
0.099
18 Ar
原子序数
原
子
半
径
元素
原子半径
/nm
原子序数与原子半径线状图
_
_
-
结论:
观察思考
随着原子序数的递增,原子半径呈现 周期性变化
原子序数与原子半径的关系
以原子序数为横坐标,原子半径为纵坐标,制作成折线图。请同学们从点(同主族元素)、线(同周期元素)、面(不同周期的变化趋势)三个层次进行数据分析,归纳规律 。
元素(除稀有气体外)的原子半径,
重复着由大到小的周期性变化
“原子半径”变化规律探讨
原子核对核外电子吸引力
(电子层数相同)
质子数
原子半径
弱
强
小
大
小
大
“原子半径”变化规律探讨
原子半径逐渐增大
原子半径逐渐减小
半径最小的原子是?
短周期主族元素中,原子半径最大的是哪种元素?
Na
H
稀有气体除外
粒子半径大小的比较
1、比较 Na 与 Cl、Na 与 F 的原子半径大小?
r(Na)>r(Cl)
r(Na)>r(F)
2、比较 Na+ 与 Cl 、Na+ 与 F 的半径大小?
r(Na+)
r(Na)>r(Na+)
r(Cl)
电子层数
核电荷数
核外电子数
元素化合价的变化规律:
正价:+1→+5,负价:-4 →-1
正价:+1→+7,负价:-4 →-1
同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);
元素的最低负价由ⅣA族的-4价逐渐升高至ⅦA族的-1价
“元素主要化合价”变化规律探讨
主族元素的最高正化合价,重复着由+1到+7的周期性变化
随着原子序数的递增(除氢、稀有气体),
“元素主要化合价”变化规律探讨
主族元素的最高正化合价,重复着由+1到+7,
随着原子序数的递增(除氢、稀有气体),
最低负化合价重复着由-4到-1的周期性变化
原子序数与最外层电子数、化合价的关系
结论1:随着原子序数的递增,原子的最外层电子数重复出现从___到___周期性变化。
1
8
H、He除外
结论2:随着核电荷数的递增,元素的主要化合价呈周期性变化。
最高正价由____到____递增,最低负价由____到____递增。
+1
+7
4
1
O、F 除外
结论3:元素最高正价=最外层电子数=主族序数。
O、F 除外
结论4:金属元素无负价;稀有气体元素化合价为0;非金属元素的最高正价+|最低负价|=8。
H B O F 除外
Ⅳ A Ⅴ A Ⅵ A Ⅶ A
氢化物 RH4 RH3 H2R HR
最高价含氧酸 H2RO3 H3RO4 或 HRO3 H2RO4 HRO4
随着原子序数的递增
原子的核外电子排布
原子半径
化合价
呈现周期性的变化
随着原子序数的增加,元素原子的半径、元素的主要化合价为什么呈现周期性变化?出现这种变化的根本原因是什么?
随着元素原子序数的递增,
原子核外电子排布呈周期性变化。
一、元素周期律
(实质、根本原因)
①主族非金属除H:丨最高正价丨+丨最低负价丨=8
② F无正价,O无最高正价
二、微粒半径的比较
思考:粒子半径受哪些因素制约?
①电子层数:
电子层数越多,原子半径越大
原子半径的变化规律
同周期: 从左→右,原子半径逐渐减小
同主族: 从上→下,原子半径逐渐增大
②核电荷数:
当电子层数相同时,核电荷数越大,半径越小
(序大径小)
③核外电子数:
当电子层数和核电荷数相同时,
核外电子数越多,半径越大。
注意:第二周期的Li比第三周期的S、Cl等原子半径大。
2.比较Na与Mg、Al的原子半径大小
1.比较O和S的半径大小
3.比较Na+、O2-、Mg2+的半径大小
Na>Mg>Al
O
4.比较Na和Na+、 O和O2-半径大小
Na>Na+
O
电子层数相同,核电荷数依次增大
核外电子排布相同,核电荷数依次增大
电子层数不同,核电荷数相同
核电荷数电、电子层数均相同,最外层电子不同
①同主族:序大径大
②同周期:序大径小
③同元素:价高径小
④同结构:价高径小
“三看”法比较简单粒子半径大小
(1)r(F) r(Cl)
(4)r(Cl-) r(S2-)
(2)r(Cl) r( S) r( P)
(3)r(Al3+) r(Mg2+) r(Na+) r(F-) r(O2-)
<
<
<
<
<
<
<
<
1.比较下列微粒半径的大小
2.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P
AB
3.下列粒子半径大小的比较中,正确的是( )
A.Na+
C.Na
BD
4.下列各组微粒半径大小比较中,不正确的是( )
A. r(K)>r(Na)>r(Li) B. r(Mg2+)>r(Na+)>r(F-)
C. r( Na+)>r(Mg2+)>r(Al3+) D. r(Cl-)>r(F-)>r(F)
B
小结:
元素性质的周期性变化规律
随着原子序数的递增,原子的核外电子排布、原子半径和化合价各呈现什么规律性的变化?
原子 序数 电子 层数 最外层 电子数 原子半径的变化 (不考虑稀有气体元素) 最高或最低化合价的变化
1~2 1 1 → 2 — +1 → 0
3~10 0.152 nm → 0.071 nm 大 → 小 +1 +2 +3 +4 +5
4 3 2 1 0
11~18
结论:
2
1 → 8
3
1 → 8
0.186 nm → 0.099 nm
大 → 小
+1 +2 +3 +4 +5 +6 +7
4 3 2 1 0
随着原子序数的递增,元素原子的核外电子排布、原子半径、元素化合价呈周期性变化。
练习1:判断正误:
(1)第二周期元素从左至右,最高正价从+1递增到+7( )
(2)原子半径最小的元素是氢元素( )
(3)同周期元素最外层电子数都是从1递增到8( )
(4)氢元素除了有+1价外,也可以有 1价,如NaH( )
×
√
×
√
练习2:下图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示( )
A.电子层数 B.最外层电子数
C.最高化合价 D.原子半径
B
练习3:A、B、C为三种短周期元素,A、B同周期,A、C的简单阴离子半径:A2 >C ,B2+与C 具有相同的电子层结构,下列比较不正确的是( )
A.原子序数:A>B>C B.原子半径:C>B>A
C.离子半径:A2 >C >B2+ D.原子核外最外层电子数:C>A>B
B
练习4:元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是七种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 A B C D E F G
原子半径/nm 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要化合价 +1 +2 +3 +6、 2 +7、 1 2 +5、 3
(1)C元素在元素周期表中的位置是第____周期_____族;B的原子结构示意图为________。
(2)D、E气态氢化物的稳定性强弱顺序为__________(填化学式)。
(3)上述七种元素的最高价氧化物对应水化物中酸性最强的是_______(填化学式)。
三
ⅢA
+12 2 8 1
HCl>H2S
HClO4
练习6:已知元素X能形成H2X和XO2化合物,则X的最外层电子数为____。
已知R元素氢化物的分子式为H2R,该元素的最高价氧化物对应水化物的化学式为_______。
6
H2RO4
谢谢欣赏
