第四单元《盐化肥》单元测试题—2022-2023学年九年级化学人教版(五四学制)全一册(有答案)
文档属性
| 名称 | 第四单元《盐化肥》单元测试题—2022-2023学年九年级化学人教版(五四学制)全一册(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 158.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-12 20:50:10 | ||
图片预览

文档简介
第四单元《盐 化肥》单元测试题—2022-2023学年九年级化学人教版(五四学制)全一册
一、单选题
1.下列物质的名称、俗名与化学式完全相符的是( )
A.碳酸钠 小苏打 Na2CO3
B.碳酸氢钠 纯碱 NaHCO3
C.氢氧化钙 熟石灰 CaO
D.二氧化碳 干冰 CO2
2.下列物质在分类上属于碱的是( )
A.HNO3 B.KClO3 C.Ba(OH)2 D.CH3COOH
3.下列实验现象的描述,正确的是
A.铜绿中加入盐酸,生成气泡,溶液最终变成无色
B.燃着的蜡烛熄灭时产生白雾
C.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
D.红磷在空气中燃烧产生大量白烟,放热
4.下列属于置换反应的是
A.
B.
C.NaOH+HCl=NaCl+H2O
D.2Al+6HCl=2AlCl3+3H2↑
5.稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,如图操作及实验现象(或结果),不能证明反应发生的是
A.在混合液中加金属Zn,无气泡产生
B.在混合液中加无色酚酞,溶液呈无色的
C.在混合液中加AgNO3溶液,有白色沉淀
D.用pH试纸测混合液的pH,测得pH等于7
6.我国制碱工业的先驱——侯德榜先生,1921年留美回国后,潜心研究制碱技术,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法),为纯碱和氮肥工业技术的发展做出了杰出贡献。下列物质中能与纯碱发生反应的是
A.NaOH B.NaHCO3 C.H2SO4 D.K2SO4
7.下列关于氯化钠的认识,正确的是
A.组成:含有钠和氯两种单质 B.性质:与盐酸类似,能与碳酸盐反应
C.用途:可用于生产金属钠 D.生产:常用钠与氯气通过化合反应获得
8.下列各组物质用稀硫酸不能区分开的是( )
A.镁粉、氧化铜粉 B.NaOH溶液、KOH溶液
C.铁片、铜片 D.Na2CO3溶液、NaCl溶液
9.下列变化只有加入酸才能一步实现的是
A.AgNO3→AgCl B.CaCO3→CO2 C.Cu→H2 D.CuO→CuSO4
二、简答题
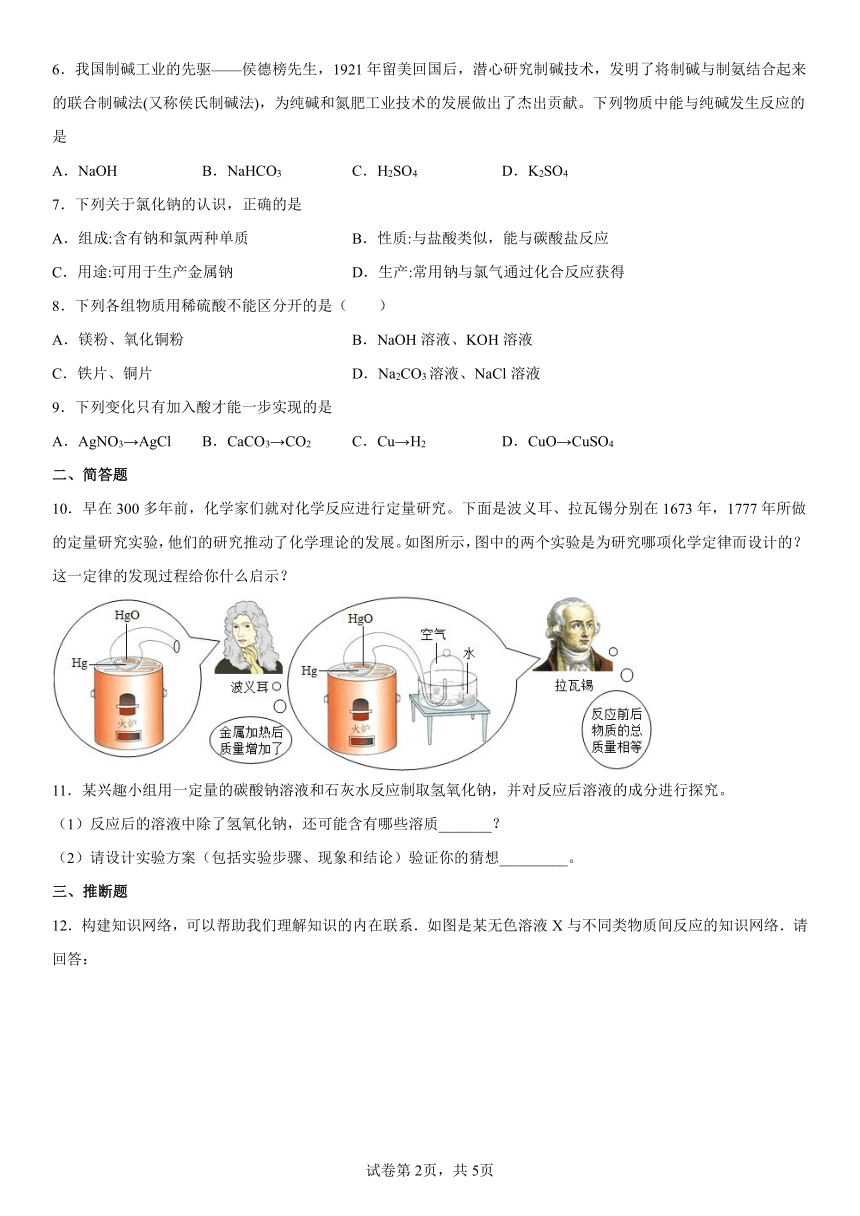
10.早在300多年前,化学家们就对化学反应进行定量研究。下面是波义耳、拉瓦锡分别在1673年,1777年所做的定量研究实验,他们的研究推动了化学理论的发展。如图所示,图中的两个实验是为研究哪项化学定律而设计的?这一定律的发现过程给你什么启示?
11.某兴趣小组用一定量的碳酸钠溶液和石灰水反应制取氢氧化钠,并对反应后溶液的成分进行探究。
(1)反应后的溶液中除了氢氧化钠,还可能含有哪些溶质_______?
(2)请设计实验方案(包括实验步骤、现象和结论)验证你的猜想_________。
三、推断题
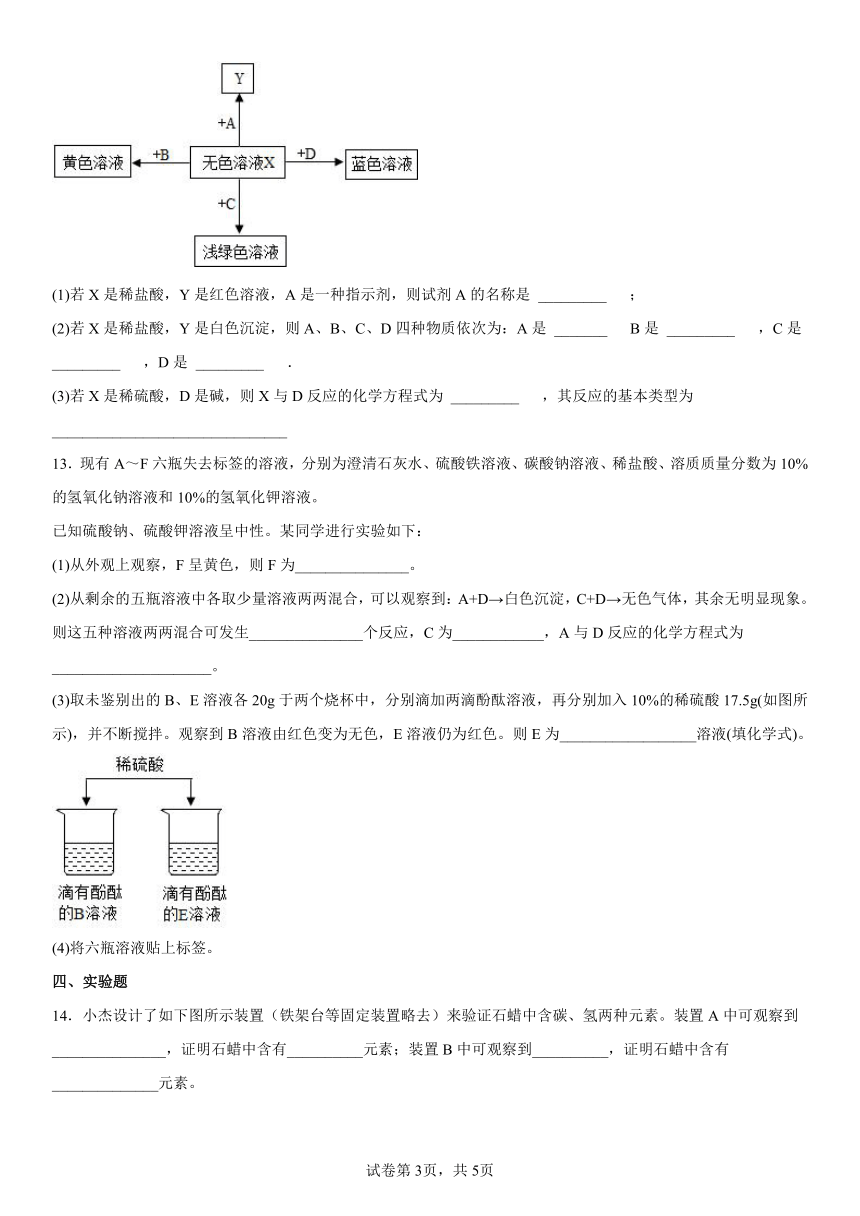
12.构建知识网络,可以帮助我们理解知识的内在联系.如图是某无色溶液X与不同类物质间反应的知识网络.请回答:
(1)若X是稀盐酸,Y是红色溶液,A是一种指示剂,则试剂A的名称是 _________ ;
(2)若X是稀盐酸,Y是白色沉淀,则A、B、C、D四种物质依次为:A是 _______ B是 _________ ,C是 _________ ,D是 _________ .
(3)若X是稀硫酸,D是碱,则X与D反应的化学方程式为 _________ ,其反应的基本类型为 _______________________________
13.现有A~F六瓶失去标签的溶液,分别为澄清石灰水、硫酸铁溶液、碳酸钠溶液、稀盐酸、溶质质量分数为10%的氢氧化钠溶液和10%的氢氧化钾溶液。
已知硫酸钠、硫酸钾溶液呈中性。某同学进行实验如下:
(1)从外观上观察,F呈黄色,则F为_______________。
(2)从剩余的五瓶溶液中各取少量溶液两两混合,可以观察到:A+D→白色沉淀,C+D→无色气体,其余无明显现象。则这五种溶液两两混合可发生_______________个反应,C为____________,A与D反应的化学方程式为_____________________。
(3)取未鉴别出的B、E溶液各20g于两个烧杯中,分别滴加两滴酚酞溶液,再分别加入10%的稀硫酸17.5g(如图所示),并不断搅拌。观察到B溶液由红色变为无色,E溶液仍为红色。则E为__________________溶液(填化学式)。
(4)将六瓶溶液贴上标签。
四、实验题
14.小杰设计了如下图所示装置(铁架台等固定装置略去)来验证石蜡中含碳、氢两种元素。装置A中可观察到_______________,证明石蜡中含有__________元素;装置B中可观察到__________,证明石蜡中含有______________元素。
15.学习了碳酸钠(Na2CO3)的性质后,课题小组运用课堂学习的方法,合作探究家庭蒸慢头用到的小苏打(NaHCO3)的性质,请回答下列问题。
【基础实验记录与分析】
(1)填写下表。
实验一 实验二 实验三
实验操作
实验现象 溶液由无色变为红色 固体溶解,生成无色气泡 生成白色沉淀
实验结论 碳酸氢钠溶液显________性 _________ ________
【拓展实验记录与分析】
(2)同学们通过查阅资料,在老师的指导下采用下图所示装置对小苏打和碳酸钠做了对比实验。实验中小试管内沾有白色固体无水硫酸铜粉末的棉花球变蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水出现白色浑浊,通过该实验得出的结论是:碳酸氢钠受热________,生成物中有水和二氧化碳气体。碳酸钠受热________。
【反思与拓展】
(3)①甲同学分析实验一得出:盐溶液________(选填“一定”或“不一定”)显中性。
②乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有________。
③医疗上,小苏打( NaHCO3)可以治疗胃酸(主要成分是盐酸)过多;依据的原理是是实验二得出的结论该反应的化学方程式_______。
五、计算题
16.草木灰是农家肥料,其主要成分是碳酸钾。某化学兴趣小组进行如下实验,以下是他们的实验过程及数据(假设杂质不与稀盐酸反应,生成的气体全部逸出)。请你回答下列问题:
(1)碳酸钾中钾元素、碳元素、氧元素的质量比为______。
(2)反应生成的气体质量为________g。
(3)稀盐酸中溶质质量分数是______?
17.现取8.0 g石灰石样品放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5 g时,烧杯内物质总质量为42.3 g(气体全部逸出),产生气体的质量与加入的稀盐酸的质量关系如图所示。(石灰石样品中的杂质不溶于水,也不发生反应)试计算 :
提示:样品中某物质的质量分数=该物质质量/样品质量100%
(1)m = ________。
(2)该石灰石样品中碳酸钙的质量是多少?_____
(3)该石灰石样品中碳酸钙的质量分数是多少_____(精确到0.1%,写出计算过程)
18.现有11 g含有少量氯化钠的某纯碱样品,为了测定该样品中的碳酸钠的质量分数,将该纯碱样品全部溶解在100 g水中,再加入氯化钙溶液141 g,恰好完全反应,经过滤后测得所得溶液质量为242 g,请计算:
(1)纯碱样品中碳酸钠的质量分数(计算结果保留到0.1%)。
(2)所得溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.D
4.D
5.C
6.C
7.C
8.B
9.D
10.实验研究的是质量守恒定律。启示:①科学研究要有科学系统的研究方法;②理论的发现都要经过实践的检验;③科学研究要有严谨细致的科学态度。
11. 碳酸钠或氢氧化钙; 取少量反应后的溶液,加入BaCl2溶液,若有白色沉淀生成,说明含有碳酸钠;另取少量反应后的溶液,加入碳酸钠溶液,若有白色沉淀生成,说明含有氢氧化钙。
12. 紫色石蕊试液 硝酸银 氧化铁 铁 氧化铜 H2SO4+Cu(OH)2=CuSO4+2H2O 复分解反应
13. 硫酸铁溶液 5 稀盐酸 NaOH
14. 白色固体变成蓝色 氢 澄清石灰水变浑浊 碳
15.(1) 碱 碳酸氢钠可以和稀盐酸反应生成二氧化碳气体 碳酸氢钠可以和石灰水反应生成碳酸钙沉淀
(2) 分解 不分解
(3) 不一定 H+
16.(1)39:6:24;(2)8.8g;(3)14.6%
17.(1)2.2g(2)5.0g(3)62.5%
18.解:碳酸钙的质量为:11g + 100g + 141g - 242g =10g
设原混合物中Na2CO3的质量为x ,生成NaCl的质量为y
(1)纯碱样品中碳酸钠的质量分数=
(2)反应后所得滤液中氯化钠的质量=11.7g +(11g – 10.6g)= 12.1g
所得滤液的溶质质量分数=
答:纯碱样品中碳酸钠的质量分数为96.4%,所得溶液中溶质质量分数为5%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质的名称、俗名与化学式完全相符的是( )
A.碳酸钠 小苏打 Na2CO3
B.碳酸氢钠 纯碱 NaHCO3
C.氢氧化钙 熟石灰 CaO
D.二氧化碳 干冰 CO2
2.下列物质在分类上属于碱的是( )
A.HNO3 B.KClO3 C.Ba(OH)2 D.CH3COOH
3.下列实验现象的描述,正确的是
A.铜绿中加入盐酸,生成气泡,溶液最终变成无色
B.燃着的蜡烛熄灭时产生白雾
C.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
D.红磷在空气中燃烧产生大量白烟,放热
4.下列属于置换反应的是
A.
B.
C.NaOH+HCl=NaCl+H2O
D.2Al+6HCl=2AlCl3+3H2↑
5.稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,如图操作及实验现象(或结果),不能证明反应发生的是
A.在混合液中加金属Zn,无气泡产生
B.在混合液中加无色酚酞,溶液呈无色的
C.在混合液中加AgNO3溶液,有白色沉淀
D.用pH试纸测混合液的pH,测得pH等于7
6.我国制碱工业的先驱——侯德榜先生,1921年留美回国后,潜心研究制碱技术,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法),为纯碱和氮肥工业技术的发展做出了杰出贡献。下列物质中能与纯碱发生反应的是
A.NaOH B.NaHCO3 C.H2SO4 D.K2SO4
7.下列关于氯化钠的认识,正确的是
A.组成:含有钠和氯两种单质 B.性质:与盐酸类似,能与碳酸盐反应
C.用途:可用于生产金属钠 D.生产:常用钠与氯气通过化合反应获得
8.下列各组物质用稀硫酸不能区分开的是( )
A.镁粉、氧化铜粉 B.NaOH溶液、KOH溶液
C.铁片、铜片 D.Na2CO3溶液、NaCl溶液
9.下列变化只有加入酸才能一步实现的是
A.AgNO3→AgCl B.CaCO3→CO2 C.Cu→H2 D.CuO→CuSO4
二、简答题
10.早在300多年前,化学家们就对化学反应进行定量研究。下面是波义耳、拉瓦锡分别在1673年,1777年所做的定量研究实验,他们的研究推动了化学理论的发展。如图所示,图中的两个实验是为研究哪项化学定律而设计的?这一定律的发现过程给你什么启示?
11.某兴趣小组用一定量的碳酸钠溶液和石灰水反应制取氢氧化钠,并对反应后溶液的成分进行探究。
(1)反应后的溶液中除了氢氧化钠,还可能含有哪些溶质_______?
(2)请设计实验方案(包括实验步骤、现象和结论)验证你的猜想_________。
三、推断题
12.构建知识网络,可以帮助我们理解知识的内在联系.如图是某无色溶液X与不同类物质间反应的知识网络.请回答:
(1)若X是稀盐酸,Y是红色溶液,A是一种指示剂,则试剂A的名称是 _________ ;
(2)若X是稀盐酸,Y是白色沉淀,则A、B、C、D四种物质依次为:A是 _______ B是 _________ ,C是 _________ ,D是 _________ .
(3)若X是稀硫酸,D是碱,则X与D反应的化学方程式为 _________ ,其反应的基本类型为 _______________________________
13.现有A~F六瓶失去标签的溶液,分别为澄清石灰水、硫酸铁溶液、碳酸钠溶液、稀盐酸、溶质质量分数为10%的氢氧化钠溶液和10%的氢氧化钾溶液。
已知硫酸钠、硫酸钾溶液呈中性。某同学进行实验如下:
(1)从外观上观察,F呈黄色,则F为_______________。
(2)从剩余的五瓶溶液中各取少量溶液两两混合,可以观察到:A+D→白色沉淀,C+D→无色气体,其余无明显现象。则这五种溶液两两混合可发生_______________个反应,C为____________,A与D反应的化学方程式为_____________________。
(3)取未鉴别出的B、E溶液各20g于两个烧杯中,分别滴加两滴酚酞溶液,再分别加入10%的稀硫酸17.5g(如图所示),并不断搅拌。观察到B溶液由红色变为无色,E溶液仍为红色。则E为__________________溶液(填化学式)。
(4)将六瓶溶液贴上标签。
四、实验题
14.小杰设计了如下图所示装置(铁架台等固定装置略去)来验证石蜡中含碳、氢两种元素。装置A中可观察到_______________,证明石蜡中含有__________元素;装置B中可观察到__________,证明石蜡中含有______________元素。
15.学习了碳酸钠(Na2CO3)的性质后,课题小组运用课堂学习的方法,合作探究家庭蒸慢头用到的小苏打(NaHCO3)的性质,请回答下列问题。
【基础实验记录与分析】
(1)填写下表。
实验一 实验二 实验三
实验操作
实验现象 溶液由无色变为红色 固体溶解,生成无色气泡 生成白色沉淀
实验结论 碳酸氢钠溶液显________性 _________ ________
【拓展实验记录与分析】
(2)同学们通过查阅资料,在老师的指导下采用下图所示装置对小苏打和碳酸钠做了对比实验。实验中小试管内沾有白色固体无水硫酸铜粉末的棉花球变蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水出现白色浑浊,通过该实验得出的结论是:碳酸氢钠受热________,生成物中有水和二氧化碳气体。碳酸钠受热________。
【反思与拓展】
(3)①甲同学分析实验一得出:盐溶液________(选填“一定”或“不一定”)显中性。
②乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有________。
③医疗上,小苏打( NaHCO3)可以治疗胃酸(主要成分是盐酸)过多;依据的原理是是实验二得出的结论该反应的化学方程式_______。
五、计算题
16.草木灰是农家肥料,其主要成分是碳酸钾。某化学兴趣小组进行如下实验,以下是他们的实验过程及数据(假设杂质不与稀盐酸反应,生成的气体全部逸出)。请你回答下列问题:
(1)碳酸钾中钾元素、碳元素、氧元素的质量比为______。
(2)反应生成的气体质量为________g。
(3)稀盐酸中溶质质量分数是______?
17.现取8.0 g石灰石样品放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5 g时,烧杯内物质总质量为42.3 g(气体全部逸出),产生气体的质量与加入的稀盐酸的质量关系如图所示。(石灰石样品中的杂质不溶于水,也不发生反应)试计算 :
提示:样品中某物质的质量分数=该物质质量/样品质量100%
(1)m = ________。
(2)该石灰石样品中碳酸钙的质量是多少?_____
(3)该石灰石样品中碳酸钙的质量分数是多少_____(精确到0.1%,写出计算过程)
18.现有11 g含有少量氯化钠的某纯碱样品,为了测定该样品中的碳酸钠的质量分数,将该纯碱样品全部溶解在100 g水中,再加入氯化钙溶液141 g,恰好完全反应,经过滤后测得所得溶液质量为242 g,请计算:
(1)纯碱样品中碳酸钠的质量分数(计算结果保留到0.1%)。
(2)所得溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.D
4.D
5.C
6.C
7.C
8.B
9.D
10.实验研究的是质量守恒定律。启示:①科学研究要有科学系统的研究方法;②理论的发现都要经过实践的检验;③科学研究要有严谨细致的科学态度。
11. 碳酸钠或氢氧化钙; 取少量反应后的溶液,加入BaCl2溶液,若有白色沉淀生成,说明含有碳酸钠;另取少量反应后的溶液,加入碳酸钠溶液,若有白色沉淀生成,说明含有氢氧化钙。
12. 紫色石蕊试液 硝酸银 氧化铁 铁 氧化铜 H2SO4+Cu(OH)2=CuSO4+2H2O 复分解反应
13. 硫酸铁溶液 5 稀盐酸 NaOH
14. 白色固体变成蓝色 氢 澄清石灰水变浑浊 碳
15.(1) 碱 碳酸氢钠可以和稀盐酸反应生成二氧化碳气体 碳酸氢钠可以和石灰水反应生成碳酸钙沉淀
(2) 分解 不分解
(3) 不一定 H+
16.(1)39:6:24;(2)8.8g;(3)14.6%
17.(1)2.2g(2)5.0g(3)62.5%
18.解:碳酸钙的质量为:11g + 100g + 141g - 242g =10g
设原混合物中Na2CO3的质量为x ,生成NaCl的质量为y
(1)纯碱样品中碳酸钠的质量分数=
(2)反应后所得滤液中氯化钠的质量=11.7g +(11g – 10.6g)= 12.1g
所得滤液的溶质质量分数=
答:纯碱样品中碳酸钠的质量分数为96.4%,所得溶液中溶质质量分数为5%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
