2022-2023学年高一上学期化学人教版(2019)必修第一册第一章 第三节 氧化还原反应 第1课时 课件 (25张ppt)
文档属性
| 名称 | 2022-2023学年高一上学期化学人教版(2019)必修第一册第一章 第三节 氧化还原反应 第1课时 课件 (25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-14 22:10:57 | ||
图片预览





文档简介
(共25张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第1课时 氧化还原反应的概念
2022年9月
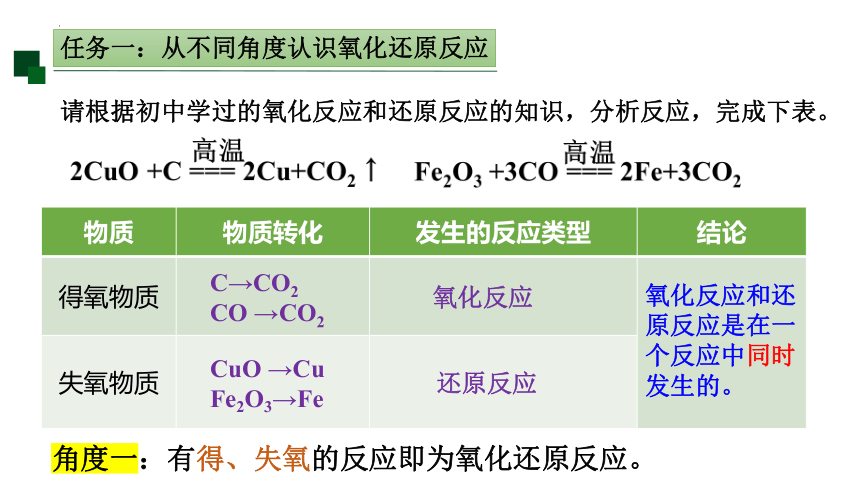
任务一:从不同角度认识氧化还原反应
请根据初中学过的氧化反应和还原反应的知识,分析反应,完成下表。
物质 物质转化 发生的反应类型 结论
得氧物质
失氧物质 C→CO2
CO →CO2
CuO →Cu
Fe2O3→Fe
还原反应
氧化反应
氧化反应和还原反应是在一个反应中同时发生的。
角度一:有得、失氧的反应即为氧化还原反应。
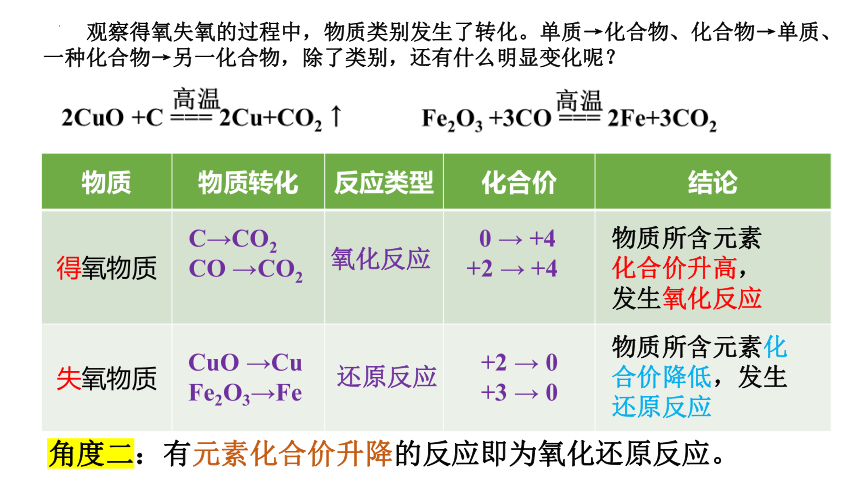
物质 物质转化 反应类型 化合价 结论
得氧物质
失氧物质
C→CO2
CO →CO2
CuO →Cu
Fe2O3→Fe
还原反应
氧化反应
观察得氧失氧的过程中,物质类别发生了转化。单质→化合物、化合物→单质、
一种化合物→另一化合物,除了类别,还有什么明显变化呢?
0 → +4
+2 → +4
+2 → 0
+3 → 0
角度二:有元素化合价升降的反应即为氧化还原反应。
物质所含元素化合价升高,发生氧化反应
物质所含元素化合价降低,发生还原反应
Fe+CuSO4===FeSO4+Cu
化合价降低,还原反应,被还原
化合价升高,氧化反应,被氧化
氧化还原反应的判断依据是: 有无化合价的升降
从得失氧角度分析一个反应是否为氧化还原反应,仅局限于有得失氧的反应,所以此种方法是有局限性、片面性的。
问题1:氧化还原反应是否一定存在氧的得失?
问题2:氧化还原反应中化合价升降存在什么样的规律?
CuSO4 + Fe Cu + FeSO4
+2 +6 -2 0 0 +2 +6 -2
2CuO + C 2Cu + CO2
高温
+2 -2
0
0
+4 -2
+3 -2
+2 -2
+4 -2
0
Fe2O3 + 3CO 2Fe + 3CO2
高温
3. 氧化还原反应中有的元素的化合价可能不变。
2. 元素化合价的升高总数与降低总数相等。
1. 氧化还原反应中元素化合价有升有降。
小结
【课堂达标】
1.下列反应是氧化还原反应的是( )
A.CaCO3+2HCl===CaCl2+H2O+CO2↑
B.CaO+H2O===Ca(OH)2
C.2KMnO4 === K2MnO4+MnO2+O2↑
D.CaCO3 === CaO+CO2↑
高温
C
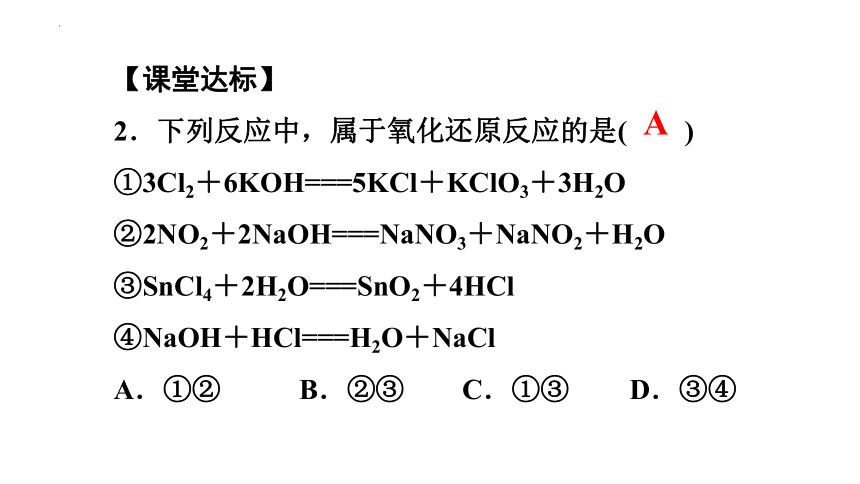
【课堂达标】
2.下列反应中,属于氧化还原反应的是( )
①3Cl2+6KOH===5KCl+KClO3+3H2O
②2NO2+2NaOH===NaNO3+NaNO2+H2O
③SnCl4+2H2O===SnO2+4HCl
④NaOH+HCl===H2O+NaCl
A.①② B.②③ C.①③ D.③④
A
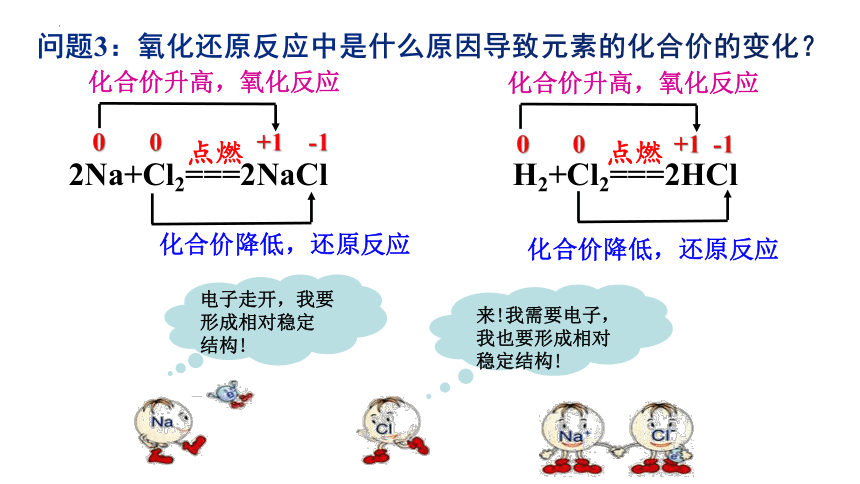
问题3:氧化还原反应中是什么原因导致元素的化合价的变化?
点燃
2Na+Cl2===2NaCl
点燃
H2+Cl2===2HCl
0 0 +1 -1
0 0 +1 -1
化合价升高,氧化反应
化合价升高,氧化反应
化合价降低,还原反应
化合价降低,还原反应
电子走开,我要
形成相对稳定
结构!
来!我需要电子,
我也要形成相对
稳定结构!
点燃
2Na+Cl2===2NaCl
0 0 +1 -1
化合价升高,氧化反应
化合价降低,还原反应
失去电子,
得到电子,
- e-
+e-
微观探析
点燃
H2+Cl2===2HCl
0 0 +1 -1
化合价升高,氧化反应
电子对偏离,
化合价降低,还原反应
电子对偏向,
共用电子对偏向于Cl,Cl的化合价由0价降为-1价;共用电子对偏离于H,H的化合价由0价升高到+1价,
- e-
电子的得失
电子对的偏移
电子的转移
角度三:有电子转移(得失或偏移)的反应为氧化还原反应。
小结
1.氧化还原反应是通过电子转移实现的。
2.氧化反应:失去电子或电子对偏离的反应
3.还原反应:得到电子或电子对偏向的反应
氧化还原反应概念的发展:
得氧、失氧
元素化合价升降
电子转移(电子得失或电子对偏移)
元素(宏观视角)
电子(微观视角)
局限性
特征
本质
任务二:多方法表示氧化还原反应中电子转移
双线桥法
标价态
标出变价元素的化合价。
连双线
箭头从反应物中的元素,指向生成物中的同种元素,箭头不代表电子转移方向。
标出“得到”“失去”,电子转移的数目用a×be-的形式。(a表示共有多少个原子得失电子,b表示每个原子得失电子数)。
注得失
检查
电子有得必有失,电子得失总数应相等。
+3 0 0 +3
得到2x3e-,化合价降低,被还原
失去2x3e-,化合价升高,被氧化
Fe2O3+3CO == 2Fe+3CO2
+3
+2
+4
0
Zn+H2SO4 == ZnSO4+H2↑
0
+1
0
+2
e-
失
2 e-
化合价
升高
被氧化
得
2
╳
化合价
降低
被还原
2
╳
3e-
3
2e-
化合价
降低
被还原
╳
化合价
升高
失
被氧化
得
小结:电子转移数=“得”或“失”电子数
=变价原子数×单个变价原子得(失)电子数
单线桥法
标出变价元素的化合价。
反应物中,失去电子的原子指向得到电子的原子,
即化合价升高的元素指向化合价降低 的元素。
写出转移的电子总数,用ne-表示,不写“得到”“失去”。
标价态
连单线
写总数
6 e-
+3 0 0 +3
【课堂达标】3.
4
【课堂达标】3.
【课堂达标】
4.下列化学反应中电子转移的表示方法正确的是( )
B
判断以下反应是否为氧化还原反应,并判断属于四大基本反应的哪个反应类型?
是否属于
氧化还原反应
四大基本反应类型
(1)2Mg + O2 ===2MgO
(2)2KMnO4 == K2MnO4 + MnO2 + O2↑
(3)CO2 + Na2O == Na2CO3
(4)Fe + CuSO4 == FeSO4 + Cu
(5)
(6)2NaHCO3 === Na2CO3 + CO2↑+ H2O
(7)CaCl2 + Na2CO3 == CaCO3↓+ 2NaCl
点燃
△
△
Cl2 + 2KOH == KCl + KClO + H2O
判断方法:
是否有元素
化合价的升降(特征)
√
化合
√
分解
×
化合
√
置换
√
×
分解
×
复分解
任务三:总结氧化还原反应与四大基本反应关系
化学反应
根据反应物和生成物的类别及数目
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
根据化合价升降
非氧化还原反应
氧化还原反应
非氧化还原反应
复分解反应
置换反应
化合反应
分解反应
小结
练习1.下列类型的反应中,元素化合价一定发生变化的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
C
练习2.
D
书本课后练习
一价氢、氯、钾、钠、银;二价氧、钙,镁、钡、锌;
三铝,四硅、五价磷;
说变价也不难,二三铁、二四碳、二四六硫都齐全;
铜汞二价最常见;单质元素价为零;
负一硝酸氢氧根;负二碳酸硫酸根;
负三记住磷酸根;正一价的是氨根。
常见化合价口诀
用单线桥法表示下列反应的电子转移的方向与数目。
(1)2KClO3 2KCl+3O2↑
(2)3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
(3)4NH3+5O2 4NO+6H2O
12e-
6e-
20e-
第一章 物质及其变化
第三节 氧化还原反应
第1课时 氧化还原反应的概念
2022年9月
任务一:从不同角度认识氧化还原反应
请根据初中学过的氧化反应和还原反应的知识,分析反应,完成下表。
物质 物质转化 发生的反应类型 结论
得氧物质
失氧物质 C→CO2
CO →CO2
CuO →Cu
Fe2O3→Fe
还原反应
氧化反应
氧化反应和还原反应是在一个反应中同时发生的。
角度一:有得、失氧的反应即为氧化还原反应。
物质 物质转化 反应类型 化合价 结论
得氧物质
失氧物质
C→CO2
CO →CO2
CuO →Cu
Fe2O3→Fe
还原反应
氧化反应
观察得氧失氧的过程中,物质类别发生了转化。单质→化合物、化合物→单质、
一种化合物→另一化合物,除了类别,还有什么明显变化呢?
0 → +4
+2 → +4
+2 → 0
+3 → 0
角度二:有元素化合价升降的反应即为氧化还原反应。
物质所含元素化合价升高,发生氧化反应
物质所含元素化合价降低,发生还原反应
Fe+CuSO4===FeSO4+Cu
化合价降低,还原反应,被还原
化合价升高,氧化反应,被氧化
氧化还原反应的判断依据是: 有无化合价的升降
从得失氧角度分析一个反应是否为氧化还原反应,仅局限于有得失氧的反应,所以此种方法是有局限性、片面性的。
问题1:氧化还原反应是否一定存在氧的得失?
问题2:氧化还原反应中化合价升降存在什么样的规律?
CuSO4 + Fe Cu + FeSO4
+2 +6 -2 0 0 +2 +6 -2
2CuO + C 2Cu + CO2
高温
+2 -2
0
0
+4 -2
+3 -2
+2 -2
+4 -2
0
Fe2O3 + 3CO 2Fe + 3CO2
高温
3. 氧化还原反应中有的元素的化合价可能不变。
2. 元素化合价的升高总数与降低总数相等。
1. 氧化还原反应中元素化合价有升有降。
小结
【课堂达标】
1.下列反应是氧化还原反应的是( )
A.CaCO3+2HCl===CaCl2+H2O+CO2↑
B.CaO+H2O===Ca(OH)2
C.2KMnO4 === K2MnO4+MnO2+O2↑
D.CaCO3 === CaO+CO2↑
高温
C
【课堂达标】
2.下列反应中,属于氧化还原反应的是( )
①3Cl2+6KOH===5KCl+KClO3+3H2O
②2NO2+2NaOH===NaNO3+NaNO2+H2O
③SnCl4+2H2O===SnO2+4HCl
④NaOH+HCl===H2O+NaCl
A.①② B.②③ C.①③ D.③④
A
问题3:氧化还原反应中是什么原因导致元素的化合价的变化?
点燃
2Na+Cl2===2NaCl
点燃
H2+Cl2===2HCl
0 0 +1 -1
0 0 +1 -1
化合价升高,氧化反应
化合价升高,氧化反应
化合价降低,还原反应
化合价降低,还原反应
电子走开,我要
形成相对稳定
结构!
来!我需要电子,
我也要形成相对
稳定结构!
点燃
2Na+Cl2===2NaCl
0 0 +1 -1
化合价升高,氧化反应
化合价降低,还原反应
失去电子,
得到电子,
- e-
+e-
微观探析
点燃
H2+Cl2===2HCl
0 0 +1 -1
化合价升高,氧化反应
电子对偏离,
化合价降低,还原反应
电子对偏向,
共用电子对偏向于Cl,Cl的化合价由0价降为-1价;共用电子对偏离于H,H的化合价由0价升高到+1价,
- e-
电子的得失
电子对的偏移
电子的转移
角度三:有电子转移(得失或偏移)的反应为氧化还原反应。
小结
1.氧化还原反应是通过电子转移实现的。
2.氧化反应:失去电子或电子对偏离的反应
3.还原反应:得到电子或电子对偏向的反应
氧化还原反应概念的发展:
得氧、失氧
元素化合价升降
电子转移(电子得失或电子对偏移)
元素(宏观视角)
电子(微观视角)
局限性
特征
本质
任务二:多方法表示氧化还原反应中电子转移
双线桥法
标价态
标出变价元素的化合价。
连双线
箭头从反应物中的元素,指向生成物中的同种元素,箭头不代表电子转移方向。
标出“得到”“失去”,电子转移的数目用a×be-的形式。(a表示共有多少个原子得失电子,b表示每个原子得失电子数)。
注得失
检查
电子有得必有失,电子得失总数应相等。
+3 0 0 +3
得到2x3e-,化合价降低,被还原
失去2x3e-,化合价升高,被氧化
Fe2O3+3CO == 2Fe+3CO2
+3
+2
+4
0
Zn+H2SO4 == ZnSO4+H2↑
0
+1
0
+2
e-
失
2 e-
化合价
升高
被氧化
得
2
╳
化合价
降低
被还原
2
╳
3e-
3
2e-
化合价
降低
被还原
╳
化合价
升高
失
被氧化
得
小结:电子转移数=“得”或“失”电子数
=变价原子数×单个变价原子得(失)电子数
单线桥法
标出变价元素的化合价。
反应物中,失去电子的原子指向得到电子的原子,
即化合价升高的元素指向化合价降低 的元素。
写出转移的电子总数,用ne-表示,不写“得到”“失去”。
标价态
连单线
写总数
6 e-
+3 0 0 +3
【课堂达标】3.
4
【课堂达标】3.
【课堂达标】
4.下列化学反应中电子转移的表示方法正确的是( )
B
判断以下反应是否为氧化还原反应,并判断属于四大基本反应的哪个反应类型?
是否属于
氧化还原反应
四大基本反应类型
(1)2Mg + O2 ===2MgO
(2)2KMnO4 == K2MnO4 + MnO2 + O2↑
(3)CO2 + Na2O == Na2CO3
(4)Fe + CuSO4 == FeSO4 + Cu
(5)
(6)2NaHCO3 === Na2CO3 + CO2↑+ H2O
(7)CaCl2 + Na2CO3 == CaCO3↓+ 2NaCl
点燃
△
△
Cl2 + 2KOH == KCl + KClO + H2O
判断方法:
是否有元素
化合价的升降(特征)
√
化合
√
分解
×
化合
√
置换
√
×
分解
×
复分解
任务三:总结氧化还原反应与四大基本反应关系
化学反应
根据反应物和生成物的类别及数目
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
根据化合价升降
非氧化还原反应
氧化还原反应
非氧化还原反应
复分解反应
置换反应
化合反应
分解反应
小结
练习1.下列类型的反应中,元素化合价一定发生变化的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
C
练习2.
D
书本课后练习
一价氢、氯、钾、钠、银;二价氧、钙,镁、钡、锌;
三铝,四硅、五价磷;
说变价也不难,二三铁、二四碳、二四六硫都齐全;
铜汞二价最常见;单质元素价为零;
负一硝酸氢氧根;负二碳酸硫酸根;
负三记住磷酸根;正一价的是氨根。
常见化合价口诀
用单线桥法表示下列反应的电子转移的方向与数目。
(1)2KClO3 2KCl+3O2↑
(2)3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
(3)4NH3+5O2 4NO+6H2O
12e-
6e-
20e-
