高中化学人教版(2019)必修第一册1.2.1电解质的电离(共45张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册1.2.1电解质的电离(共45张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-14 22:17:17 | ||
图片预览





文档简介
(共45张PPT)
新人教版 化学 必修一
第一章 物质的分类及其变化
第二节 离子反应
第1课时:电解质的电离
电解质和非电解质
01
电离及电离方程式
02
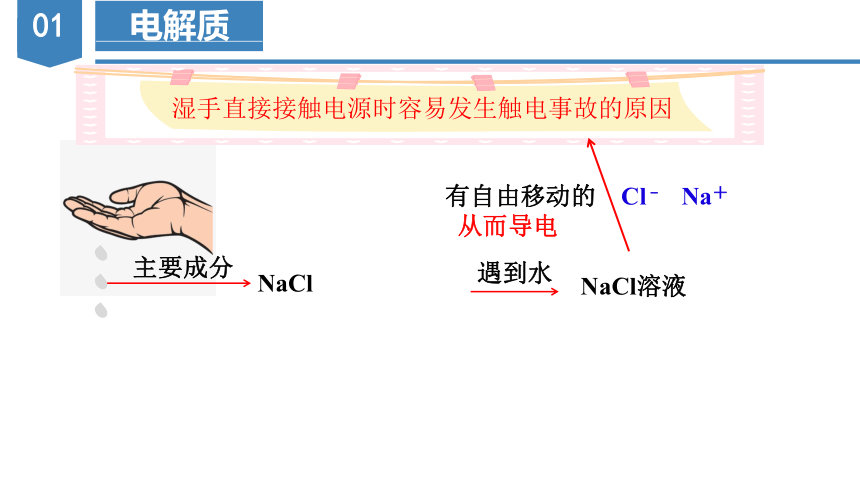
为什么湿手直接接触电源时容易发生触电事故?
只是因为有水吗?
电解质
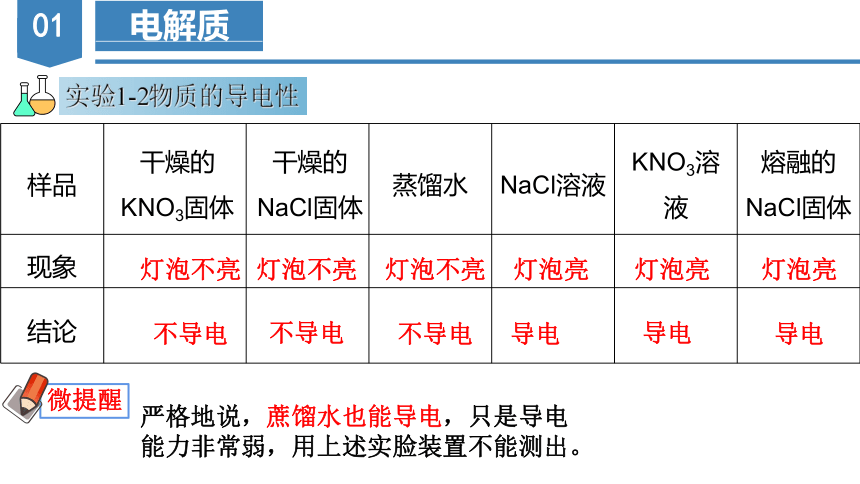
实验1-2物质的导电性
样品 干燥的KNO3固体 干燥的NaCl固体 蒸馏水 NaCl溶液 KNO3溶液 熔融的NaCl固体
现象
结论
灯泡不亮
灯泡不亮
灯泡不亮
灯泡亮
灯泡亮
不导电
不导电
不导电
导电
导电
灯泡亮
导电
严格地说,蔗馏水也能导电,只是导电能力非常弱,用上述实脸装置不能测出。
微提醒
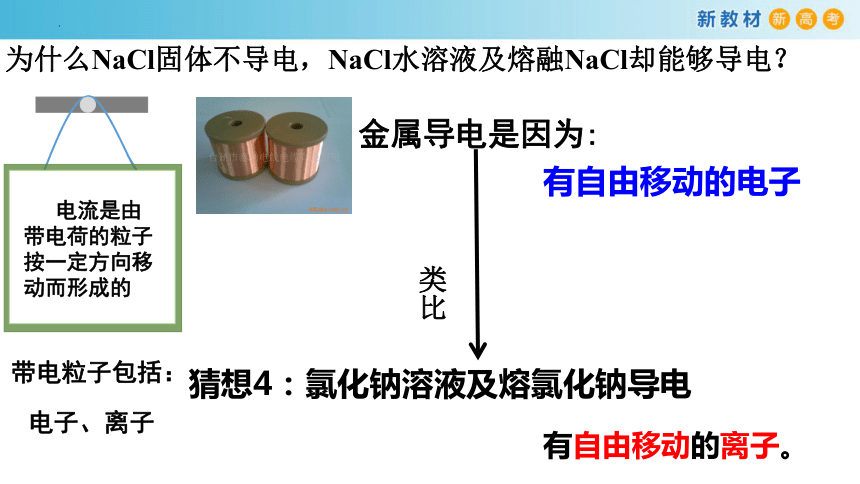
电流是由带电荷的粒子按一定方向移动而形成的
猜想4:氯化钠溶液及熔氯化钠导电
类比
有自由移动的离子。
金属导电是因为:
有自由移动的电子
带电粒子包括:
电子、离子
为什么NaCl固体不导电,NaCl水溶液及熔融NaCl却能够导电?
电解质
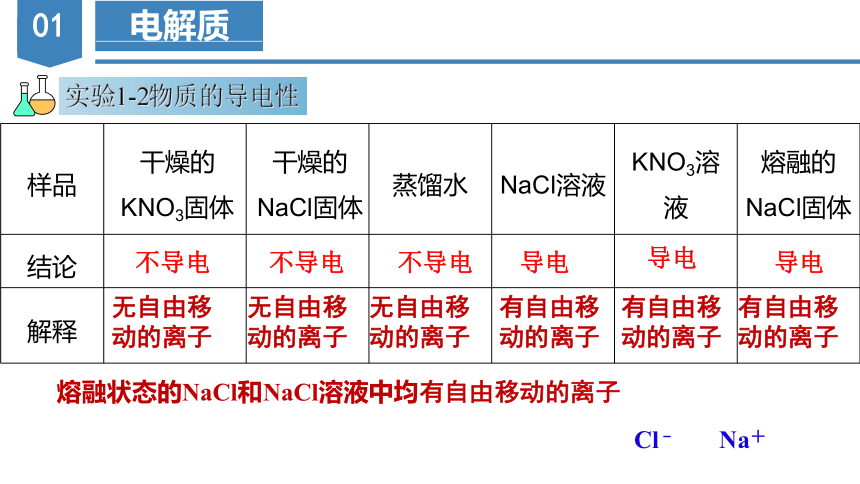
实验1-2物质的导电性
样品 干燥的KNO3固体 干燥的NaCl固体 蒸馏水 NaCl溶液 KNO3溶液 熔融的NaCl固体
结论
解释
无自由移动的离子
不导电
不导电
不导电
导电
导电
导电
无自由移动的离子
无自由移动的离子
有自由移动的离子
有自由移动的离子
有自由移动的离子
熔融状态的NaCl和NaCl溶液中均有自由移动的离子
Cl﹣ Na+
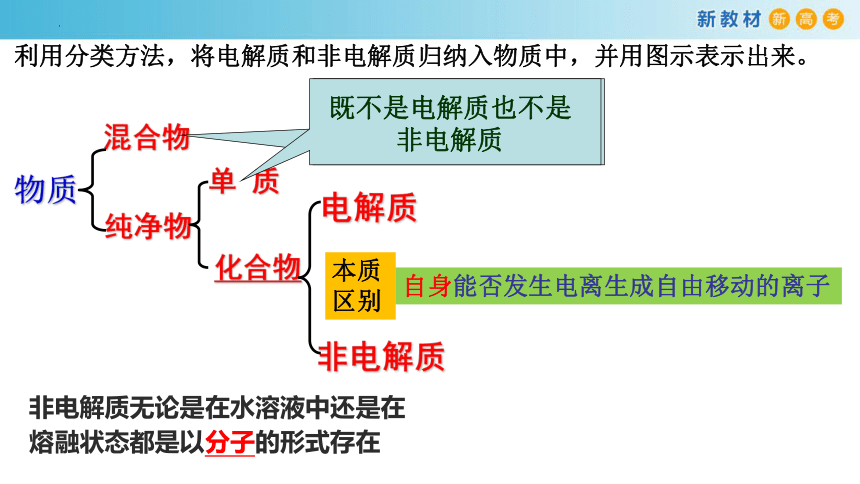
一、电解质、非电解质
在水溶液中
熔融状态下本身产生自由移动的离子而
能导电的
电解质
或
在水溶液中和
熔融状态下
均不能导电的
非电解质
条件
现象
类别
2、电解质与非电解质异同
共同点: 电解质、非电解质均指化合物(判断的前提),属于纯净物。
不同之处: 是在水溶液中或融化状态下能否导电是在水溶
电解质
NaCl
主要成分
湿手直接接触电源时容易发生触电事故的原因
遇到水
NaCl溶液
有自由移动的 Cl﹣ Na+
从而导电
电解质
非电解质
化合物
纯净物
物质
混合物
单 质
既不是电解质也不是非电解质
利用分类方法,将电解质和非电解质归纳入物质中,并用图示表示出来。
本质区别
自身能否发生电离生成自由移动的离子
非电解质无论是在水溶液中还是在熔融状态都是以分子的形式存在
电解质
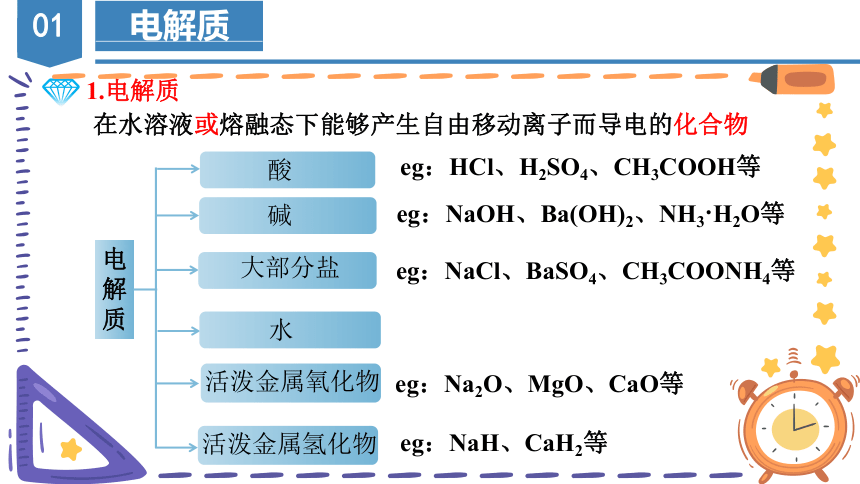
1.电解质
在水溶液或熔融态下能够产生自由移动离子而导电的化合物
电解质
酸
碱
大部分盐
水
活泼金属氧化物
活泼金属氢化物
eg:HCl、H2SO4、CH3COOH等
eg:NaOH、Ba(OH)2、NH3 H2O等
eg:NaCl、BaSO4、CH3COONH4等
eg:Na2O、MgO、CaO等
eg:NaH、CaH2等
电解质
2.非电解质
在水溶液和熔融态下均不导电的化合物
非电解质
大部分非金属氧化物
大部分有机物
部分非金属氢化物
eg:CO2、SO3、NO等
eg:CH4、C2H5OH、C6H12O6等
eg:NH3、N2H4等
电解质
强电解质:强酸、强碱、绝大多数的盐
金属氧化物
弱电解质:弱酸、弱碱、水
电解质
以氯化钠(NaCl)固体为例
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
-
+
+
-
-
+
-
Na+
Cl-
与电源正极相连的电极
与电源负极相连的电极
带相反电荷的离子间的相互作用
Na+和Cl-按一定规则紧密地排列着
离子不能自由移动
干燥的NaCl固体不导电
电解质
以氯化钠(NaCl)为例
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
Na+
Cl-
H2O
将NaCl固体加入水中
电解质
以氯化钠(NaCl)为例
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
在水分子 的作用下
将NaCl固体加入水中
电解质
以氯化钠(NaCl)为例
在水分子 的作用下
进入水中
将NaCl固体加入水中
Na+和Cl-脱离NaCl固体的表面
形成能够自由移动的水合钠离子和水合氯离子
-
+
-
-
-
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
电解质
以氯化钠(NaCl)为例
在水分子 的作用下
进入水中
将NaCl固体加入水中
Na+和Cl-脱离NaCl固体的表面
形成能够自由移动的水合钠离子和水合氯离子
-
+
-
+
与电源正极相连的电极
与电源负极相连的电极
带正电荷的水合钠离子向与电源负极相连的电极移动
当在NaCI溶液 中插入电极并接通电源
带负电荷的水合氯离子向与电源正极相连的电极移动
NaCl溶液能够导电
电解质
以氯化钠(NaCl)为例
当NaCl固体受热熔化
离子的运动随温度升高而加快
产生了能够自由移动的Na+和Cl-
与电源正极相连的电极
与电源负极相连的电极
NaCl在熔融状态能够导电
克服了离子间 的相互作用
-
+
-
+
-
+
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
电解质
以氯化钠(NaCl)为例
NaCl 在熔融状态 能够导电
干燥的NaCl固体不导电
NaCl 溶液 能够导电
电解质
溶于水或受热融化时
形成自由移动离子的过程
叫做电离
电离
电离
1.物质的电离
电解质溶于水或受热融化时形成自由移动离子的过程。
微提醒
都不是因为通电而电离
电解质溶于水时是由于水分子的作用而电离
熔融状态下是由于热能破坏化学键而电离成自由移动的离子
电离不需要通电
1.铜、石墨和食盐水都能导电,所以它们是电解质。
2.NaCl是电解质,所以NaCl晶体能导电。
3.NH3、CO2、SO2的水溶液能导电,所以它们是电解质。
4.CaCO3、BaSO4在水中溶解性很小,导电性也不好,所以是非电解质。
×
×
×
×
电解质、非电解质大前提应是化合物。
电解质不一定能导电,导电的物质也不一定是电解质。
如NaCl固体是电解质,但固态时不导电;金属导电,但不是电解质。
电解质导电必须是该化合物本身能电离出自由移动的离子而导电。
化合物是否为电解质,与溶解度的大小无关。
如BaSO4虽难溶于水,但溶于水的部分发生了电离,所以是电解质。
活动:电解质、非电解质的概念
5.纯硫酸在熔融状态下不导电,所以硫酸不是电解质。
电解质导电的条件是在水溶液或熔融状态下,两个条件具备一个即可。
硫酸溶于水形成硫酸溶液可导电
×
判断电解质的方法:
①看:物质类别是否属于化合物;
②看:条件是不是在水溶液或熔融状态下导电;
③看:化合物本身能不能发生电离。
注意点:
(1)电解质、非电解质都是化合物。
Cu是单质,K2SO4与NaCl溶液都是混合物
(2)电解质的导电条件:水溶液或熔融状态下
(3)电解质导电必须是该电解质本身电离出自由移动的离子而导电,不能是发生化学反应而生成的物质导电。如:CO2、SO2不是电解质,
(4)难溶于水的无机化合物也是电解质。 如:BaSO4、AgCl在水中溶解的部分完全电离。
(5)酸、碱、盐、水是电解质,
蔗糖、酒精等有机物、CO2、SO2、NH3等是非电解质
思维建模
判断电解质的思维流程
练习1:有下列物质:①NaOH固体;②铜丝;③HCl气体;④稀H2SO4;
⑤CO2;⑥氨水;⑦Na2CO3粉末;⑧蔗糖晶体;⑨熔融NaCl;⑩CuSO4·5H2O晶体。
(1)上述状态下可导电的是 (填序号,下同),溶于水和熔融状态下都能导电的是 。
(2)属于电解质的是 ,属于非电解质的是 。
②④⑥⑨
①⑦⑨⑩
①③⑦⑨⑩
⑤⑧
2、下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里和熔融状态时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
盐酸,NaOH溶液,NaCl固体,石墨,NaCl溶液、蔗糖溶液,酒精溶液,Cu
石墨、Cu等单质导电是由于有自由移动的电子;
盐酸、 NaCl溶液、 NaOH溶液等化合物溶液导电是由于有自由移动的离子;
【例1】下列物质中能导电的物质有哪些?为什么?
像蔗糖、酒精等物质,本身就不具备离子,所以它们是不会导电的。
定义:表示电解质电离的式子。
书写要求:为简便起见,用离子符号表示水合离子
一般情况下等号左边写电解质的化学式,右边写电离出的离子。
实例:HCl==H++Cl-;NaCl===Na++Cl-;Ba(OH)2===____________。
Ba2++2OH-
电离方程式:
(表示方法)
电离
-
+
-
-
-
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
NaCl =
Na+ + Cl-
KNO3 =
K+ + NO3-
遵循质量守恒
原子团不能拆开写
微提醒
和电荷守恒
电离方程式:
电离
H2SO4 =
HNO3 =
HCl =
2 H+ + SO42-
H+ + NO3-
H+ + Cl-
酸:
电离时生成的阳离子全部是氢离子(H+)的化合物
氢原子失去电子后,剩余1个质子构成的核,即氢离子。氢离子是“裸露”的质子,半径很小,易与水分子细合成水合氢离子,通常用H3O+表示。为了简便,也常把H3O+写作H+。
电离方程式:
电离
碱:
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物
KOH =
Ba(OH)2 =
NaOH =
K+ + OH-
Ba2+ + 2 OH-
Na+ + OH-
Na2CO3 =
BaSO4 =
CaCl2 =
NH4NO3 =
NO3-
+
NH4+
2Na+ + CO32-
Ba2+ + SO42-
Ca2+ + 2Cl-
碱:
电离时生成的金属阳离子(或铵根离子)和酸根离子(或非金属离子)的化合物
电离方程式:
电离
NaHSO4 =
NaHSO3 =
酸式盐的电离方程式
NaHCO3 =
微点拨
Na+ + H+ + SO42-
Na+ + HCO3-
Na+ + HSO3-
电离时弱酸的酸式酸根不可拆
电离方程式:
物质的电离
电离方程式书写的注意事项
1、符合客观事实:不能随意书写离子符号,要注意正确标注离子所带的电荷及其数目。
4、质量守恒:即电离方程式左右两侧元素的种类、原子或原子团的个数相等。
5、电荷守恒:即电离方程式左右两侧的正负电荷数相等,溶液呈电中性。
6、电离时弱酸的酸式酸根不可拆
2、为简便起见,用离子符号表示水合离子。等号左边写电解质的化学式,右边写电离出的离子。
3、固定原子团不能拆开写。
C
3.下列电离方程式正确的是( )A.MgSO4=Mg+2+SO4-2B.Ba(OH)2=Ba2++OH2-C.Al2(SO4)3=2Al3++3SO42-D.Ca(NO3)2=Ca2++NO3-
4.判断下列物质在水溶液中的电离方程式是否正确,不正确的加以改正。
_______________________________
(2)Ba(OH)2===Ba2++(OH-)2
____________________________________
__________________________________
______________________________________
不正确;改正:Ba(OH)2===Ba2++2OH-
1.下列物质________________________________________能导电?
________________________________________是电解质?
________________________________________是非电解质?
(1)金属铜 (2)碳棒 (3)O2 (4)H2SO4 (5)液态HCl (6)CH3COOH
(7)葡萄糖 (8)固态NaCl (9)CaCO3固体 (10)CuSO4·5H2O
(11)熔融状态的KNO3 (12)KOH水溶液 (13)酒精水溶液
(14)盐酸 (15)CaO (16)CO2 (17)H2O (18)NH3
(1)、(2)、(11)、(12)、(14)、(17)
(4)、(5)、(6)、(8)、(9)、(10)、(11)、(15)
(7)、(16)、(18)
BC
2.下面叙述正确的是________A.NaCl溶液能导电,所以NaCl溶液是电解质
B.固态NaCl不导电,但NaCl是电解质
C.HCl水溶液能导电,所以HCl是电解质
D.SO3溶于水能导电,所以SO3是电解质
E.Cu能导电,所以是电解质
F.BaSO4的水溶液不能导电,所以BaSO4是非电解质
【例1】CO2、NH3等溶于水能导电,它们是电解质吗?
判断依据:化合物本身能否电离出离子
CO2水溶液中,CO2与水反应生成H2CO3。离子是由H2CO3电离的,所以CO2不是电解质。与CO2 相似的还有SO2、 SO3 、P2O5等。
结论:二氧化碳、氨气等不是电解质。
氨水中的铵根离子,氢氧根离子是NH3· H2O电离的,所以氨气也不是电解质。
与导电性、溶解性无关。
非电解质
电解质与化合物之间的关系
电解质是本身能电离的化合物,不是单质也不是混合物;
能导电的物质不一定是电解质;
电解质不一定能导电,电解质必须在水溶液或熔化状态下才能导电;
电解质能导电,但导电的本质是它本身电离出自由移动的离子而导电,不是它与其他物质发生反应后的物质导电。
物质的电离
总结
铜丝、NaCl溶液和盐酸都能导电,所以三者都是电解质( )
NH3、CO2的水溶液能导电,所以NH3、CO2均是电解质( )
NaCl是电解质,所以NaCl固体可以导电( )
BaSO4难溶于水,其水溶液几乎不导电,所以BaSO4不是电解质( )
×
×
×
×
【例1】请同学们认真思考并判断正误:
用水将一组化合物溶解,制成电解质饮料。此饮料可补充人体新陈代谢的消耗。其电解质成分有钠离子、钾离子、镁离子、氯离子、硫酸根离子、磷酸根离子、柠檬酸盐、蔗糖、葡萄糖、维生素C及维生素B6。
电解质饮料
3.现有中学化学中常见的八种物质:
①固体氢氧化钡 ②石墨碳棒 ③纯醋酸 ④液态氯化氢 ⑤硫酸氢钾固体 ⑥熔融氯化钠 ⑦蔗糖 ⑧碳酸钠粉末
请用序号填空:
(1)上述状态下可导电的是 ,属于非电解质的是 。
(2)属于酸的是 ,属于碱的是 ,属于盐的是 。
(3)写出①④⑤⑧在水溶液中的电离方程式:
① ; ④ ;
⑤ ; ⑧ 。
②⑥
⑦
③④
①
⑤⑥⑧
Ba(OH)2===Ba2++2OH-
HCl=== H++Cl-
KHSO4===K++H++SO42-
Na2CO3===2Na++CO32-
5.某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论正确的是( )
A.硝酸钾固体不是电解质
B.硝酸钾溶液是电解质
C.硝酸钾在水溶液中电离出了可以自由移动的离子
D.在硝酸钾溶液中,水电离出了大量的离子
C
电
解
质
A
非电解质
B
导电的物质
C
电离
D
电离方程式
E
第1课时 电解质的电离
新人教版 化学 必修一
新人教版 化学 必修一
第一章 物质的分类及其变化
第二节 离子反应
第1课时:电解质的电离
电解质和非电解质
01
电离及电离方程式
02
为什么湿手直接接触电源时容易发生触电事故?
只是因为有水吗?
电解质
实验1-2物质的导电性
样品 干燥的KNO3固体 干燥的NaCl固体 蒸馏水 NaCl溶液 KNO3溶液 熔融的NaCl固体
现象
结论
灯泡不亮
灯泡不亮
灯泡不亮
灯泡亮
灯泡亮
不导电
不导电
不导电
导电
导电
灯泡亮
导电
严格地说,蔗馏水也能导电,只是导电能力非常弱,用上述实脸装置不能测出。
微提醒
电流是由带电荷的粒子按一定方向移动而形成的
猜想4:氯化钠溶液及熔氯化钠导电
类比
有自由移动的离子。
金属导电是因为:
有自由移动的电子
带电粒子包括:
电子、离子
为什么NaCl固体不导电,NaCl水溶液及熔融NaCl却能够导电?
电解质
实验1-2物质的导电性
样品 干燥的KNO3固体 干燥的NaCl固体 蒸馏水 NaCl溶液 KNO3溶液 熔融的NaCl固体
结论
解释
无自由移动的离子
不导电
不导电
不导电
导电
导电
导电
无自由移动的离子
无自由移动的离子
有自由移动的离子
有自由移动的离子
有自由移动的离子
熔融状态的NaCl和NaCl溶液中均有自由移动的离子
Cl﹣ Na+
一、电解质、非电解质
在水溶液中
熔融状态下本身产生自由移动的离子而
能导电的
电解质
或
在水溶液中和
熔融状态下
均不能导电的
非电解质
条件
现象
类别
2、电解质与非电解质异同
共同点: 电解质、非电解质均指化合物(判断的前提),属于纯净物。
不同之处: 是在水溶液中或融化状态下能否导电是在水溶
电解质
NaCl
主要成分
湿手直接接触电源时容易发生触电事故的原因
遇到水
NaCl溶液
有自由移动的 Cl﹣ Na+
从而导电
电解质
非电解质
化合物
纯净物
物质
混合物
单 质
既不是电解质也不是非电解质
利用分类方法,将电解质和非电解质归纳入物质中,并用图示表示出来。
本质区别
自身能否发生电离生成自由移动的离子
非电解质无论是在水溶液中还是在熔融状态都是以分子的形式存在
电解质
1.电解质
在水溶液或熔融态下能够产生自由移动离子而导电的化合物
电解质
酸
碱
大部分盐
水
活泼金属氧化物
活泼金属氢化物
eg:HCl、H2SO4、CH3COOH等
eg:NaOH、Ba(OH)2、NH3 H2O等
eg:NaCl、BaSO4、CH3COONH4等
eg:Na2O、MgO、CaO等
eg:NaH、CaH2等
电解质
2.非电解质
在水溶液和熔融态下均不导电的化合物
非电解质
大部分非金属氧化物
大部分有机物
部分非金属氢化物
eg:CO2、SO3、NO等
eg:CH4、C2H5OH、C6H12O6等
eg:NH3、N2H4等
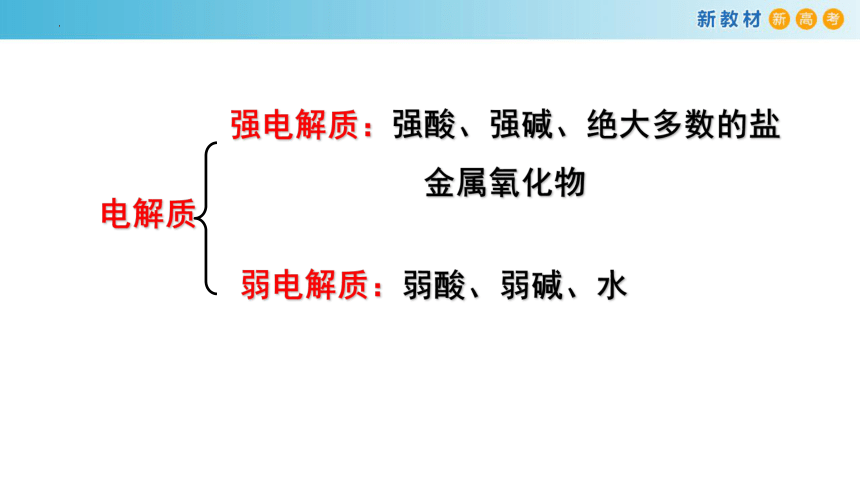
电解质
强电解质:强酸、强碱、绝大多数的盐
金属氧化物
弱电解质:弱酸、弱碱、水
电解质
以氯化钠(NaCl)固体为例
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
-
+
+
-
-
+
-
Na+
Cl-
与电源正极相连的电极
与电源负极相连的电极
带相反电荷的离子间的相互作用
Na+和Cl-按一定规则紧密地排列着
离子不能自由移动
干燥的NaCl固体不导电
电解质
以氯化钠(NaCl)为例
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
Na+
Cl-
H2O
将NaCl固体加入水中
电解质
以氯化钠(NaCl)为例
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
在水分子 的作用下
将NaCl固体加入水中
电解质
以氯化钠(NaCl)为例
在水分子 的作用下
进入水中
将NaCl固体加入水中
Na+和Cl-脱离NaCl固体的表面
形成能够自由移动的水合钠离子和水合氯离子
-
+
-
-
-
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
电解质
以氯化钠(NaCl)为例
在水分子 的作用下
进入水中
将NaCl固体加入水中
Na+和Cl-脱离NaCl固体的表面
形成能够自由移动的水合钠离子和水合氯离子
-
+
-
+
与电源正极相连的电极
与电源负极相连的电极
带正电荷的水合钠离子向与电源负极相连的电极移动
当在NaCI溶液 中插入电极并接通电源
带负电荷的水合氯离子向与电源正极相连的电极移动
NaCl溶液能够导电
电解质
以氯化钠(NaCl)为例
当NaCl固体受热熔化
离子的运动随温度升高而加快
产生了能够自由移动的Na+和Cl-
与电源正极相连的电极
与电源负极相连的电极
NaCl在熔融状态能够导电
克服了离子间 的相互作用
-
+
-
+
-
+
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
电解质
以氯化钠(NaCl)为例
NaCl 在熔融状态 能够导电
干燥的NaCl固体不导电
NaCl 溶液 能够导电
电解质
溶于水或受热融化时
形成自由移动离子的过程
叫做电离
电离
电离
1.物质的电离
电解质溶于水或受热融化时形成自由移动离子的过程。
微提醒
都不是因为通电而电离
电解质溶于水时是由于水分子的作用而电离
熔融状态下是由于热能破坏化学键而电离成自由移动的离子
电离不需要通电
1.铜、石墨和食盐水都能导电,所以它们是电解质。
2.NaCl是电解质,所以NaCl晶体能导电。
3.NH3、CO2、SO2的水溶液能导电,所以它们是电解质。
4.CaCO3、BaSO4在水中溶解性很小,导电性也不好,所以是非电解质。
×
×
×
×
电解质、非电解质大前提应是化合物。
电解质不一定能导电,导电的物质也不一定是电解质。
如NaCl固体是电解质,但固态时不导电;金属导电,但不是电解质。
电解质导电必须是该化合物本身能电离出自由移动的离子而导电。
化合物是否为电解质,与溶解度的大小无关。
如BaSO4虽难溶于水,但溶于水的部分发生了电离,所以是电解质。
活动:电解质、非电解质的概念
5.纯硫酸在熔融状态下不导电,所以硫酸不是电解质。
电解质导电的条件是在水溶液或熔融状态下,两个条件具备一个即可。
硫酸溶于水形成硫酸溶液可导电
×
判断电解质的方法:
①看:物质类别是否属于化合物;
②看:条件是不是在水溶液或熔融状态下导电;
③看:化合物本身能不能发生电离。
注意点:
(1)电解质、非电解质都是化合物。
Cu是单质,K2SO4与NaCl溶液都是混合物
(2)电解质的导电条件:水溶液或熔融状态下
(3)电解质导电必须是该电解质本身电离出自由移动的离子而导电,不能是发生化学反应而生成的物质导电。如:CO2、SO2不是电解质,
(4)难溶于水的无机化合物也是电解质。 如:BaSO4、AgCl在水中溶解的部分完全电离。
(5)酸、碱、盐、水是电解质,
蔗糖、酒精等有机物、CO2、SO2、NH3等是非电解质
思维建模
判断电解质的思维流程
练习1:有下列物质:①NaOH固体;②铜丝;③HCl气体;④稀H2SO4;
⑤CO2;⑥氨水;⑦Na2CO3粉末;⑧蔗糖晶体;⑨熔融NaCl;⑩CuSO4·5H2O晶体。
(1)上述状态下可导电的是 (填序号,下同),溶于水和熔融状态下都能导电的是 。
(2)属于电解质的是 ,属于非电解质的是 。
②④⑥⑨
①⑦⑨⑩
①③⑦⑨⑩
⑤⑧
2、下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里和熔融状态时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
盐酸,NaOH溶液,NaCl固体,石墨,NaCl溶液、蔗糖溶液,酒精溶液,Cu
石墨、Cu等单质导电是由于有自由移动的电子;
盐酸、 NaCl溶液、 NaOH溶液等化合物溶液导电是由于有自由移动的离子;
【例1】下列物质中能导电的物质有哪些?为什么?
像蔗糖、酒精等物质,本身就不具备离子,所以它们是不会导电的。
定义:表示电解质电离的式子。
书写要求:为简便起见,用离子符号表示水合离子
一般情况下等号左边写电解质的化学式,右边写电离出的离子。
实例:HCl==H++Cl-;NaCl===Na++Cl-;Ba(OH)2===____________。
Ba2++2OH-
电离方程式:
(表示方法)
电离
-
+
-
-
-
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
NaCl =
Na+ + Cl-
KNO3 =
K+ + NO3-
遵循质量守恒
原子团不能拆开写
微提醒
和电荷守恒
电离方程式:
电离
H2SO4 =
HNO3 =
HCl =
2 H+ + SO42-
H+ + NO3-
H+ + Cl-
酸:
电离时生成的阳离子全部是氢离子(H+)的化合物
氢原子失去电子后,剩余1个质子构成的核,即氢离子。氢离子是“裸露”的质子,半径很小,易与水分子细合成水合氢离子,通常用H3O+表示。为了简便,也常把H3O+写作H+。
电离方程式:
电离
碱:
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物
KOH =
Ba(OH)2 =
NaOH =
K+ + OH-
Ba2+ + 2 OH-
Na+ + OH-
Na2CO3 =
BaSO4 =
CaCl2 =
NH4NO3 =
NO3-
+
NH4+
2Na+ + CO32-
Ba2+ + SO42-
Ca2+ + 2Cl-
碱:
电离时生成的金属阳离子(或铵根离子)和酸根离子(或非金属离子)的化合物
电离方程式:
电离
NaHSO4 =
NaHSO3 =
酸式盐的电离方程式
NaHCO3 =
微点拨
Na+ + H+ + SO42-
Na+ + HCO3-
Na+ + HSO3-
电离时弱酸的酸式酸根不可拆
电离方程式:
物质的电离
电离方程式书写的注意事项
1、符合客观事实:不能随意书写离子符号,要注意正确标注离子所带的电荷及其数目。
4、质量守恒:即电离方程式左右两侧元素的种类、原子或原子团的个数相等。
5、电荷守恒:即电离方程式左右两侧的正负电荷数相等,溶液呈电中性。
6、电离时弱酸的酸式酸根不可拆
2、为简便起见,用离子符号表示水合离子。等号左边写电解质的化学式,右边写电离出的离子。
3、固定原子团不能拆开写。
C
3.下列电离方程式正确的是( )A.MgSO4=Mg+2+SO4-2B.Ba(OH)2=Ba2++OH2-C.Al2(SO4)3=2Al3++3SO42-D.Ca(NO3)2=Ca2++NO3-
4.判断下列物质在水溶液中的电离方程式是否正确,不正确的加以改正。
_______________________________
(2)Ba(OH)2===Ba2++(OH-)2
____________________________________
__________________________________
______________________________________
不正确;改正:Ba(OH)2===Ba2++2OH-
1.下列物质________________________________________能导电?
________________________________________是电解质?
________________________________________是非电解质?
(1)金属铜 (2)碳棒 (3)O2 (4)H2SO4 (5)液态HCl (6)CH3COOH
(7)葡萄糖 (8)固态NaCl (9)CaCO3固体 (10)CuSO4·5H2O
(11)熔融状态的KNO3 (12)KOH水溶液 (13)酒精水溶液
(14)盐酸 (15)CaO (16)CO2 (17)H2O (18)NH3
(1)、(2)、(11)、(12)、(14)、(17)
(4)、(5)、(6)、(8)、(9)、(10)、(11)、(15)
(7)、(16)、(18)
BC
2.下面叙述正确的是________A.NaCl溶液能导电,所以NaCl溶液是电解质
B.固态NaCl不导电,但NaCl是电解质
C.HCl水溶液能导电,所以HCl是电解质
D.SO3溶于水能导电,所以SO3是电解质
E.Cu能导电,所以是电解质
F.BaSO4的水溶液不能导电,所以BaSO4是非电解质
【例1】CO2、NH3等溶于水能导电,它们是电解质吗?
判断依据:化合物本身能否电离出离子
CO2水溶液中,CO2与水反应生成H2CO3。离子是由H2CO3电离的,所以CO2不是电解质。与CO2 相似的还有SO2、 SO3 、P2O5等。
结论:二氧化碳、氨气等不是电解质。
氨水中的铵根离子,氢氧根离子是NH3· H2O电离的,所以氨气也不是电解质。
与导电性、溶解性无关。
非电解质
电解质与化合物之间的关系
电解质是本身能电离的化合物,不是单质也不是混合物;
能导电的物质不一定是电解质;
电解质不一定能导电,电解质必须在水溶液或熔化状态下才能导电;
电解质能导电,但导电的本质是它本身电离出自由移动的离子而导电,不是它与其他物质发生反应后的物质导电。
物质的电离
总结
铜丝、NaCl溶液和盐酸都能导电,所以三者都是电解质( )
NH3、CO2的水溶液能导电,所以NH3、CO2均是电解质( )
NaCl是电解质,所以NaCl固体可以导电( )
BaSO4难溶于水,其水溶液几乎不导电,所以BaSO4不是电解质( )
×
×
×
×
【例1】请同学们认真思考并判断正误:
用水将一组化合物溶解,制成电解质饮料。此饮料可补充人体新陈代谢的消耗。其电解质成分有钠离子、钾离子、镁离子、氯离子、硫酸根离子、磷酸根离子、柠檬酸盐、蔗糖、葡萄糖、维生素C及维生素B6。
电解质饮料
3.现有中学化学中常见的八种物质:
①固体氢氧化钡 ②石墨碳棒 ③纯醋酸 ④液态氯化氢 ⑤硫酸氢钾固体 ⑥熔融氯化钠 ⑦蔗糖 ⑧碳酸钠粉末
请用序号填空:
(1)上述状态下可导电的是 ,属于非电解质的是 。
(2)属于酸的是 ,属于碱的是 ,属于盐的是 。
(3)写出①④⑤⑧在水溶液中的电离方程式:
① ; ④ ;
⑤ ; ⑧ 。
②⑥
⑦
③④
①
⑤⑥⑧
Ba(OH)2===Ba2++2OH-
HCl=== H++Cl-
KHSO4===K++H++SO42-
Na2CO3===2Na++CO32-
5.某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论正确的是( )
A.硝酸钾固体不是电解质
B.硝酸钾溶液是电解质
C.硝酸钾在水溶液中电离出了可以自由移动的离子
D.在硝酸钾溶液中,水电离出了大量的离子
C
电
解
质
A
非电解质
B
导电的物质
C
电离
D
电离方程式
E
第1课时 电解质的电离
新人教版 化学 必修一
