2022-2023学年新密第一高级中学高一第一学期第一次月考化学试卷(含答案)
文档属性
| 名称 | 2022-2023学年新密第一高级中学高一第一学期第一次月考化学试卷(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 110.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-15 15:29:16 | ||
图片预览



文档简介
2022-2023学年新密一高高一
第一学期第一次月考化学试卷
可能用到的相对原子质量:C-12 H-1 0-16 K-39 Cl-35.5 Mg-24 Ca-40 Na-23 N-14 S-32 Mn-55
一,选择题(18x3=54分 )
1.古诗词是历代文人为我们留下的宝贵精神财富。下列诗句中只涉及物理变化的是( )
A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干
C.只要功夫深,铁杵磨成针 D.爆竹声中一岁除,春风送暖入屠苏
2.下雪时,常用融雪剂清理路面,醋酸钾(CH3COOK)是效果较好的融雪剂,下列关于1mol CH3COOK的叙述正确的是( )
A.摩尔是国际单位制中七个基本物理量之一 B.CH3COOK的摩尔质量为98g
C.I mol CH3COOK 含有2 mol 氧 D.Imol CH3COOK 含有3x6.02x1023个H
3.下列说法中正确的是( )
A漂白粉是纯净物,漂白液是混合物
漂白粉中含有次氯酸,所以漂白粉能使染料等有机色素褪色
C.工业上将氯气通入澄清石灰水制取漂白粉
D,次氯酸能杀死病菌,所以氯气可用于自来水的消毒
4.下列说法中正确的是( )
①钠在空气中燃烧生成白色的氧化钠 ②钠投入硫酸铜溶液中有红色粉末产生 ③过氧化钠可在潜水艇面具中作供氧剂 ④铁丝在氯气中燃烧生成红棕色的FeC13
⑤钠、氢气在氯气中燃烧都能产生白烟
A.①② B. ③④ C. ②③ D.④⑤
5.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是( )
序号 ① ② ③ ④ ⑤
甲 物质 微粒数 标准状况下气体摩尔体积 固体体积 溶液的 质量分数 非标准状况下物质的质量
乙 阿伏加 德罗常 标准状况下气体体积 固体 密度 溶液 的体积 物质的摩尔质量
A.②③④ B.③④⑤ C.③④ D. ③
6.如图是某溶液在稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线图,根据图中的数据分析得出V值等于( )
A.4 B.3 C.2 D. 5
如图装置,试管中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水。将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管 b的水中,将发现的现象是( )
A.U形管内红水褪色 B.试管内溶液变红 C.气球a被吹大 D.U形管水位:d8.某化学兴趣小组利用MnO2和浓HC1及如图装置制备Cl2下列分析中不正确的是( )
A.A中可用分液漏斗代替长颈漏斗 B.A中缺少加热装置
C.B中盛放的NaOH 溶液可以净化 Cl2
D.D中的导管口若连接倒置漏斗可防止倒吸
9.下列叙述中正确的是()
①标准状况下,1L HCl和1L H2O 的物质的量相同;
②标准状况下,1 g H 和 14 g N 的体积相同;
③28 g CO 的体积为 22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体物质的物质的最越大,则压强越大:
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. ①②③ B.②⑤⑥ C.②③⑧ D. ④⑤⑥
10将钠、镁、铝各0.3mol分别放入100mL 1mol/L的盐酸中,同温同压下产生的气体体积比是( )
A.1:2:3 B.3:1:1 C.6:3:2 D.1:1:A
11若m g Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则m g Na 与氧气反应,生成固体的质量为( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.6)g ⑤(m+1.4)g
仅①④ B.仅①⑤ C.仅③④ D.①②③④⑤
12.下列物质能使干燥的蓝色石器试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制氯水 ④敞口久置的氧水 ⑤盐酸 ⑥用盐酸酸化的漂白粉溶液
A.①②③ B.①②③⑥ C. ③ D. ③④⑥
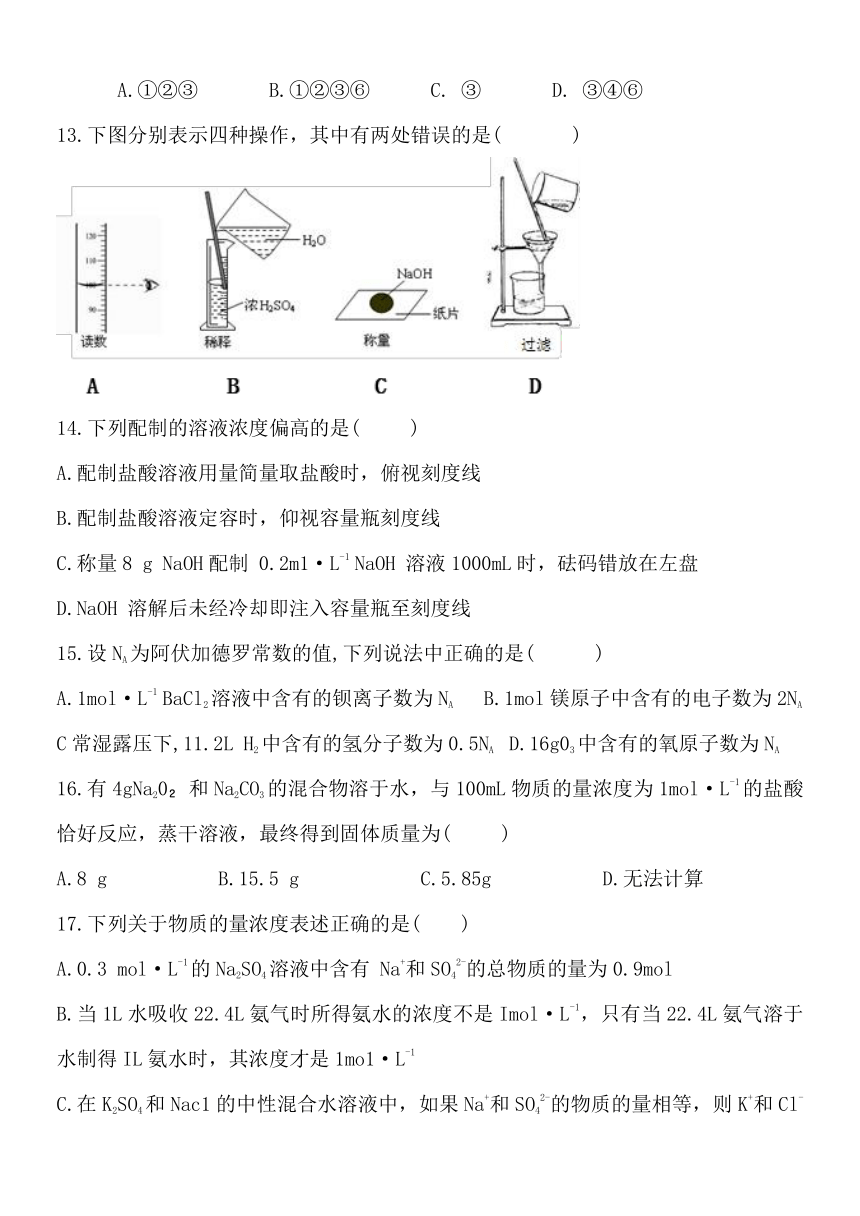
13.下图分别表示四种操作,其中有两处错误的是( )
14.下列配制的溶液浓度偏高的是( )
A.配制盐酸溶液用量简量取盐酸时,俯视刻度线
B.配制盐酸溶液定容时,仰视容量瓶刻度线
C.称量8 g NaOH配制 0.2m1·L-1 NaOH 溶液1000mL时,砝码错放在左盘
D.NaOH 溶解后未经冷却即注入容量瓶至刻度线
15.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1mol·L-1 BaCl2溶液中含有的钡离子数为NA B.1mol镁原子中含有的电子数为2NA
C常湿露压下,11.2L H2中含有的氢分子数为0.5NA D.16g03中含有的氧原子数为NA
16.有4gNa20 和Na2CO3的混合物溶于水,与100mL物质的量浓度为1mol·L-1的盐酸恰好反应,蒸干溶液,最终得到固体质量为( )
A.8 g B.15.5 g C.5.85g D.无法计算
17.下列关于物质的量浓度表述正确的是( )
A.0.3 mol·L-1的Na2SO4溶液中含有 Na+和SO42-的总物质的量为0.9mol
B.当1L水吸收22.4L氨气时所得氨水的浓度不是Imol·L-1,只有当22.4L氨气溶于水制得IL氨水时,其浓度才是1mo1·L-1
C.在K2SO4和Nac1的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D.10℃时,0.35mol·L-1的KC1饱和溶液100mL蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35mol·L-1
18.同温、同压下,某容器充满O2重116g若充满CO2重122g现充满某气体重114g,则该气体的相对分子质量为( )
A.28 B.60 C.32 D.44
二,非选择题
(10分)如右图A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。已知A在空气中燃烧生成淡黄色固体(部分产物已略去)。
请填写下列空白:
(1)写出化学式: A 、B___ 、C_______ 、D .
(2)以上反应中属于置换反应的有__ (填写编号)。
(3)写出下列转化的化学方程式:
A C_ ;
B D_ ·
20.(8分)在0.2 L 由 NaCl、MgCl2、CaCI2组成的混合液中, 部分离子浓度大小如图所示,回答下列问题:
(1)该混合液中,NaCl的物质的量为____mol,含溶质MgCl2的质量为___g.
(2)该混合液中CaCl2的物质的量为_______mol,将该温合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 mol·L-1。
21.(14分)实验室需要0.1mol·L-1 NaOH 溶液 450 mL 和0.5 mol·L-1 硫酸溶液 500 mL。根据这两种溶液的配制情况回答下列问题
(1)如图所示的仪器中配制溶液肯定不需要的是__ (填序号),配制上述溶液还需用到的玻璃仪器是_ (填仪器名称)。
(2)配制0.1mol·L-1 NaOH 溶液操作步骤如下:
①把称量好的NaOH固体放入小烧中,加量蒸馏水溶解;
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中:
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒 2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为___ (填序号)。
根据计算用托盘天平称取NaOH 的质量为__ g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度_ _0.10mol·L-1 (填“大于”“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度__ 0.10mol·L-1
根据计算得知,所需质量分数为98%、密度为1.84g· cm-3的浓硫酸的体积为
mL(计算结果保留一位小数)。如果实验室有10 ml、15 mL、20 ml、50 mL 的量简,应选用 mL的量筒最好。
(14分)下图表示在没有通风橱时制取纯净的氯气时设计的装置图,图中A、B 是可控制的弹簧铁夹。
烧杯中盛放的液体是_ ,其作用是__ ,并写出原理方程式
水槽中盛放的液是_ .
简述操作过程(对试管夹A/B的操作):(从氯气已经产生开始)在收集氯气之前,应 当氯气纯度合乎要求时,应 当氨气收集完毕时,应 。
将8.7gMnO2与含HCl 14.6g的浓盐酸共热制Cl2,甲同学认为可制得Cl2 7.1g,乙同学认为制得Cl2;的质量小于7.1 g,你认为____(填“甲”或“乙”)同学正确,原因是 。
2022-2023学年新密一高高一
第一学期第一次月考化学试卷答案
选择题
1-5 CDDBC 6-10 ACCBB 11-15 DCBDD 16-18 CDA
二.非选择题
19.(1)Na Na2O2 NaOH; Na2CO3
(2)②;
(3)2Na + 2H2O = 2NaOH + H2↑; 2Na2O2 + CO2 = 2Na2CO3 +02
【解析】A为一种常见的单质,已知A在空气中燃烧生成淡黄色固体,则A为Na,B、C、D、E是含有A元素的常见化合物,钠在氧气中点燃生成B为Na2O2,过氧化钠与二氧化碳反应生成D为NazCO3,钠与水反应生成C为NaOH,C与过量的二氧化碳反应生成E为NaHCO3,碳酸氢钠受热分解生成碳酸钠,符合各物质的转化关系,
(1)根据上面的分析可知,A为Na,B为 Na2O2 ,C为NaOH,D为Na2CO3
(2)根据上面的分析可知,以上反应中只有钠与水生成氢氧化钠和氢气是一种单子和一种化合物反应生成另一种单质和另一种化合物的反应,故属于置换反应的为②
(3)略
20.(1)0.2 95 (2)0.1 0.1 (3)0.6
21.答案:(1)A、C 烧杯、玻璃棒
(2)①②④③⑤
(3)2.0 等于 大于
(4)13.6 15
【解析】(1)配制溶液用不到圆底烧瓶和分液漏斗。
(2)配制NaOH溶液的步骤为称量→溶解→转移→洗涤→定容→摇匀。
(3)必须用500mL的容量瓶来配制0.10mol·L-1NaOH溶液,故需要称取 NaOH的质量为010mol·L-1 x 05L x 40g·mol-1 =2.0g。容量瓶未干燥不影响所配制溶液的浓度;未等溶液冷却就定容会导致冷却后溶液的体积变小,浓度变大。
(4)设需要浓硫酸的体积为V,184g· cm-3 xV x 98% = 0.50g·mol-1 x 0.5L x 98g·mol-1, V≈13.6mL应选用15 mL的量筒。
22.(1)NaOH溶液 吸收多余的Cl2 饱和食盐水
(2)打开B夹,关闭A夹 打开A夹,关闭B夹 关闭A夹,打开B夹
(3)乙 ①浓盐酸易挥发②随着反应进行,浓盐酸浓度会降低,稀盐酸将不再反应
【解析】:用饱和食盐水可洗去Cl2中混有的HCI,又使Cl2损失较少,故可用排饱和食盐水法收集Cl2。处理制Cl2的尾气最好的试剂是强碱溶液。由于浓盐酸会挥发,稀盐酸不能反应,故用浓盐酸制Cl2时,HCI不能完全反应。
第一学期第一次月考化学试卷
可能用到的相对原子质量:C-12 H-1 0-16 K-39 Cl-35.5 Mg-24 Ca-40 Na-23 N-14 S-32 Mn-55
一,选择题(18x3=54分 )
1.古诗词是历代文人为我们留下的宝贵精神财富。下列诗句中只涉及物理变化的是( )
A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干
C.只要功夫深,铁杵磨成针 D.爆竹声中一岁除,春风送暖入屠苏
2.下雪时,常用融雪剂清理路面,醋酸钾(CH3COOK)是效果较好的融雪剂,下列关于1mol CH3COOK的叙述正确的是( )
A.摩尔是国际单位制中七个基本物理量之一 B.CH3COOK的摩尔质量为98g
C.I mol CH3COOK 含有2 mol 氧 D.Imol CH3COOK 含有3x6.02x1023个H
3.下列说法中正确的是( )
A漂白粉是纯净物,漂白液是混合物
漂白粉中含有次氯酸,所以漂白粉能使染料等有机色素褪色
C.工业上将氯气通入澄清石灰水制取漂白粉
D,次氯酸能杀死病菌,所以氯气可用于自来水的消毒
4.下列说法中正确的是( )
①钠在空气中燃烧生成白色的氧化钠 ②钠投入硫酸铜溶液中有红色粉末产生 ③过氧化钠可在潜水艇面具中作供氧剂 ④铁丝在氯气中燃烧生成红棕色的FeC13
⑤钠、氢气在氯气中燃烧都能产生白烟
A.①② B. ③④ C. ②③ D.④⑤
5.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是( )
序号 ① ② ③ ④ ⑤
甲 物质 微粒数 标准状况下气体摩尔体积 固体体积 溶液的 质量分数 非标准状况下物质的质量
乙 阿伏加 德罗常 标准状况下气体体积 固体 密度 溶液 的体积 物质的摩尔质量
A.②③④ B.③④⑤ C.③④ D. ③
6.如图是某溶液在稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线图,根据图中的数据分析得出V值等于( )
A.4 B.3 C.2 D. 5
如图装置,试管中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水。将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管 b的水中,将发现的现象是( )
A.U形管内红水褪色 B.试管内溶液变红 C.气球a被吹大 D.U形管水位:d
A.A中可用分液漏斗代替长颈漏斗 B.A中缺少加热装置
C.B中盛放的NaOH 溶液可以净化 Cl2
D.D中的导管口若连接倒置漏斗可防止倒吸
9.下列叙述中正确的是()
①标准状况下,1L HCl和1L H2O 的物质的量相同;
②标准状况下,1 g H 和 14 g N 的体积相同;
③28 g CO 的体积为 22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体物质的物质的最越大,则压强越大:
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. ①②③ B.②⑤⑥ C.②③⑧ D. ④⑤⑥
10将钠、镁、铝各0.3mol分别放入100mL 1mol/L的盐酸中,同温同压下产生的气体体积比是( )
A.1:2:3 B.3:1:1 C.6:3:2 D.1:1:A
11若m g Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则m g Na 与氧气反应,生成固体的质量为( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.6)g ⑤(m+1.4)g
仅①④ B.仅①⑤ C.仅③④ D.①②③④⑤
12.下列物质能使干燥的蓝色石器试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制氯水 ④敞口久置的氧水 ⑤盐酸 ⑥用盐酸酸化的漂白粉溶液
A.①②③ B.①②③⑥ C. ③ D. ③④⑥
13.下图分别表示四种操作,其中有两处错误的是( )
14.下列配制的溶液浓度偏高的是( )
A.配制盐酸溶液用量简量取盐酸时,俯视刻度线
B.配制盐酸溶液定容时,仰视容量瓶刻度线
C.称量8 g NaOH配制 0.2m1·L-1 NaOH 溶液1000mL时,砝码错放在左盘
D.NaOH 溶解后未经冷却即注入容量瓶至刻度线
15.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1mol·L-1 BaCl2溶液中含有的钡离子数为NA B.1mol镁原子中含有的电子数为2NA
C常湿露压下,11.2L H2中含有的氢分子数为0.5NA D.16g03中含有的氧原子数为NA
16.有4gNa20 和Na2CO3的混合物溶于水,与100mL物质的量浓度为1mol·L-1的盐酸恰好反应,蒸干溶液,最终得到固体质量为( )
A.8 g B.15.5 g C.5.85g D.无法计算
17.下列关于物质的量浓度表述正确的是( )
A.0.3 mol·L-1的Na2SO4溶液中含有 Na+和SO42-的总物质的量为0.9mol
B.当1L水吸收22.4L氨气时所得氨水的浓度不是Imol·L-1,只有当22.4L氨气溶于水制得IL氨水时,其浓度才是1mo1·L-1
C.在K2SO4和Nac1的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D.10℃时,0.35mol·L-1的KC1饱和溶液100mL蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35mol·L-1
18.同温、同压下,某容器充满O2重116g若充满CO2重122g现充满某气体重114g,则该气体的相对分子质量为( )
A.28 B.60 C.32 D.44
二,非选择题
(10分)如右图A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。已知A在空气中燃烧生成淡黄色固体(部分产物已略去)。
请填写下列空白:
(1)写出化学式: A 、B___ 、C_______ 、D .
(2)以上反应中属于置换反应的有__ (填写编号)。
(3)写出下列转化的化学方程式:
A C_ ;
B D_ ·
20.(8分)在0.2 L 由 NaCl、MgCl2、CaCI2组成的混合液中, 部分离子浓度大小如图所示,回答下列问题:
(1)该混合液中,NaCl的物质的量为____mol,含溶质MgCl2的质量为___g.
(2)该混合液中CaCl2的物质的量为_______mol,将该温合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 mol·L-1。
21.(14分)实验室需要0.1mol·L-1 NaOH 溶液 450 mL 和0.5 mol·L-1 硫酸溶液 500 mL。根据这两种溶液的配制情况回答下列问题
(1)如图所示的仪器中配制溶液肯定不需要的是__ (填序号),配制上述溶液还需用到的玻璃仪器是_ (填仪器名称)。
(2)配制0.1mol·L-1 NaOH 溶液操作步骤如下:
①把称量好的NaOH固体放入小烧中,加量蒸馏水溶解;
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中:
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒 2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为___ (填序号)。
根据计算用托盘天平称取NaOH 的质量为__ g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度_ _0.10mol·L-1 (填“大于”“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度__ 0.10mol·L-1
根据计算得知,所需质量分数为98%、密度为1.84g· cm-3的浓硫酸的体积为
mL(计算结果保留一位小数)。如果实验室有10 ml、15 mL、20 ml、50 mL 的量简,应选用 mL的量筒最好。
(14分)下图表示在没有通风橱时制取纯净的氯气时设计的装置图,图中A、B 是可控制的弹簧铁夹。
烧杯中盛放的液体是_ ,其作用是__ ,并写出原理方程式
水槽中盛放的液是_ .
简述操作过程(对试管夹A/B的操作):(从氯气已经产生开始)在收集氯气之前,应 当氯气纯度合乎要求时,应 当氨气收集完毕时,应 。
将8.7gMnO2与含HCl 14.6g的浓盐酸共热制Cl2,甲同学认为可制得Cl2 7.1g,乙同学认为制得Cl2;的质量小于7.1 g,你认为____(填“甲”或“乙”)同学正确,原因是 。
2022-2023学年新密一高高一
第一学期第一次月考化学试卷答案
选择题
1-5 CDDBC 6-10 ACCBB 11-15 DCBDD 16-18 CDA
二.非选择题
19.(1)Na Na2O2 NaOH; Na2CO3
(2)②;
(3)2Na + 2H2O = 2NaOH + H2↑; 2Na2O2 + CO2 = 2Na2CO3 +02
【解析】A为一种常见的单质,已知A在空气中燃烧生成淡黄色固体,则A为Na,B、C、D、E是含有A元素的常见化合物,钠在氧气中点燃生成B为Na2O2,过氧化钠与二氧化碳反应生成D为NazCO3,钠与水反应生成C为NaOH,C与过量的二氧化碳反应生成E为NaHCO3,碳酸氢钠受热分解生成碳酸钠,符合各物质的转化关系,
(1)根据上面的分析可知,A为Na,B为 Na2O2 ,C为NaOH,D为Na2CO3
(2)根据上面的分析可知,以上反应中只有钠与水生成氢氧化钠和氢气是一种单子和一种化合物反应生成另一种单质和另一种化合物的反应,故属于置换反应的为②
(3)略
20.(1)0.2 95 (2)0.1 0.1 (3)0.6
21.答案:(1)A、C 烧杯、玻璃棒
(2)①②④③⑤
(3)2.0 等于 大于
(4)13.6 15
【解析】(1)配制溶液用不到圆底烧瓶和分液漏斗。
(2)配制NaOH溶液的步骤为称量→溶解→转移→洗涤→定容→摇匀。
(3)必须用500mL的容量瓶来配制0.10mol·L-1NaOH溶液,故需要称取 NaOH的质量为010mol·L-1 x 05L x 40g·mol-1 =2.0g。容量瓶未干燥不影响所配制溶液的浓度;未等溶液冷却就定容会导致冷却后溶液的体积变小,浓度变大。
(4)设需要浓硫酸的体积为V,184g· cm-3 xV x 98% = 0.50g·mol-1 x 0.5L x 98g·mol-1, V≈13.6mL应选用15 mL的量筒。
22.(1)NaOH溶液 吸收多余的Cl2 饱和食盐水
(2)打开B夹,关闭A夹 打开A夹,关闭B夹 关闭A夹,打开B夹
(3)乙 ①浓盐酸易挥发②随着反应进行,浓盐酸浓度会降低,稀盐酸将不再反应
【解析】:用饱和食盐水可洗去Cl2中混有的HCI,又使Cl2损失较少,故可用排饱和食盐水法收集Cl2。处理制Cl2的尾气最好的试剂是强碱溶液。由于浓盐酸会挥发,稀盐酸不能反应,故用浓盐酸制Cl2时,HCI不能完全反应。
同课章节目录
