第三章 第四节 沉淀溶解平衡——2022-2023学年高二化学人教版(2019)选择性必修1课时练习(Word含答案)
文档属性
| 名称 | 第三章 第四节 沉淀溶解平衡——2022-2023学年高二化学人教版(2019)选择性必修1课时练习(Word含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 438.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-15 18:22:57 | ||
图片预览




文档简介
第三章 第四节 沉淀溶解平衡
1.在一定温度下,在水中的沉淀溶解平衡可用离子方程式表示为__________,该平衡的可表示为__________。
2.难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的是( )。
A.沉淀的速率和溶解的速率相等
B.难溶电解质在水中形成饱和溶液
C.再加入难溶电解质,溶液中各离子的浓度不变
D.难溶电解质溶解形成的阴、阳离子的浓度相等
3.现进行下列实验:
(1)将0.1mol/L溶液和0.1mol/LNaCl溶液等体积混合,得到悬浊液a;将悬浊液a过滤,得到滤液b和白色沉淀c。
(2)向滤液b中滴加0.1mol/LKI溶液,滤液出现浑浊。
(3)向沉淀c中滴加0.1mol/LKI溶液,沉淀变为黄色。
下列关于上述实验的分析错误的是( )。
A.悬浊液a中存在沉淀溶解平衡:
B.滤液b中不含
C.实验(3)表明AgCl转化为AgI
D.实验可以证明AgI的比AgCl的小
4.在一定温度下,向AgCl的悬浊液中滴入下列溶液(滴入溶液的体积忽略不计),根据变化的情况填写下表(填“增大”“减小”或“不变”)。
实验操作 m(AgCl)
(1)滴入稀盐酸
(2)滴入溶液
(3)滴人溶液
5.沉淀溶解平衡对于定量分离沉淀时如何选择洗涤剂具有指导作用。例如,现制得0.1g沉淀,常温下如果用100mL蒸馏水洗涤该沉淀以除掉杂质,将损失;如果改用100mL0.01mol/L硫酸洗涤该沉淀,仅损失,与用等体积的蒸馏水洗涤相比,损失少得多。请解释原因。
6.医疗上常用作X射线透视肠胃的内服药剂,俗称“钡餐”。和都是难溶电解质,二者的溶度积相差不大。那么,能否用代替作“钡餐”?请说明原因。
7.工业上处理废水时,和FeS均可用于除去废水中的,试解释原因(用离子方程式表示)。
8.盐碱地(含较多的NaCl、)不利于农作物生长,通过施加适量石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因,以及用石膏降低其碱性的反应原理。
9.在粗制晶体中常含有杂质。在提纯时,为了除去,常加入少量,使氧化为,然后调节溶液,可以达到除去而不损失的目的。请查阅附录Ⅲ,通过计算解释原因(已知25℃时饱和溶液中的物质的量浓度为1.41mol/L)。
10.25℃时,在含有大量固体的饱和溶液中存在着平衡,加入KI溶液,下列说法正确的是( )
A.固体减少 B.溶度积常数增大
C.沉淀溶解平衡不移动 D.溶液中浓度减少
11.将AgCl分别加入盛有:①5mL水②溶液③溶液④盐酸的烧杯中,均有固体剩余,各溶液中从大到小的顺序排列正确的是( )
A.④③②① B.②③④① C.①④③② D.①③②④
12.已知常温下AgCl和AgBr的溶解度分别为,将AgCl与AgBr的饱和溶液等体积混合,再加入足量溶液,发生的反应为( )
A.只有AgBr沉淀生成 B.AgCl和AgBr沉淀等量生成
C.AgCl沉淀多于AgBr沉淀 D.AgCl沉淀少于AgBr沉淀
13.已知:,则下列难溶盐的饱和溶液中,浓度大小顺序正确的是( )
A. B.
C. D.
14.下列化学原理的应用,主要用沉淀溶解平衡原理解释的是( )
①热纯碱溶液的洗涤油污能力强
②误将钡盐当作食盐混用后,常用0.5%的溶液解毒
③溶洞的形成
④碳酸钡不能作“钡餐”而硫酸钡能
⑤泡沫灭火器灭火的原理
A.①②③ B.②③④ C.③④⑤ D.①②③④⑤
15.下列说法正确的是( )
A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
B.悬浊液中存在平衡:,向其中加入少量NaOH粉末,平衡向左移动,体系中离子的总浓度会减小
C.硬水中含有较多的等离子,加热煮沸可以完全除去其中的
D.为减小洗涤过程中固体的损失,最好选用稀硫酸代替来洗涤沉淀
16.化工生产中常用MnS作为沉淀剂除去工业废水中的:,下列说法正确的是( )
A.相同温度时,MnS的比CuS的小
B.该反应达到平衡时
C.向平衡体系中加入少量固体后,减小,增大
D.设该反应的平衡常数为,则
17.两种温度下在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:
(1)______(填“>”“<”“=”),时______。
(2)根据温度时的沉淀溶解平衡曲线,判断下列说法正确的是______(填字母)。
A.加入可由a点变为b点
B.在曲线上方区域(不含曲线)的任意一点时,均有沉淀生成
C.蒸发溶剂可能由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
18.工业制胆矾时,将粗制CuO粉未(含杂质)慢慢加入适量的稀中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:时,以的形式完全沉淀;时,以的形式完全沉淀;pH在3~4时,以的形式完全沉淀。回答下列问题:
(1)为除去溶液中的,可先加入_______(填化学式)将氧化为,反应的离子方程式为_________,然后再加入适量的_______调整溶液的pH到_________,使转化为。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去而不损失的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下的溶度积,的溶度积,通常认为残留在溶液中的离子浓度小于时就认为沉淀完全,设溶液中的浓度为,则开始沉淀时溶液的pH为_________,完全沉淀时溶液的pH为_________,通过计算确定上述方案_________(填“可行”或“不可行”)。
19.工业废水中常含有一定量的,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将转化为,再将转化为沉淀。
(1)利用硫酸工业废气中的可以处理酸性含铬废水,用离子方程式表示反应原理:___________________。
(2)常温下,,除去被还原所得溶液中的[使],需调节溶液的pH至少为___________________。
(3)和类似,也是两性氢氧化物。写出的酸式电离方程式:___________________。
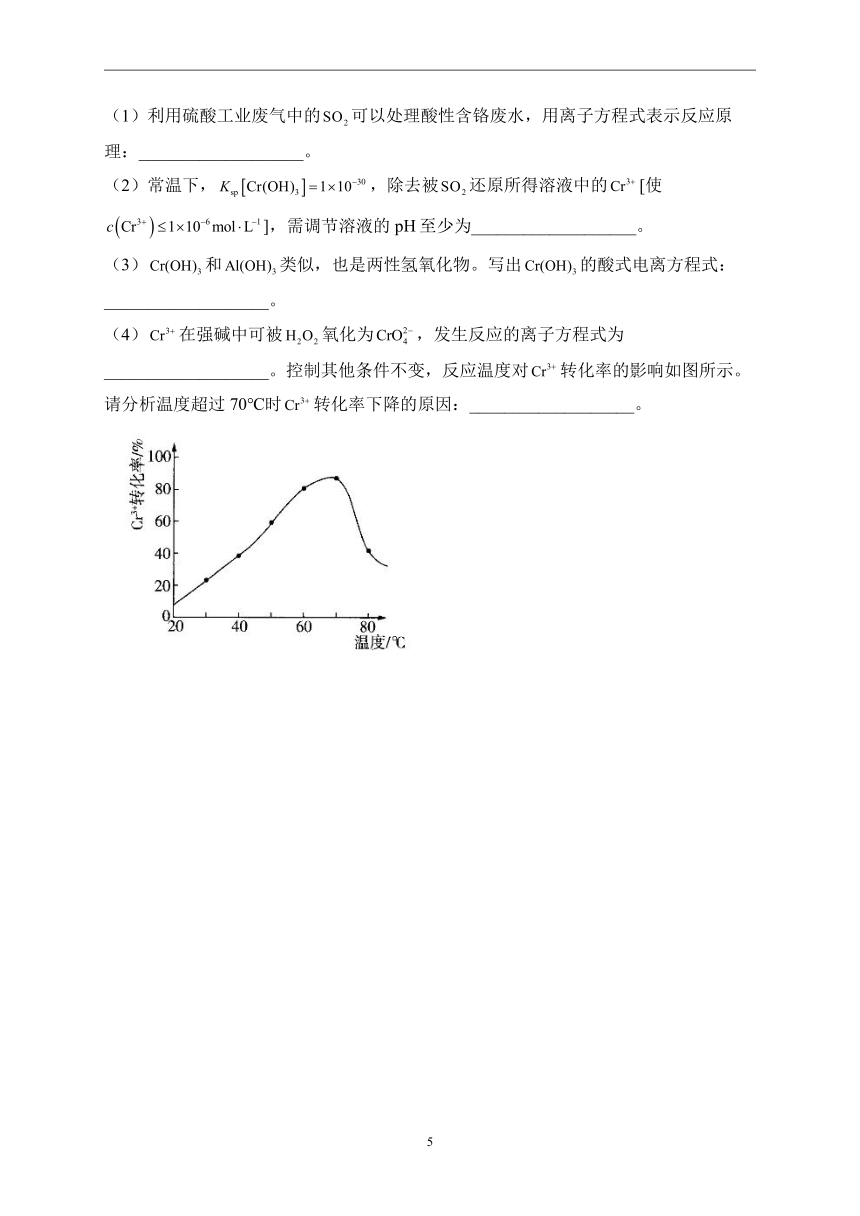
(4)在强碱中可被氧化为,发生反应的离子方程式为___________________。控制其他条件不变,反应温度对转化率的影响如图所示。请分析温度超过70℃时转化率下降的原因:___________________。
答案以及解析
1.答案:;
2.答案:D
3.答案:B
4.答案:
实验操作
(1)滴入稀盐酸 减小 增大 增大
(2)滴入溶液 增大 减小 增大
(3)滴入溶液 减小 增大 减小
解析:AgCl悬浊液中存在沉淀溶解平衡:,(1)滴入稀盐酸,增大,平衡逆向移动,减小,增大;(2)滴入溶液,增大,平衡逆向移动,减小,增大;(3)滴入溶液,与结合生成更难溶的,减小,平衡正向移动,增大,减小。
5.答案:在水中存在沉淀溶解平衡:,0.01 mol/L硫酸中,用此浓度的硫酸洗涤,会使上述沉淀溶解平衡向逆反应方向移动,所以损失少得多。
6.答案:不能;在水中存在沉淀溶解平衡:,胃酸的主要成分是盐酸,盐酸与反应,减小,使上述平衡向正反应方向移动,增大,导致人体中毒。
7.答案:;
8.答案:盐碱地呈碱性的原因:;用石膏降低其碱性的反应原理:石膏的主要成分是,其与反应生成更难溶的,降低了,其离子方程式为,使的水解平衡向逆反应方向移动,减小,从而降低了碱性。
9.答案:见解析
解析:在常温下,溶液的,。已知,,计算可得,,所以此时已沉淀完全。如果此时溶液中是饱和的,,,,不会析出;如果此时溶液中是不饱和的,,同样地,,不会析出。因此,可以达到除去而不损失的目的。
10.答案:D
解析:A项,加入KI溶液,溶液中浓度增大,平衡向左移动,固体增多,错误;B项,只与温度有关,温度不变则溶度积常数不变,错误;C项,浓度增大,沉淀溶解平衡向左移动,错误;D项,浓度增大,沉淀溶解平衡向左移动,溶液中浓度减小,正确;故选D。
11.答案:C
解析:在AgCl饱和溶液中存在沉淀溶解平衡:,加入平衡逆向移动,会减小,加入的浓度越大,越小,已知的浓度从大到小顺序为②③④①,则浓度从大到小顺序为①④③②,C正确。
12.答案:C
解析:由于AgCl的溶解度大于AgBr,在AgCl和AgBr的饱和溶液中,前者大于后者,,当将 AgCl、AgBr的饱和溶液等体积混合时,有AgBr沉淀生成;再加入足量溶液时,溶液中也形成 AgCl沉淀,由于原等体积的饱和溶液中物质的量大于,则生成的AgCl沉淀比AgBr沉淀多;故选C。
13.答案:C
解析:AgCl饱和溶液中浓度和浓度相等,所以,AgI饱和溶液中浓度和浓度相等,所以,饱和溶液中浓度是浓度的2倍,因此,解得,三种难溶盐的饱和溶液中浓度大小顺序为,故选C。
14.答案:B
解析:①碳酸钠是强碱弱酸盐,水解使其溶液呈碱性,水解是吸热过程,加热有利于水解平衡正向移动,故热纯碱溶液洗涤油污的能力比冷纯碱溶液强,应用了盐类水解原理,错误;②钡离子有毒,所以可溶性的钡盐有毒,钡离子和硫酸根离子反应生成不溶于酸和水的硫酸钡,即易溶性的物质能向难溶性的物质转化,可以用沉淀溶解平衡原理来解释,正确;③水中含有钙离子,空气中有二氧化碳,二氧化碳和水反应生成碳酸,碳酸和钙离子反应生成难溶性的碳酸钙,长时间反应,形成溶洞,所以可以用沉淀溶解平衡原理来解释,正确;④碳酸钡能和盐酸反应生成氯化钡、二氧化碳和水,硫酸钡和盐酸不反应,所以碳酸钡不能作“钡餐”而硫酸钡能,可以用沉淀溶解平衡原理来解释,正确;⑤碳酸氢钠水解使其溶液呈碱性,硫酸铝水解使其溶液呈酸性,氢离子和氢氧根离子反应生成水,碳酸氢钠和硫酸铝发生相互促进的水解反应,从而迅速产生二氧化碳,所以可以用盐类水解原理来解释泡沫灭火器灭火的原理,错误;故选B。
15.答案:D
解析:氢氧化钙的溶解度随着温度的升高而减小,升高温度,溶液浓度减小,pH减小,故A项错误;向悬浊液中加入少量NaOH粉末,平衡向左移动,引入了钠离子,体系中离子的总浓度会增大,故B项错误;氢氧化镁、碳酸钙难溶于水,在水中的溶解度很小,但不是完全不溶的,体系中仍会存在少量,故C项错误;稀硫酸使硫酸钡沉淀的溶解平衡逆向移动,用稀硫酸代替来洗涤沉淀,能减少硫酸钡的溶解,故D项正确。
16.答案:D
解析:一种沉淀易转化为更难溶的沉淀,则,A项错误;达到平衡时,,B项错误;加入少量固体后,增大,平衡正向移动,增大,C项错误;该反应的平衡常数,D项正确。
17.答案:(1);
(2)ABC
解析:(1)升高温度促进溶解,溶度积常数增大,则依据题图可知;时根据c点对应的离子浓度可知。
(2)A项,加入,硫酸根离子浓度增大,浓度减小,则可由a点变为b点,正确;B项,在曲线上方区域(不含曲线)的任意一点时浓度积均大于溶度积,因此均有沉淀生成,正确;C项,蒸发溶剂硫酸根离子、钡离子浓度均增大,因此可能由d点变为曲线上a、b之间的某一点(不含a、b),正确;D项,升温离子的浓度不变,不可能由b点变为d点,错误;故选A、B、C。
18.答案:(1);;CuO[或或或];3~4
(2)4;3;可行
解析:(1)加入合适氧化剂,将氧化为,不能引入新的杂质,应选过氧化氢,反应的离子方程式为;调整至溶液pH=3~4,使转化为沉淀,可以达到除去而不损失的目的,则加入的含铜元素的物质应可与氢离子反应促进铁离子水解转化为沉淀,即可加入或。
(2)的溶度积,溶液中的浓度为,,依据溶度积常数得,,得到,此时溶液中,溶液pH=4,则开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于时就认为沉淀完全,的溶度积,求得,此时溶液中,pH=3,则完全沉淀时溶液的pH为3;通过计算可知pH=4能达到除去而不损失的目的,则方案可行。
19.答案:(1)
(2)6
(3)
(4);在较高温度下发生分解,浓度降低,氧化能力下降
解析:(1)酸性含铬废水中含有,具有较强的氧化性,与发生氧化还原反应,结合得失电子守恒和元素守恒可得反应的离子方程式:。
(2)常温下,,溶液中时,,此时溶液的。
(3)和类似,也是两性氢氧化物,而发生酸式电离的方程式为,类比推理写出的酸式电离方程式。
(4)在强碱中被氧化为,而则被还原为,反应的离子方程式为。分析反应温度对转化率的影响可知,随着温度的升高,开始阶段转化率增大,温度超过70℃时,转化率下降,其原因可能是在较高温度下发生分解,浓度降低,氧化能力下降。
2
1.在一定温度下,在水中的沉淀溶解平衡可用离子方程式表示为__________,该平衡的可表示为__________。
2.难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的是( )。
A.沉淀的速率和溶解的速率相等
B.难溶电解质在水中形成饱和溶液
C.再加入难溶电解质,溶液中各离子的浓度不变
D.难溶电解质溶解形成的阴、阳离子的浓度相等
3.现进行下列实验:
(1)将0.1mol/L溶液和0.1mol/LNaCl溶液等体积混合,得到悬浊液a;将悬浊液a过滤,得到滤液b和白色沉淀c。
(2)向滤液b中滴加0.1mol/LKI溶液,滤液出现浑浊。
(3)向沉淀c中滴加0.1mol/LKI溶液,沉淀变为黄色。
下列关于上述实验的分析错误的是( )。
A.悬浊液a中存在沉淀溶解平衡:
B.滤液b中不含
C.实验(3)表明AgCl转化为AgI
D.实验可以证明AgI的比AgCl的小
4.在一定温度下,向AgCl的悬浊液中滴入下列溶液(滴入溶液的体积忽略不计),根据变化的情况填写下表(填“增大”“减小”或“不变”)。
实验操作 m(AgCl)
(1)滴入稀盐酸
(2)滴入溶液
(3)滴人溶液
5.沉淀溶解平衡对于定量分离沉淀时如何选择洗涤剂具有指导作用。例如,现制得0.1g沉淀,常温下如果用100mL蒸馏水洗涤该沉淀以除掉杂质,将损失;如果改用100mL0.01mol/L硫酸洗涤该沉淀,仅损失,与用等体积的蒸馏水洗涤相比,损失少得多。请解释原因。
6.医疗上常用作X射线透视肠胃的内服药剂,俗称“钡餐”。和都是难溶电解质,二者的溶度积相差不大。那么,能否用代替作“钡餐”?请说明原因。
7.工业上处理废水时,和FeS均可用于除去废水中的,试解释原因(用离子方程式表示)。
8.盐碱地(含较多的NaCl、)不利于农作物生长,通过施加适量石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因,以及用石膏降低其碱性的反应原理。
9.在粗制晶体中常含有杂质。在提纯时,为了除去,常加入少量,使氧化为,然后调节溶液,可以达到除去而不损失的目的。请查阅附录Ⅲ,通过计算解释原因(已知25℃时饱和溶液中的物质的量浓度为1.41mol/L)。
10.25℃时,在含有大量固体的饱和溶液中存在着平衡,加入KI溶液,下列说法正确的是( )
A.固体减少 B.溶度积常数增大
C.沉淀溶解平衡不移动 D.溶液中浓度减少
11.将AgCl分别加入盛有:①5mL水②溶液③溶液④盐酸的烧杯中,均有固体剩余,各溶液中从大到小的顺序排列正确的是( )
A.④③②① B.②③④① C.①④③② D.①③②④
12.已知常温下AgCl和AgBr的溶解度分别为,将AgCl与AgBr的饱和溶液等体积混合,再加入足量溶液,发生的反应为( )
A.只有AgBr沉淀生成 B.AgCl和AgBr沉淀等量生成
C.AgCl沉淀多于AgBr沉淀 D.AgCl沉淀少于AgBr沉淀
13.已知:,则下列难溶盐的饱和溶液中,浓度大小顺序正确的是( )
A. B.
C. D.
14.下列化学原理的应用,主要用沉淀溶解平衡原理解释的是( )
①热纯碱溶液的洗涤油污能力强
②误将钡盐当作食盐混用后,常用0.5%的溶液解毒
③溶洞的形成
④碳酸钡不能作“钡餐”而硫酸钡能
⑤泡沫灭火器灭火的原理
A.①②③ B.②③④ C.③④⑤ D.①②③④⑤
15.下列说法正确的是( )
A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
B.悬浊液中存在平衡:,向其中加入少量NaOH粉末,平衡向左移动,体系中离子的总浓度会减小
C.硬水中含有较多的等离子,加热煮沸可以完全除去其中的
D.为减小洗涤过程中固体的损失,最好选用稀硫酸代替来洗涤沉淀
16.化工生产中常用MnS作为沉淀剂除去工业废水中的:,下列说法正确的是( )
A.相同温度时,MnS的比CuS的小
B.该反应达到平衡时
C.向平衡体系中加入少量固体后,减小,增大
D.设该反应的平衡常数为,则
17.两种温度下在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:
(1)______(填“>”“<”“=”),时______。
(2)根据温度时的沉淀溶解平衡曲线,判断下列说法正确的是______(填字母)。
A.加入可由a点变为b点
B.在曲线上方区域(不含曲线)的任意一点时,均有沉淀生成
C.蒸发溶剂可能由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
18.工业制胆矾时,将粗制CuO粉未(含杂质)慢慢加入适量的稀中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:时,以的形式完全沉淀;时,以的形式完全沉淀;pH在3~4时,以的形式完全沉淀。回答下列问题:
(1)为除去溶液中的,可先加入_______(填化学式)将氧化为,反应的离子方程式为_________,然后再加入适量的_______调整溶液的pH到_________,使转化为。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去而不损失的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下的溶度积,的溶度积,通常认为残留在溶液中的离子浓度小于时就认为沉淀完全,设溶液中的浓度为,则开始沉淀时溶液的pH为_________,完全沉淀时溶液的pH为_________,通过计算确定上述方案_________(填“可行”或“不可行”)。
19.工业废水中常含有一定量的,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将转化为,再将转化为沉淀。
(1)利用硫酸工业废气中的可以处理酸性含铬废水,用离子方程式表示反应原理:___________________。
(2)常温下,,除去被还原所得溶液中的[使],需调节溶液的pH至少为___________________。
(3)和类似,也是两性氢氧化物。写出的酸式电离方程式:___________________。
(4)在强碱中可被氧化为,发生反应的离子方程式为___________________。控制其他条件不变,反应温度对转化率的影响如图所示。请分析温度超过70℃时转化率下降的原因:___________________。
答案以及解析
1.答案:;
2.答案:D
3.答案:B
4.答案:
实验操作
(1)滴入稀盐酸 减小 增大 增大
(2)滴入溶液 增大 减小 增大
(3)滴入溶液 减小 增大 减小
解析:AgCl悬浊液中存在沉淀溶解平衡:,(1)滴入稀盐酸,增大,平衡逆向移动,减小,增大;(2)滴入溶液,增大,平衡逆向移动,减小,增大;(3)滴入溶液,与结合生成更难溶的,减小,平衡正向移动,增大,减小。
5.答案:在水中存在沉淀溶解平衡:,0.01 mol/L硫酸中,用此浓度的硫酸洗涤,会使上述沉淀溶解平衡向逆反应方向移动,所以损失少得多。
6.答案:不能;在水中存在沉淀溶解平衡:,胃酸的主要成分是盐酸,盐酸与反应,减小,使上述平衡向正反应方向移动,增大,导致人体中毒。
7.答案:;
8.答案:盐碱地呈碱性的原因:;用石膏降低其碱性的反应原理:石膏的主要成分是,其与反应生成更难溶的,降低了,其离子方程式为,使的水解平衡向逆反应方向移动,减小,从而降低了碱性。
9.答案:见解析
解析:在常温下,溶液的,。已知,,计算可得,,所以此时已沉淀完全。如果此时溶液中是饱和的,,,,不会析出;如果此时溶液中是不饱和的,,同样地,,不会析出。因此,可以达到除去而不损失的目的。
10.答案:D
解析:A项,加入KI溶液,溶液中浓度增大,平衡向左移动,固体增多,错误;B项,只与温度有关,温度不变则溶度积常数不变,错误;C项,浓度增大,沉淀溶解平衡向左移动,错误;D项,浓度增大,沉淀溶解平衡向左移动,溶液中浓度减小,正确;故选D。
11.答案:C
解析:在AgCl饱和溶液中存在沉淀溶解平衡:,加入平衡逆向移动,会减小,加入的浓度越大,越小,已知的浓度从大到小顺序为②③④①,则浓度从大到小顺序为①④③②,C正确。
12.答案:C
解析:由于AgCl的溶解度大于AgBr,在AgCl和AgBr的饱和溶液中,前者大于后者,,当将 AgCl、AgBr的饱和溶液等体积混合时,有AgBr沉淀生成;再加入足量溶液时,溶液中也形成 AgCl沉淀,由于原等体积的饱和溶液中物质的量大于,则生成的AgCl沉淀比AgBr沉淀多;故选C。
13.答案:C
解析:AgCl饱和溶液中浓度和浓度相等,所以,AgI饱和溶液中浓度和浓度相等,所以,饱和溶液中浓度是浓度的2倍,因此,解得,三种难溶盐的饱和溶液中浓度大小顺序为,故选C。
14.答案:B
解析:①碳酸钠是强碱弱酸盐,水解使其溶液呈碱性,水解是吸热过程,加热有利于水解平衡正向移动,故热纯碱溶液洗涤油污的能力比冷纯碱溶液强,应用了盐类水解原理,错误;②钡离子有毒,所以可溶性的钡盐有毒,钡离子和硫酸根离子反应生成不溶于酸和水的硫酸钡,即易溶性的物质能向难溶性的物质转化,可以用沉淀溶解平衡原理来解释,正确;③水中含有钙离子,空气中有二氧化碳,二氧化碳和水反应生成碳酸,碳酸和钙离子反应生成难溶性的碳酸钙,长时间反应,形成溶洞,所以可以用沉淀溶解平衡原理来解释,正确;④碳酸钡能和盐酸反应生成氯化钡、二氧化碳和水,硫酸钡和盐酸不反应,所以碳酸钡不能作“钡餐”而硫酸钡能,可以用沉淀溶解平衡原理来解释,正确;⑤碳酸氢钠水解使其溶液呈碱性,硫酸铝水解使其溶液呈酸性,氢离子和氢氧根离子反应生成水,碳酸氢钠和硫酸铝发生相互促进的水解反应,从而迅速产生二氧化碳,所以可以用盐类水解原理来解释泡沫灭火器灭火的原理,错误;故选B。
15.答案:D
解析:氢氧化钙的溶解度随着温度的升高而减小,升高温度,溶液浓度减小,pH减小,故A项错误;向悬浊液中加入少量NaOH粉末,平衡向左移动,引入了钠离子,体系中离子的总浓度会增大,故B项错误;氢氧化镁、碳酸钙难溶于水,在水中的溶解度很小,但不是完全不溶的,体系中仍会存在少量,故C项错误;稀硫酸使硫酸钡沉淀的溶解平衡逆向移动,用稀硫酸代替来洗涤沉淀,能减少硫酸钡的溶解,故D项正确。
16.答案:D
解析:一种沉淀易转化为更难溶的沉淀,则,A项错误;达到平衡时,,B项错误;加入少量固体后,增大,平衡正向移动,增大,C项错误;该反应的平衡常数,D项正确。
17.答案:(1);
(2)ABC
解析:(1)升高温度促进溶解,溶度积常数增大,则依据题图可知;时根据c点对应的离子浓度可知。
(2)A项,加入,硫酸根离子浓度增大,浓度减小,则可由a点变为b点,正确;B项,在曲线上方区域(不含曲线)的任意一点时浓度积均大于溶度积,因此均有沉淀生成,正确;C项,蒸发溶剂硫酸根离子、钡离子浓度均增大,因此可能由d点变为曲线上a、b之间的某一点(不含a、b),正确;D项,升温离子的浓度不变,不可能由b点变为d点,错误;故选A、B、C。
18.答案:(1);;CuO[或或或];3~4
(2)4;3;可行
解析:(1)加入合适氧化剂,将氧化为,不能引入新的杂质,应选过氧化氢,反应的离子方程式为;调整至溶液pH=3~4,使转化为沉淀,可以达到除去而不损失的目的,则加入的含铜元素的物质应可与氢离子反应促进铁离子水解转化为沉淀,即可加入或。
(2)的溶度积,溶液中的浓度为,,依据溶度积常数得,,得到,此时溶液中,溶液pH=4,则开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于时就认为沉淀完全,的溶度积,求得,此时溶液中,pH=3,则完全沉淀时溶液的pH为3;通过计算可知pH=4能达到除去而不损失的目的,则方案可行。
19.答案:(1)
(2)6
(3)
(4);在较高温度下发生分解,浓度降低,氧化能力下降
解析:(1)酸性含铬废水中含有,具有较强的氧化性,与发生氧化还原反应,结合得失电子守恒和元素守恒可得反应的离子方程式:。
(2)常温下,,溶液中时,,此时溶液的。
(3)和类似,也是两性氢氧化物,而发生酸式电离的方程式为,类比推理写出的酸式电离方程式。
(4)在强碱中被氧化为,而则被还原为,反应的离子方程式为。分析反应温度对转化率的影响可知,随着温度的升高,开始阶段转化率增大,温度超过70℃时,转化率下降,其原因可能是在较高温度下发生分解,浓度降低,氧化能力下降。
2
