高中化学人教版(2019)必修第二册5.2 氮及其化合物(共68张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第二册5.2 氮及其化合物(共68张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-15 19:50:51 | ||
图片预览








文档简介
(共68张PPT)
第二节 氮及其化合物
一、氮气与氮的固定
1.氮气的性质
氮分子内两个氮原子间以共价三键结合,所以氮气化学性质稳定,通常情况下难以
与其他物质发生反应,但在高温、放电等条件下,能够与镁、氧气、氢气等物质发
生化合反应。
(1)3Mg+N2 Mg3N2;
(2)N2+3H2 2NH3;
(3)N2+O2 2NO。
2.氮的固定
(1)定义:将大气中游离态的氮转化为氮的化合物的过程叫做氮的固定。
(2)氮的固定包括自然固氮(如“雷雨发庄稼”“根瘤菌固氮”等)、人工固氮(如
工业合成氨等)。
色、态 气味 密度 溶解性 毒性 收集方法
NO 无色气体 — 比空气略大 不溶于水 有毒 排水集气法
NO2 红棕色气体 有刺激性气味 比空气大 易溶于水 有毒 向上排空气法
二、一氧化氮和二氧化氮
1.物理性质
2.化学性质
(1)常温下,NO不稳定,易与O2化合,反应的化学方程式为2NO+O2 2NO2。
(2)NO2溶于水时与水发生反应,反应的化学方程式为3NO2+H2O 2HNO3+NO,
工业上利用这一原理生产硝酸。
三、氨和铵盐
1.氨的物理性质
颜色 气味 密度 溶解性 沸点
无色 有刺激性气味 小于空气 极易溶于水(常温常压下,体积比约为1∶700) 较低(易液化,可作制冷剂)
2.氨的化学性质
(1)氨与水的反应:NH3+H2O NH3·H2O N +OH-;氨的水溶液俗称氨水,显
弱碱性。
(2)氨与酸的反应(盐酸为例):HCl+NH3 NH4Cl;蘸有浓盐酸的玻璃棒与蘸有浓
氨水的玻璃棒靠近,产生大量白烟。
(3)氨的还原性——氨的催化氧化
4NH3+5O2 4NO+6H2O,这是工业制硝酸的基础反应。
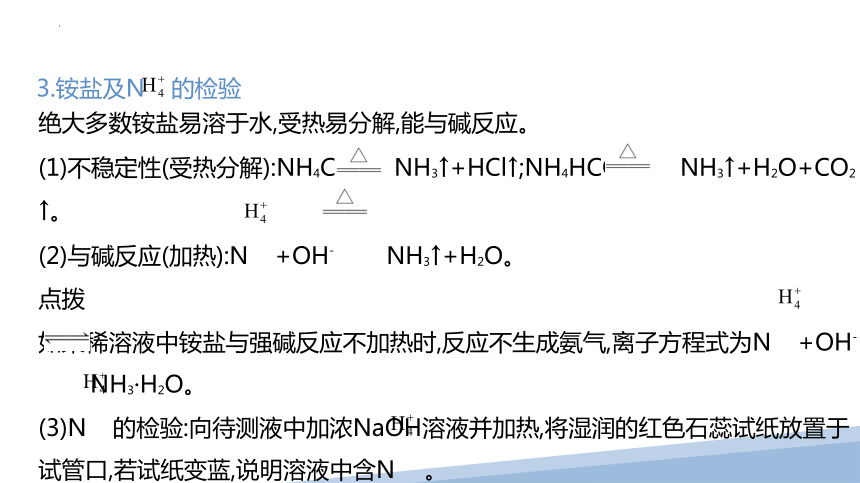
3.铵盐及N 的检验
绝大多数铵盐易溶于水,受热易分解,能与碱反应。
(1)不稳定性(受热分解):NH4Cl NH3↑+HCl↑;NH4HCO3 NH3↑+H2O+CO2↑。
(2)与碱反应(加热):N +OH- NH3↑+H2O。
点拨
如果稀溶液中铵盐与强碱反应不加热时,反应不生成氨气,离子方程式为N +OH-
NH3·H2O。
(3)N 的检验:向待测液中加浓NaOH溶液并加热,将湿润的红色石蕊试纸放置于试管口,若试纸变蓝,说明溶液中含N 。
4.氨气的实验室制法
(1)加热NH4Cl和Ca(OH)2的混合物:2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O。
①装置:“固体、固体,加热”型。
②收集:向下排空气法。
③验满方法:a.将湿润的红色石蕊试纸置于试管口,试纸变蓝,说明已集满;b.将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生,说明已集满。
④棉花的作用:减小NH3与空气的对流,使收集到的NH3更纯。
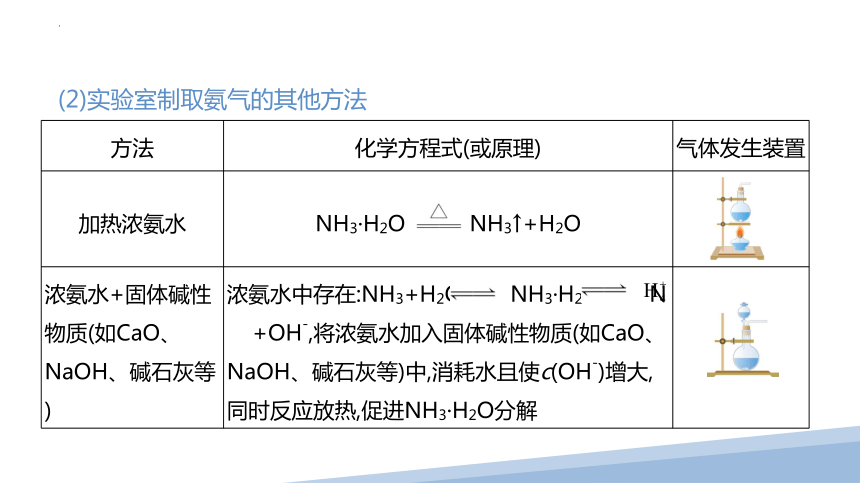
方法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O NH3↑+H2O
浓氨水+固体碱性物质(如CaO、 NaOH、碱石灰等) 浓氨水中存在:NH3+H2O NH3·H2O N +OH-,将浓氨水加入固体碱性物质(如CaO、 NaOH、碱石灰等)中,消耗水且使c(OH-)增大,同时反应放热,促进NH3·H2O分解
(2)实验室制取氨气的其他方法
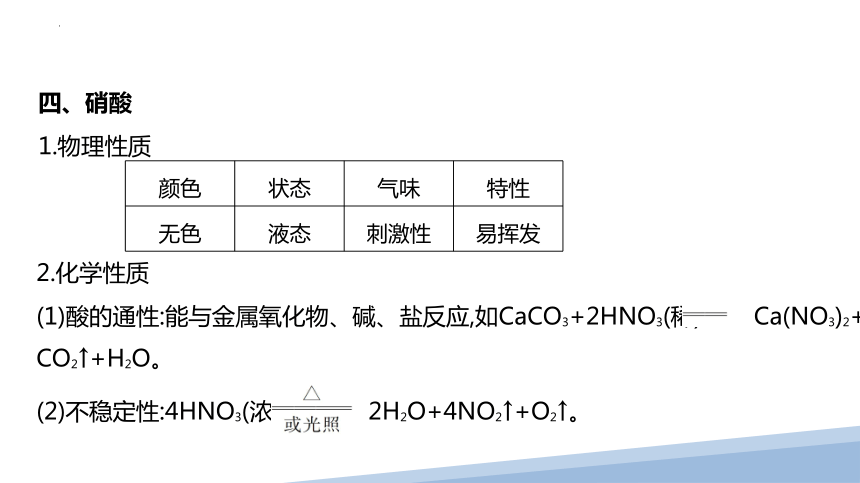
四、硝酸
1.物理性质
2.化学性质
(1)酸的通性:能与金属氧化物、碱、盐反应,如CaCO3+2HNO3(稀) Ca(NO3)2+
CO2↑+H2O。
(2)不稳定性:4HNO3(浓) 2H2O+4NO2↑+O2↑。
颜色 状态 气味 特性
无色 液态 刺激性 易挥发
保存:棕色试剂瓶,并放置在阴凉处。
(3)强氧化性:硝酸无论浓、稀都有强氧化性,而且浓度越大,氧化性越强。
①与金属反应
稀硝酸与铜反应:3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O;
浓硝酸与铜反应:Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O。
②与非金属反应
浓硝酸与C的反应:C+4HNO3(浓) CO2↑+4NO2↑+2H2O。
③钝化
常温下,浓硝酸使铁、铝发生钝化。
点拨
常温下,可用铁、铝容器来盛放浓硝酸。
五、酸雨及防治
1.SO2、NOx的主要来源
(1)SO2:主要来源于煤、石油和某些含硫的金属矿物的燃烧或冶炼。
(2)NOx:主要来源于机动车产生的尾气。
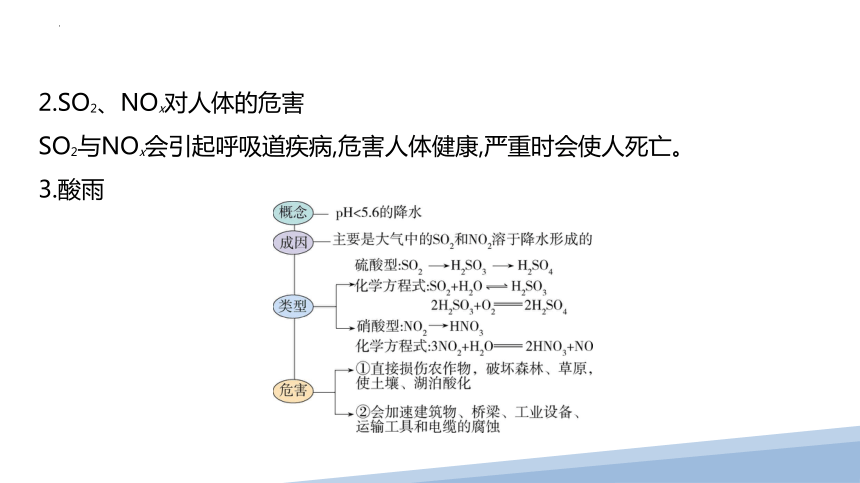
2.SO2、NOx对人体的危害
SO2与NOx会引起呼吸道疾病,危害人体健康,严重时会使人死亡。
3.酸雨
4.酸雨防治
(1)工业废气排放到大气中之前,必须进行适当处理,防止有害物质污染大气。
(2)减少化石燃料直接燃烧,如脱硫处理。
一、喷泉实验原理及装置
1.喷泉实验的原理
使烧瓶内外在短时间内产生较大的压强差,利用大气压将烧瓶下面烧杯中的液体
压入烧瓶内,在尖嘴导管口形成喷泉。
在实验室中可以利用喷泉实验,验证氨气等气体的溶解性。
2.喷泉实验的装置
图1 图2 图3
3.形成喷泉的常见组合及其组合条件
(1)液体是水时,NH3、HCl、SO2、NO2、NO2+O2等气体均可形成喷泉;液体是
NaOH溶液时,Cl2、CO2、H2S、SO2等气体均可形成喷泉。
(2)组合条件:气体在溶液中的溶解度很大或通过反应使气体的物质的量迅速减小,产生足够的压强差(负压)。产生压强差的一般方法:使烧瓶外气压不变,烧瓶内气压减小。
二、氮的氧化物溶于水的计算方法
NO2和NO有如下反应:
3NO2+H2O 2HNO3+NO ① 2NO+O2 2NO2 ②
由①②可得计算式:
4NO2+O2+2H2O 4HNO3 ③
4NO+3O2+2H2O 4HNO3 ④
(1)NO和NO2的混合气体:NO、NO2的混合气体溶于水时仅涉及反应①,可利用气
体体积变化的差值进行计算:V剩=V(NO)原+ V(NO2)。
(3)NO和O2的混合气体:NO和O2的混合气体溶于水时涉及反应④,其计算如表:
x= 0
反应情况 O2过量,剩余气体为O2 恰好完全反应 NO过量,剩余气体为NO
(2)NO2和O2的混合气体:NO2和O2的混合气体溶于水时涉及反应③,其计算如下表:
x= 04
反应情况 O2过量,剩余气体为O2 恰好完全反应 NO2过量,剩余气体为NO
理。
NO+NO2+2NaOH 2NaNO2+H2O
2NO2+2NaOH NaNO3+NaNO2+H2O
NO+NO2+Na2CO3 2NaNO2+CO2
三、氮的氧化物的处理
(1)形成酸雨(pH小于5.6的降水)的气体有氮的氧化物和二氧化硫。
(2)汽车尾气的处理:在催化剂的作用下,将氮的氧化物转化为氮气,发生的主要反
应的化学方程式为2NOx+2xCO N2+2xCO2。
(3)硝酸工业的尾气处理主要是利用碱(如氢氧化钠)或碱性溶液(如纯碱溶液)来处
第二单元 氮及其化合物 A卷 必备知识全优
一、选择题
1.20世纪80年代后期,人们逐渐认识到NO在人体内起着多方面的重要生理作
用。下列关于NO的说法正确的是 ( )
A.NO是酸性氧化物,它与水反应生成亚硝酸(HNO2)
B.NO是造成光化学烟雾的因素之一
C.因为NO在人体内起着多方面的重要生理作用,所以NO对人类无害
D.NO分子所含电子总数为偶数
B
解题思路 NO不溶于水,不与水反应,也不能与碱反应,不属于酸性氧化物,A错
误;氮氧化物是造成光化学烟雾的主要原因,B正确;尽管微量的NO在人体内起
着多方面的重要生理作用,但NO是有毒气体,吸入过多对人体有害,C错误;1个
NO分子所含电子总数为7+8=15,为奇数,D错误。
拓展延伸 不能与酸或碱反应生成相应价态的盐和水的氧化物叫做不成盐氧
化物,如NO、CO、NO2等。
2.(2021山东菏泽期末)下列事实与括号中物质的性质对应关系正确的是 ( )
A.浓硝酸敞口放置于空气中密度减小(硝酸有强氧化性)
B.NO暴露于空气中变红棕色(NO有氧化性)
C.H2S溶液敞口久置变浑浊(H2S有还原性)
D.浓硝酸久置后变为棕黄色液体(浓硝酸具有强氧化性)
C
解题思路 硝酸溶液的密度比水大,且浓度越大密度越大,浓硝酸具有挥发性,
若敞口放置于空气中,溶液浓度变小,密度减小,这与硝酸有强氧化性无关,A错
误;NO暴露于空气中,与空气中的O2反应生成红棕色的NO2气体,在该反应中NO
表现还原性,B错误;由于O2的氧化性比S强,H2S溶液敞口久置,H2S会被溶解在溶
液中的O2氧化生成难溶于水的S单质,导致溶液变浑浊,H2S表现还原性,C正确;
浓硝酸久置后变为棕黄色液体是因为浓硝酸分解产生的NO2溶于浓硝酸中,D错
误。
3.(2021山东威海期末)如图所示,弹簧夹开始处于关闭状态,将液体A滴入试管②
中与气体B充分反应,打开弹簧夹,可发现试管①内的水立刻沸腾。则液体A和
气体B的组合不可能是 ( )
C
A.氢氧化钠溶液、二氧化碳 B.水、氨气
C.氢氧化钠溶液、一氧化氮 D.水、二氧化氮
解题思路 要使试管①内的水立刻沸腾,则试管②中气体压强要显著下降,即气
体B要被液体A大量消耗,A、B、D均符合要求;氢氧化钠溶液不能吸收一氧化
氮,不符合要求,故选C。
4.(2021全国甲)实验室制备下列气体的方法可行的是 ( )
气体 方法
A 氨气 加热氯化铵固体
B 二氧化氮 将铝片加到冷浓硝酸中
C 硫化氢 向硫化钠固体滴加浓硫酸
D 氧气 加热氯酸钾和二氧化锰的混合物
D
解题思路 氯化铵不稳定,加热易分解生成氨气和氯化氢,但两者遇冷又会化合
生成氯化铵固体,所以不能用于制备氨气,A不可行;将铝片加到冷浓硝酸中会发
生钝化,反应很快停止,不能用于制备二氧化氮,B不可行;硫化氢为还原性气体,
浓硫酸具有强氧化性,不能用浓硫酸与硫化钠固体反应制备硫化氢气体,C不可
行;加热氯酸钾和二氧化锰的混合物,二者反应生成氯化钾和氧气,二氧化锰作
催化剂,可用此方法制备氧气,D可行。
5.(2021河北)关于非金属含氧酸及其盐的性质,下列说法正确的是 ( )
A.浓H2SO4具有强吸水性,能吸收糖类化合物中的水分并使其炭化
B.NaClO、KClO3等氯的含氧酸盐的氧化性会随溶液的pH减小而增强
C.加热NaI与浓H3PO4混合物可制备HI,说明H3PO4比HI酸性强
D.浓HNO3和稀HNO3与Cu反应的还原产物分别为NO2和NO,故稀HNO3氧化性
更强
B
解题思路 浓硫酸使糖类化合物炭化体现了脱水性,A项错误;pH减小,NaClO、
KClO3等氯的含氧酸盐的氧化性增强,B项正确;加热NaI与浓H3PO4混合物可制
备HI,是利用了不挥发性酸制备挥发性酸,C项错误;浓硝酸的氧化性比稀硝酸
强,D项错误。
6.等物质的量的下列物质与足量稀硝酸反应,放出NO气体的物质的量最多的是
( )
A.Fe3O4 B.FeO C.Cu D.Fe
D
解题思路 假设题述各物质的物质的量都是1 mol。Fe3O4中Fe(Ⅱ)与Fe(Ⅲ)的原子个数比为1∶2,与硝酸反应时,Fe(Ⅱ)被氧化,失去1 mol电子;FeO与硝酸反应,失去1 mol电子;Cu与硝酸反应生成Cu2+,失去2 mol电子;Fe与硝酸反应生成Fe3+,失去3 mol电子。由此可知,等物质的量的4种物质与硝酸反应时失电子最多的是Fe,则对应放出NO物质的量也最多,故选D。
解后反思 根据得失电子守恒,可知1 mol物质与稀硝酸反应时失去电子越多,
放出NO的物质的量越多,因此比较1 mol物质失去电子的多少即可。
7.(2021江苏常熟期末)利用N2→NH3→NO→NO2→HNO3这一过程制备HNO3,有
关上述各物质的叙述中不正确的是 ( )
A.上述转化过程中某些气体会发生颜色变化
B.可利用Cu与硝酸的反应,将N元素转化为NO或NO2
C.为使上述各步骤依次发生,必须向每个步骤中提供氧化剂
D.实验室中可以利用Ca(OH)2固体与NH4Cl固体混合加热制备NH3
C
解题思路 NO→NO2的转化会出现气体由无色到红棕色的颜色变化,A正确;Cu
与稀硝酸反应生成NO,与浓硝酸反应生成NO2,B正确;N2转化为NH3时,N元素化
合价降低,需要加入还原剂,不需要加入氧化剂,NO2与H2O反应生成HNO3和NO
时,NO2既是氧化剂又是还原剂,也不需要加入氧化剂,C错误;Ca(OH)2与NH4Cl混
合加热可制备NH3,D正确。
8.(2021吉林四平期末)NH4NO3在高温下爆炸时的反应为4NH4NO3 3N2↑+
2NO2↑+8H2O↑。下列说法不正确的是 ( )
A.NH4NO3在高温下爆炸时可以看到红棕色的烟雾
B.NH4NO3的含氮量小于氯化铵
C.实验室不能用NH4NO3固体与Ca(OH)2固体混合加热制备NH3
D.乘坐火车时不能携带NH4NO3固体
B
解题思路 NH4NO3爆炸时生成的NO2为红棕色,NO2、粉尘、H2O等形成了红
棕色的烟雾,A正确;NH4NO3的含氮量为35%,NH4Cl的含氮量约为26.2%,B不正
确;由于NH4NO3固体受热可能会爆炸,故实验室不能用其与Ca(OH)2固体混合加
热制备NH3,C正确;NH4NO3属于易爆炸物品,不能带上火车,D正确。
9.下列反应既体现硝酸的酸性,又体现硝酸的氧化性的是 ( )
A.CuO+2HNO3 Cu(NO3)2+H2O
B.FeO+4HNO3 Fe(NO3)3+2H2O+NO2↑
C.C+4HNO3 CO2↑+2H2O+4NO2↑
D.NH3+HNO3 NH4NO3
B
解题思路 A项,硝酸中氮元素的化合价没有变化,只生成硝酸盐,则只体现硝酸
的酸性,错误;B项,生成硝酸铁,体现硝酸的酸性,且硝酸中部分氮元素的化合价
由+5价降低为+4价,体现硝酸的氧化性,正确;C项,硝酸与碳反应,硝酸中氮元素
的化合价全部降低,只体现硝酸的氧化性,错误;D项,反应中没有元素化合价的
变化,只生成硝酸盐,则只体现硝酸的酸性,错误。
10.(2021福建宁德期末)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、
N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气
体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入2.5 mol·L-1 NaOH溶液至
Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 ( )
A.30 mL B.60 mL
C.90 mL D.120 mL
D
解题思路 足量的Cu与一定量的浓硝酸反应得到的NO2、N2O4、NO混合气体,
与1.68 L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸,
则Cu失去的电子的物质的量等于O2得到的电子的物质的量,即n(Cu)=2n(O2)=2×
=0.15 mol,根据NaOH和Cu(NO3)2的反应可得n(NaOH)=2n[Cu(NO3)2]
=2n(Cu)=0.3 mol,则V(NaOH溶液)= =0.12 L=120 mL。故选D。
归纳总结
二、选择题
11.(2020全国Ⅲ)喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷
泉现象的是 ( )
B
解题思路 H2S在稀盐酸中溶解度很小,且与稀盐酸不反应,不能出现喷泉现象,
A错误;HCl气体极易溶于水,且HCl气体与氨水反应生成氯化铵,会瞬间产生压
强差,出现喷泉现象,B正确;一氧化氮不溶于稀H2SO4,也不与其反应,不能出现喷
泉现象,C错误;二氧化碳不溶于饱和碳酸氢钠溶液,也不与其反应,不能出现喷泉
现象,D错误。
解后反思 喷泉现象出现的关键是形成压强差,要求气体极易溶于液体或极易
与液体发生反应,使烧瓶内的压强迅速降低,才可形成喷泉。
12.(2021福建宁德期末)四支相同试管分别充满下列气体:①NO2,②NH3,③NO2
和O2(体积比1∶1),④HCl和O2(体积比1∶1)。把四支试管倒扣在盛有水的水槽
中,试管中水面上升的高度分别为h1、h2、h3、h4,它们的大小顺序正确的是( )
A.h2>h1>h3>h4 B.h2>h3>h1>h4
C.h2>h3>h4>h1 D.h2>h1>h4>h3
A
解题思路 设试管的体积为4体积。①3NO2+H2O 2HNO3+NO,试管中水的
体积为4体积× = 体积;②NH3能完全溶于水,试管中水的体积为4体积;③4NO2
+O2+2H2O 4HNO3,NO2和O2体积比为1∶1,则NO2和O2各为2体积,2体积NO2
和0.5体积O2反应生成硝酸,试管中水的体积为2.5体积;④HCl能完全溶于水,HCl
和O2体积比1∶1,则HCl和O2各为2体积,试管中剩余2体积O2,试管中水的体积为
2体积。综上所述,h2>h1>h3>h4,故选A。
13.(2021江苏苏州吴江中学期末)下列离子方程式不正确的是 ( )
A.二氧化氮与水反应:3NO2+H2O 2H++2N +NO
B.过量铁粉与稀HNO3反应:Fe+4H++N Fe3++NO↑+2H2O
C.AlCl3溶液与氨水反应:AlCl3+3OH- Al(OH)3↓+3Cl-
D.铜与浓HNO3反应:Cu+4H++2N Cu2++2H2O+2NO2↑
BC
解题思路 过量铁粉与稀硝酸反应生成Fe2+,正确的离子方程式为3Fe+8H++2N
3Fe2++2NO↑+4H2O,B错误;NH3·H2O为弱碱,不能拆分,AlCl3为可溶的强
电解质,应拆写为离子,正确的离子方程式为Al3++3NH3·H2O Al(OH)3↓+3N , C错误;故选B、C。
14.(2021湖南湘潭期末)NH3是一种重要的化工原料,可以制备一系列物质(如
图)。下列有关表述正确的是 ( )
A.NH4Cl和NaHCO3都是常用的化肥
C
B.NO2与水反应时,氧化剂与还原剂的物质的量之比为1∶1
C.NH3和NO2在一定条件下可发生氧化还原反应
D.利用上述关系制取NaHCO3的操作为向饱和
NaCl溶液中依次通入过量的CO2、NH3,然后过滤得到NaHCO3
解题思路 NaHCO3不是化肥,A项错误;NO2与水反应的化学方程式为3NO2+H2O 2HNO3+NO,氧化剂与还原剂的物质的量之比为1∶2,B项错误;制NaHCO3时,
是向饱和NaCl溶液中依次通入NH3和CO2,D项错误。
15.根据装置和表内的物质(省略夹持、净化以及尾气处理装置,图1中虚线框内
的装置是图2),其中能达到相应实验目的的是 ( )
AD
选项 a中的物质 b中的物质 实验目的、试剂和操作
实验目的 c中的物质 进气方向
A 稀硝酸 Cu 收集贮存NO 水 N→M
B 浓硝酸 Na2SO3 检验SO2的氧化性 品红溶液 M→N
C 浓氨水 碱石灰 收集贮存氨气 饱和NH4Cl溶液 N→M
D 浓盐酸 KMnO4 检验Cl2的氧化性 Na2S溶液 M→N
解题思路 稀硝酸和Cu反应生成NO,NO不溶于水,且不与水反应,可用排水法
收集,进气方向是N→M,故A符合题意;由于浓硝酸具有强氧化性,与Na2SO3反应
生成硫酸盐和NO2气体,未生成SO2,无法检验SO2的氧化性,故B不符合题意;氨气
极易溶于水,不能用排饱和NH4Cl溶液法来收集氨气,故C不符合题意;高锰酸钾
和浓盐酸在常温下反应生成氯气,Cl2可氧化S2-,生成S单质,故D符合题意。
三、非选择题
16.(10分)(2021河北沧州期末)一定条件下,含氮元素的物质可发生如图所示的
循环转化。
回答下列问题:
(1)氮原子的结构示意图为 。
(2)图中属于“氮的固定”的是 (填字母,下同);转化过程中发生非氧化
还原反应的是 。
(3)若“反应h”是在NO2和H2O的作用下实现的,则该反应中氧化产物与还原产
物的物质的量之比为 。
(4)若“反应i”是在酸性条件下由N 与Zn的作用实现的,则该反应的离子方程
式为 。
答案 (每空2分)
(1) (2)k和c a和l (3)2∶1
(4)4Zn+2N +10H+ 4Zn2++N2O↑+5H2O
解题思路 (1)N位于第二周期第ⅤA族,其原子结构示意图为 。(2)“氮
的固定”是游离态的氮转化为化合态的氮,根据题给循环转化图可知,属于“氮
的固定”的是k和c;发生非氧化还原反应,说明反应前后各元素化合价没有发生
变化,则属于非氧化还原反应的是a和l。(3)“反应h”的化学方程式为3NO2+H2O 2HNO3+NO,HNO3是氧化产物,NO是还原产物,因此氧化产物和还原产物的物质的量之比为2∶1。(4)根据题给信息、电荷守恒、得失电子守恒以及原子守恒得反应i的离子方程式为4Zn+2N +10H+ 4Zn2++N2O↑+5H2O。
17.(12分)某校课外活动小组为了探究铜与稀硝酸反应产生的气体是NO,设计了
如下实验。实验装置(夹持装置已略去)如图所示(已知NO、NO2能与NaOH溶
液反应):
(1)设计装置A的目的是
。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,观察到装置B中的现象是
;B中反应的离子方程式是 。
(3)将注射器F中的空气推入E中,E中的气体变为红棕色,该实验的目的是
。
(4)D装置的作用是 。
答案 (除标注外,每空2分)
(1)利用生成的CO2将整套装置内的空气赶尽,以排除对气体产物观察的干扰(3
分) (2)铜丝上产生气泡,稀硝酸液面上方气体仍为无色,溶液变为蓝色(3分)
3Cu+8H++2N 3Cu2++2NO↑+4H2O (3)验证E中的无色气体为NO (4)吸
收NO2等尾气,防止污染空气
解题思路 (1)因装置中有空气,则生成的NO能与氧气反应生成二氧化氮,干扰
实验,可以利用装置A中生成的CO2将整套装置内的空气赶尽,以排除对气体产
物观察的干扰。(2)铜与稀硝酸反应生成硝酸铜、NO和水,其离子方程式为3Cu
+8H++2N 3C +2NO↑+4H2O,因此实验现象是铜丝上产生气泡,稀硝酸
液面上方气体仍为无色,溶液变为蓝色。(3)将F中的空气推入E中,发生反应
2NO+O2 2NO2,E中无色气体变为红棕色,证明NO存在。(4)NO2有毒,装置D
中NaOH溶液的作用为吸收多余的NO2,防止污染空气。
18.(12分)某些物质的转化可用下图表示。
请回答下列问题:
(1)完成化学方程式:
Ca(OH)2+ NaHCO3(过量) + + H2O
(2)若A、C均含有铝元素。
①当B为过量盐酸时,C为 ;
②当B为过量NaOH时,C为 。
(3)若A为第二周期元素形成的黑色固体单质,B为第二周期某元素的最高价氧
化物的水化物。写出该反应的化学方程式: 。
(4)若A为过量铁粉、B为稀硝酸,检验溶液中金属阳离子的方法是
。
(5)若C为能使湿润红色石蕊试纸变蓝的气体。实验室为了简便制取该气体,下
列方法中适合的是 (填字母)。
A.加热氯化铵固体,产生的气体用碱石灰干燥
B.在N2和H2混合气体中加入铁触媒并加热至500 ℃
C.在浓氨水中加入NaOH固体,产生的气体可用固体NaOH干燥
D.加热NH4HCO3,生成的气体用P2O5干燥
答案 (除标注外,每空2分)
(1)1 2 CaCO3↓ Na2CO3 2(共2分)
(2)①AlCl3 ②NaAlO2
(3)C+4HNO3(浓) CO2↑+4NO2↑+2H2O
(4)取少许反应后溶液于试管中,滴加少量酸性KMnO4溶液,紫红色褪去(合理即
可)
(5)C
解题思路 (2)若A、C均含有铝元素,①当B为过量盐酸时,A为NaAlO2,C为AlCl3,D为NaCl;②当B为过量NaOH时,A为AlCl3,C为NaAlO2,D为NaCl。(3)由题意可知,A是C,B是HNO3,则反应的化学方程式为C+4HNO3(浓) CO2↑+4NO2↑+2H2O。(4)若A为过量铁粉、B为稀硝酸,则溶液中的金属阳离子是Fe2+。
19.(14分)(2021济南外国语学校检测)在浓CaCl2溶液中通入NH3和CO2,可以制得
纳米级碳酸钙。如图所示,A~E为实验室常见的仪器装置(部分固定夹持装置已
略去),请根据要求回答问题。
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置中的 (填字
母)。写出A装置中发生反应的化学方程: 。若选用了C、D,则C中盛放的药品为 ;D的作用为
。
(2)向浓CaCl2溶液中通入NH3和CO2制纳米级碳酸钙时,应先通入的气体是
,写出制纳米级碳酸钙的化学方程式: 。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级: 。
答案 (每空2分)
(1)A、C、D、E 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O 碱石灰 吸收
尾气(防止污染空气),防倒吸
(2)NH3 CaCl2+CO2+2NH3+H2O CaCO3↓+2NH4Cl
(3)取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则
所得样品是纳米级,否则不是
解题思路 (1)实验室用A装置将铵盐与碱共热来制取氨气,通过装有碱石灰的
干燥管C干燥,用E装置收集,D装置进行尾气处理。(2)制取纳米级碳酸钙的原理
是先用CO2与过量NH3、H2O反应生成(NH4)2CO3,再与CaCl2反应生成CaCO3,由
于CO2在水中溶解度较小,要先通入NH3形成碱性环境,再通入CO2。(3)纳米级碳
酸钙颗粒分散到水中时形成的分散系为胶体,可以利用丁达尔效应加以判断。
20.(12分)某校化学兴趣小组的同学在进行研究性学习时,对“NO2能否支持燃
烧”这个问题很感兴趣,他们决定自己动手设计实验进行探究。
(1)甲组同学设计的实验方案如下:向烧瓶中加入适量浓硝酸并加热,当烧瓶中有
红棕色气体产生时,将燃着的木条伸入烧瓶中,发现木条熄灭。由此他们得出
“NO2不能支持燃烧”的结论。
甲组同学所得的结论一定正确吗 请你说明理由: 。
(2)乙组同学通过查阅资料得知,一些不活泼金属的硝酸盐受热时也能产生NO2
气体,如2Cu(NO3)2 2CuO+4NO2↑+O2↑,2AgNO3 2Ag+2NO2↑+O2↑。
他们根据此原理设计了如图所示的实验装置(加热、夹持仪器未画出),并分别
用Cu(NO3)2和AgNO3进行实验,实验中发现当红棕色气体进入集气瓶中,带火星
的木炭均能复燃,乙组同学由此得出“NO2能支持燃烧”的结论。
①老师认为上述两个实验中,有一个实验所得结论是不可靠的,你认为该实验中
选用的反应物是 ,其结论不可靠的原因是
。
②运用该实验装置进行实验时,造成的不良后果是 。
(3)丙组同学拟设计一个用较为纯净的NO2气体(无O2)来探究“NO2能否支持燃
烧”的实验。
①丙组同学制取NO2的化学方程式是 。
②下图是该组同学设计的制取并收集NO2气体的实验装置,请在方框中将该装
置补充完整,并注明补充装置中所用试剂。
答案 (除标注外,每空2分)
(1)不一定正确,加热时HNO3分解产生的H2O及溶液蒸发产生的水蒸气可能导致
木条熄灭
(2)①AgNO3(1分) AgNO3受热分解产生的混合气体中O2的体积分数为 ,大于
空气中O2的体积分数( ),故带火星的木炭复燃可能是由于O2浓度增大(3分)
②产生的氮氧化物会污染空气
(3)①Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
②
解题思路 (2)①因为AgNO3分解产生的NO2和O2中,O2的含量大于空气中O2的
含量,O2浓度增大可能导致带火星的木炭复燃。②乙组同学的实验中产生大量
的NO2,NO2扩散到空气中会造成环境污染。(3)Cu和浓硝酸反应可生成NO2,要
除去水蒸气,应先通过浓硫酸,然后收集,最后用NaOH溶液吸收尾气。
第二节 氮及其化合物
一、氮气与氮的固定
1.氮气的性质
氮分子内两个氮原子间以共价三键结合,所以氮气化学性质稳定,通常情况下难以
与其他物质发生反应,但在高温、放电等条件下,能够与镁、氧气、氢气等物质发
生化合反应。
(1)3Mg+N2 Mg3N2;
(2)N2+3H2 2NH3;
(3)N2+O2 2NO。
2.氮的固定
(1)定义:将大气中游离态的氮转化为氮的化合物的过程叫做氮的固定。
(2)氮的固定包括自然固氮(如“雷雨发庄稼”“根瘤菌固氮”等)、人工固氮(如
工业合成氨等)。
色、态 气味 密度 溶解性 毒性 收集方法
NO 无色气体 — 比空气略大 不溶于水 有毒 排水集气法
NO2 红棕色气体 有刺激性气味 比空气大 易溶于水 有毒 向上排空气法
二、一氧化氮和二氧化氮
1.物理性质
2.化学性质
(1)常温下,NO不稳定,易与O2化合,反应的化学方程式为2NO+O2 2NO2。
(2)NO2溶于水时与水发生反应,反应的化学方程式为3NO2+H2O 2HNO3+NO,
工业上利用这一原理生产硝酸。
三、氨和铵盐
1.氨的物理性质
颜色 气味 密度 溶解性 沸点
无色 有刺激性气味 小于空气 极易溶于水(常温常压下,体积比约为1∶700) 较低(易液化,可作制冷剂)
2.氨的化学性质
(1)氨与水的反应:NH3+H2O NH3·H2O N +OH-;氨的水溶液俗称氨水,显
弱碱性。
(2)氨与酸的反应(盐酸为例):HCl+NH3 NH4Cl;蘸有浓盐酸的玻璃棒与蘸有浓
氨水的玻璃棒靠近,产生大量白烟。
(3)氨的还原性——氨的催化氧化
4NH3+5O2 4NO+6H2O,这是工业制硝酸的基础反应。
3.铵盐及N 的检验
绝大多数铵盐易溶于水,受热易分解,能与碱反应。
(1)不稳定性(受热分解):NH4Cl NH3↑+HCl↑;NH4HCO3 NH3↑+H2O+CO2↑。
(2)与碱反应(加热):N +OH- NH3↑+H2O。
点拨
如果稀溶液中铵盐与强碱反应不加热时,反应不生成氨气,离子方程式为N +OH-
NH3·H2O。
(3)N 的检验:向待测液中加浓NaOH溶液并加热,将湿润的红色石蕊试纸放置于试管口,若试纸变蓝,说明溶液中含N 。
4.氨气的实验室制法
(1)加热NH4Cl和Ca(OH)2的混合物:2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O。
①装置:“固体、固体,加热”型。
②收集:向下排空气法。
③验满方法:a.将湿润的红色石蕊试纸置于试管口,试纸变蓝,说明已集满;b.将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生,说明已集满。
④棉花的作用:减小NH3与空气的对流,使收集到的NH3更纯。
方法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O NH3↑+H2O
浓氨水+固体碱性物质(如CaO、 NaOH、碱石灰等) 浓氨水中存在:NH3+H2O NH3·H2O N +OH-,将浓氨水加入固体碱性物质(如CaO、 NaOH、碱石灰等)中,消耗水且使c(OH-)增大,同时反应放热,促进NH3·H2O分解
(2)实验室制取氨气的其他方法
四、硝酸
1.物理性质
2.化学性质
(1)酸的通性:能与金属氧化物、碱、盐反应,如CaCO3+2HNO3(稀) Ca(NO3)2+
CO2↑+H2O。
(2)不稳定性:4HNO3(浓) 2H2O+4NO2↑+O2↑。
颜色 状态 气味 特性
无色 液态 刺激性 易挥发
保存:棕色试剂瓶,并放置在阴凉处。
(3)强氧化性:硝酸无论浓、稀都有强氧化性,而且浓度越大,氧化性越强。
①与金属反应
稀硝酸与铜反应:3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O;
浓硝酸与铜反应:Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O。
②与非金属反应
浓硝酸与C的反应:C+4HNO3(浓) CO2↑+4NO2↑+2H2O。
③钝化
常温下,浓硝酸使铁、铝发生钝化。
点拨
常温下,可用铁、铝容器来盛放浓硝酸。
五、酸雨及防治
1.SO2、NOx的主要来源
(1)SO2:主要来源于煤、石油和某些含硫的金属矿物的燃烧或冶炼。
(2)NOx:主要来源于机动车产生的尾气。
2.SO2、NOx对人体的危害
SO2与NOx会引起呼吸道疾病,危害人体健康,严重时会使人死亡。
3.酸雨
4.酸雨防治
(1)工业废气排放到大气中之前,必须进行适当处理,防止有害物质污染大气。
(2)减少化石燃料直接燃烧,如脱硫处理。
一、喷泉实验原理及装置
1.喷泉实验的原理
使烧瓶内外在短时间内产生较大的压强差,利用大气压将烧瓶下面烧杯中的液体
压入烧瓶内,在尖嘴导管口形成喷泉。
在实验室中可以利用喷泉实验,验证氨气等气体的溶解性。
2.喷泉实验的装置
图1 图2 图3
3.形成喷泉的常见组合及其组合条件
(1)液体是水时,NH3、HCl、SO2、NO2、NO2+O2等气体均可形成喷泉;液体是
NaOH溶液时,Cl2、CO2、H2S、SO2等气体均可形成喷泉。
(2)组合条件:气体在溶液中的溶解度很大或通过反应使气体的物质的量迅速减小,产生足够的压强差(负压)。产生压强差的一般方法:使烧瓶外气压不变,烧瓶内气压减小。
二、氮的氧化物溶于水的计算方法
NO2和NO有如下反应:
3NO2+H2O 2HNO3+NO ① 2NO+O2 2NO2 ②
由①②可得计算式:
4NO2+O2+2H2O 4HNO3 ③
4NO+3O2+2H2O 4HNO3 ④
(1)NO和NO2的混合气体:NO、NO2的混合气体溶于水时仅涉及反应①,可利用气
体体积变化的差值进行计算:V剩=V(NO)原+ V(NO2)。
(3)NO和O2的混合气体:NO和O2的混合气体溶于水时涉及反应④,其计算如表:
x= 0
反应情况 O2过量,剩余气体为O2 恰好完全反应 NO过量,剩余气体为NO
(2)NO2和O2的混合气体:NO2和O2的混合气体溶于水时涉及反应③,其计算如下表:
x= 0
反应情况 O2过量,剩余气体为O2 恰好完全反应 NO2过量,剩余气体为NO
理。
NO+NO2+2NaOH 2NaNO2+H2O
2NO2+2NaOH NaNO3+NaNO2+H2O
NO+NO2+Na2CO3 2NaNO2+CO2
三、氮的氧化物的处理
(1)形成酸雨(pH小于5.6的降水)的气体有氮的氧化物和二氧化硫。
(2)汽车尾气的处理:在催化剂的作用下,将氮的氧化物转化为氮气,发生的主要反
应的化学方程式为2NOx+2xCO N2+2xCO2。
(3)硝酸工业的尾气处理主要是利用碱(如氢氧化钠)或碱性溶液(如纯碱溶液)来处
第二单元 氮及其化合物 A卷 必备知识全优
一、选择题
1.20世纪80年代后期,人们逐渐认识到NO在人体内起着多方面的重要生理作
用。下列关于NO的说法正确的是 ( )
A.NO是酸性氧化物,它与水反应生成亚硝酸(HNO2)
B.NO是造成光化学烟雾的因素之一
C.因为NO在人体内起着多方面的重要生理作用,所以NO对人类无害
D.NO分子所含电子总数为偶数
B
解题思路 NO不溶于水,不与水反应,也不能与碱反应,不属于酸性氧化物,A错
误;氮氧化物是造成光化学烟雾的主要原因,B正确;尽管微量的NO在人体内起
着多方面的重要生理作用,但NO是有毒气体,吸入过多对人体有害,C错误;1个
NO分子所含电子总数为7+8=15,为奇数,D错误。
拓展延伸 不能与酸或碱反应生成相应价态的盐和水的氧化物叫做不成盐氧
化物,如NO、CO、NO2等。
2.(2021山东菏泽期末)下列事实与括号中物质的性质对应关系正确的是 ( )
A.浓硝酸敞口放置于空气中密度减小(硝酸有强氧化性)
B.NO暴露于空气中变红棕色(NO有氧化性)
C.H2S溶液敞口久置变浑浊(H2S有还原性)
D.浓硝酸久置后变为棕黄色液体(浓硝酸具有强氧化性)
C
解题思路 硝酸溶液的密度比水大,且浓度越大密度越大,浓硝酸具有挥发性,
若敞口放置于空气中,溶液浓度变小,密度减小,这与硝酸有强氧化性无关,A错
误;NO暴露于空气中,与空气中的O2反应生成红棕色的NO2气体,在该反应中NO
表现还原性,B错误;由于O2的氧化性比S强,H2S溶液敞口久置,H2S会被溶解在溶
液中的O2氧化生成难溶于水的S单质,导致溶液变浑浊,H2S表现还原性,C正确;
浓硝酸久置后变为棕黄色液体是因为浓硝酸分解产生的NO2溶于浓硝酸中,D错
误。
3.(2021山东威海期末)如图所示,弹簧夹开始处于关闭状态,将液体A滴入试管②
中与气体B充分反应,打开弹簧夹,可发现试管①内的水立刻沸腾。则液体A和
气体B的组合不可能是 ( )
C
A.氢氧化钠溶液、二氧化碳 B.水、氨气
C.氢氧化钠溶液、一氧化氮 D.水、二氧化氮
解题思路 要使试管①内的水立刻沸腾,则试管②中气体压强要显著下降,即气
体B要被液体A大量消耗,A、B、D均符合要求;氢氧化钠溶液不能吸收一氧化
氮,不符合要求,故选C。
4.(2021全国甲)实验室制备下列气体的方法可行的是 ( )
气体 方法
A 氨气 加热氯化铵固体
B 二氧化氮 将铝片加到冷浓硝酸中
C 硫化氢 向硫化钠固体滴加浓硫酸
D 氧气 加热氯酸钾和二氧化锰的混合物
D
解题思路 氯化铵不稳定,加热易分解生成氨气和氯化氢,但两者遇冷又会化合
生成氯化铵固体,所以不能用于制备氨气,A不可行;将铝片加到冷浓硝酸中会发
生钝化,反应很快停止,不能用于制备二氧化氮,B不可行;硫化氢为还原性气体,
浓硫酸具有强氧化性,不能用浓硫酸与硫化钠固体反应制备硫化氢气体,C不可
行;加热氯酸钾和二氧化锰的混合物,二者反应生成氯化钾和氧气,二氧化锰作
催化剂,可用此方法制备氧气,D可行。
5.(2021河北)关于非金属含氧酸及其盐的性质,下列说法正确的是 ( )
A.浓H2SO4具有强吸水性,能吸收糖类化合物中的水分并使其炭化
B.NaClO、KClO3等氯的含氧酸盐的氧化性会随溶液的pH减小而增强
C.加热NaI与浓H3PO4混合物可制备HI,说明H3PO4比HI酸性强
D.浓HNO3和稀HNO3与Cu反应的还原产物分别为NO2和NO,故稀HNO3氧化性
更强
B
解题思路 浓硫酸使糖类化合物炭化体现了脱水性,A项错误;pH减小,NaClO、
KClO3等氯的含氧酸盐的氧化性增强,B项正确;加热NaI与浓H3PO4混合物可制
备HI,是利用了不挥发性酸制备挥发性酸,C项错误;浓硝酸的氧化性比稀硝酸
强,D项错误。
6.等物质的量的下列物质与足量稀硝酸反应,放出NO气体的物质的量最多的是
( )
A.Fe3O4 B.FeO C.Cu D.Fe
D
解题思路 假设题述各物质的物质的量都是1 mol。Fe3O4中Fe(Ⅱ)与Fe(Ⅲ)的原子个数比为1∶2,与硝酸反应时,Fe(Ⅱ)被氧化,失去1 mol电子;FeO与硝酸反应,失去1 mol电子;Cu与硝酸反应生成Cu2+,失去2 mol电子;Fe与硝酸反应生成Fe3+,失去3 mol电子。由此可知,等物质的量的4种物质与硝酸反应时失电子最多的是Fe,则对应放出NO物质的量也最多,故选D。
解后反思 根据得失电子守恒,可知1 mol物质与稀硝酸反应时失去电子越多,
放出NO的物质的量越多,因此比较1 mol物质失去电子的多少即可。
7.(2021江苏常熟期末)利用N2→NH3→NO→NO2→HNO3这一过程制备HNO3,有
关上述各物质的叙述中不正确的是 ( )
A.上述转化过程中某些气体会发生颜色变化
B.可利用Cu与硝酸的反应,将N元素转化为NO或NO2
C.为使上述各步骤依次发生,必须向每个步骤中提供氧化剂
D.实验室中可以利用Ca(OH)2固体与NH4Cl固体混合加热制备NH3
C
解题思路 NO→NO2的转化会出现气体由无色到红棕色的颜色变化,A正确;Cu
与稀硝酸反应生成NO,与浓硝酸反应生成NO2,B正确;N2转化为NH3时,N元素化
合价降低,需要加入还原剂,不需要加入氧化剂,NO2与H2O反应生成HNO3和NO
时,NO2既是氧化剂又是还原剂,也不需要加入氧化剂,C错误;Ca(OH)2与NH4Cl混
合加热可制备NH3,D正确。
8.(2021吉林四平期末)NH4NO3在高温下爆炸时的反应为4NH4NO3 3N2↑+
2NO2↑+8H2O↑。下列说法不正确的是 ( )
A.NH4NO3在高温下爆炸时可以看到红棕色的烟雾
B.NH4NO3的含氮量小于氯化铵
C.实验室不能用NH4NO3固体与Ca(OH)2固体混合加热制备NH3
D.乘坐火车时不能携带NH4NO3固体
B
解题思路 NH4NO3爆炸时生成的NO2为红棕色,NO2、粉尘、H2O等形成了红
棕色的烟雾,A正确;NH4NO3的含氮量为35%,NH4Cl的含氮量约为26.2%,B不正
确;由于NH4NO3固体受热可能会爆炸,故实验室不能用其与Ca(OH)2固体混合加
热制备NH3,C正确;NH4NO3属于易爆炸物品,不能带上火车,D正确。
9.下列反应既体现硝酸的酸性,又体现硝酸的氧化性的是 ( )
A.CuO+2HNO3 Cu(NO3)2+H2O
B.FeO+4HNO3 Fe(NO3)3+2H2O+NO2↑
C.C+4HNO3 CO2↑+2H2O+4NO2↑
D.NH3+HNO3 NH4NO3
B
解题思路 A项,硝酸中氮元素的化合价没有变化,只生成硝酸盐,则只体现硝酸
的酸性,错误;B项,生成硝酸铁,体现硝酸的酸性,且硝酸中部分氮元素的化合价
由+5价降低为+4价,体现硝酸的氧化性,正确;C项,硝酸与碳反应,硝酸中氮元素
的化合价全部降低,只体现硝酸的氧化性,错误;D项,反应中没有元素化合价的
变化,只生成硝酸盐,则只体现硝酸的酸性,错误。
10.(2021福建宁德期末)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、
N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气
体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入2.5 mol·L-1 NaOH溶液至
Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 ( )
A.30 mL B.60 mL
C.90 mL D.120 mL
D
解题思路 足量的Cu与一定量的浓硝酸反应得到的NO2、N2O4、NO混合气体,
与1.68 L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸,
则Cu失去的电子的物质的量等于O2得到的电子的物质的量,即n(Cu)=2n(O2)=2×
=0.15 mol,根据NaOH和Cu(NO3)2的反应可得n(NaOH)=2n[Cu(NO3)2]
=2n(Cu)=0.3 mol,则V(NaOH溶液)= =0.12 L=120 mL。故选D。
归纳总结
二、选择题
11.(2020全国Ⅲ)喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷
泉现象的是 ( )
B
解题思路 H2S在稀盐酸中溶解度很小,且与稀盐酸不反应,不能出现喷泉现象,
A错误;HCl气体极易溶于水,且HCl气体与氨水反应生成氯化铵,会瞬间产生压
强差,出现喷泉现象,B正确;一氧化氮不溶于稀H2SO4,也不与其反应,不能出现喷
泉现象,C错误;二氧化碳不溶于饱和碳酸氢钠溶液,也不与其反应,不能出现喷泉
现象,D错误。
解后反思 喷泉现象出现的关键是形成压强差,要求气体极易溶于液体或极易
与液体发生反应,使烧瓶内的压强迅速降低,才可形成喷泉。
12.(2021福建宁德期末)四支相同试管分别充满下列气体:①NO2,②NH3,③NO2
和O2(体积比1∶1),④HCl和O2(体积比1∶1)。把四支试管倒扣在盛有水的水槽
中,试管中水面上升的高度分别为h1、h2、h3、h4,它们的大小顺序正确的是( )
A.h2>h1>h3>h4 B.h2>h3>h1>h4
C.h2>h3>h4>h1 D.h2>h1>h4>h3
A
解题思路 设试管的体积为4体积。①3NO2+H2O 2HNO3+NO,试管中水的
体积为4体积× = 体积;②NH3能完全溶于水,试管中水的体积为4体积;③4NO2
+O2+2H2O 4HNO3,NO2和O2体积比为1∶1,则NO2和O2各为2体积,2体积NO2
和0.5体积O2反应生成硝酸,试管中水的体积为2.5体积;④HCl能完全溶于水,HCl
和O2体积比1∶1,则HCl和O2各为2体积,试管中剩余2体积O2,试管中水的体积为
2体积。综上所述,h2>h1>h3>h4,故选A。
13.(2021江苏苏州吴江中学期末)下列离子方程式不正确的是 ( )
A.二氧化氮与水反应:3NO2+H2O 2H++2N +NO
B.过量铁粉与稀HNO3反应:Fe+4H++N Fe3++NO↑+2H2O
C.AlCl3溶液与氨水反应:AlCl3+3OH- Al(OH)3↓+3Cl-
D.铜与浓HNO3反应:Cu+4H++2N Cu2++2H2O+2NO2↑
BC
解题思路 过量铁粉与稀硝酸反应生成Fe2+,正确的离子方程式为3Fe+8H++2N
3Fe2++2NO↑+4H2O,B错误;NH3·H2O为弱碱,不能拆分,AlCl3为可溶的强
电解质,应拆写为离子,正确的离子方程式为Al3++3NH3·H2O Al(OH)3↓+3N , C错误;故选B、C。
14.(2021湖南湘潭期末)NH3是一种重要的化工原料,可以制备一系列物质(如
图)。下列有关表述正确的是 ( )
A.NH4Cl和NaHCO3都是常用的化肥
C
B.NO2与水反应时,氧化剂与还原剂的物质的量之比为1∶1
C.NH3和NO2在一定条件下可发生氧化还原反应
D.利用上述关系制取NaHCO3的操作为向饱和
NaCl溶液中依次通入过量的CO2、NH3,然后过滤得到NaHCO3
解题思路 NaHCO3不是化肥,A项错误;NO2与水反应的化学方程式为3NO2+H2O 2HNO3+NO,氧化剂与还原剂的物质的量之比为1∶2,B项错误;制NaHCO3时,
是向饱和NaCl溶液中依次通入NH3和CO2,D项错误。
15.根据装置和表内的物质(省略夹持、净化以及尾气处理装置,图1中虚线框内
的装置是图2),其中能达到相应实验目的的是 ( )
AD
选项 a中的物质 b中的物质 实验目的、试剂和操作
实验目的 c中的物质 进气方向
A 稀硝酸 Cu 收集贮存NO 水 N→M
B 浓硝酸 Na2SO3 检验SO2的氧化性 品红溶液 M→N
C 浓氨水 碱石灰 收集贮存氨气 饱和NH4Cl溶液 N→M
D 浓盐酸 KMnO4 检验Cl2的氧化性 Na2S溶液 M→N
解题思路 稀硝酸和Cu反应生成NO,NO不溶于水,且不与水反应,可用排水法
收集,进气方向是N→M,故A符合题意;由于浓硝酸具有强氧化性,与Na2SO3反应
生成硫酸盐和NO2气体,未生成SO2,无法检验SO2的氧化性,故B不符合题意;氨气
极易溶于水,不能用排饱和NH4Cl溶液法来收集氨气,故C不符合题意;高锰酸钾
和浓盐酸在常温下反应生成氯气,Cl2可氧化S2-,生成S单质,故D符合题意。
三、非选择题
16.(10分)(2021河北沧州期末)一定条件下,含氮元素的物质可发生如图所示的
循环转化。
回答下列问题:
(1)氮原子的结构示意图为 。
(2)图中属于“氮的固定”的是 (填字母,下同);转化过程中发生非氧化
还原反应的是 。
(3)若“反应h”是在NO2和H2O的作用下实现的,则该反应中氧化产物与还原产
物的物质的量之比为 。
(4)若“反应i”是在酸性条件下由N 与Zn的作用实现的,则该反应的离子方程
式为 。
答案 (每空2分)
(1) (2)k和c a和l (3)2∶1
(4)4Zn+2N +10H+ 4Zn2++N2O↑+5H2O
解题思路 (1)N位于第二周期第ⅤA族,其原子结构示意图为 。(2)“氮
的固定”是游离态的氮转化为化合态的氮,根据题给循环转化图可知,属于“氮
的固定”的是k和c;发生非氧化还原反应,说明反应前后各元素化合价没有发生
变化,则属于非氧化还原反应的是a和l。(3)“反应h”的化学方程式为3NO2+H2O 2HNO3+NO,HNO3是氧化产物,NO是还原产物,因此氧化产物和还原产物的物质的量之比为2∶1。(4)根据题给信息、电荷守恒、得失电子守恒以及原子守恒得反应i的离子方程式为4Zn+2N +10H+ 4Zn2++N2O↑+5H2O。
17.(12分)某校课外活动小组为了探究铜与稀硝酸反应产生的气体是NO,设计了
如下实验。实验装置(夹持装置已略去)如图所示(已知NO、NO2能与NaOH溶
液反应):
(1)设计装置A的目的是
。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,观察到装置B中的现象是
;B中反应的离子方程式是 。
(3)将注射器F中的空气推入E中,E中的气体变为红棕色,该实验的目的是
。
(4)D装置的作用是 。
答案 (除标注外,每空2分)
(1)利用生成的CO2将整套装置内的空气赶尽,以排除对气体产物观察的干扰(3
分) (2)铜丝上产生气泡,稀硝酸液面上方气体仍为无色,溶液变为蓝色(3分)
3Cu+8H++2N 3Cu2++2NO↑+4H2O (3)验证E中的无色气体为NO (4)吸
收NO2等尾气,防止污染空气
解题思路 (1)因装置中有空气,则生成的NO能与氧气反应生成二氧化氮,干扰
实验,可以利用装置A中生成的CO2将整套装置内的空气赶尽,以排除对气体产
物观察的干扰。(2)铜与稀硝酸反应生成硝酸铜、NO和水,其离子方程式为3Cu
+8H++2N 3C +2NO↑+4H2O,因此实验现象是铜丝上产生气泡,稀硝酸
液面上方气体仍为无色,溶液变为蓝色。(3)将F中的空气推入E中,发生反应
2NO+O2 2NO2,E中无色气体变为红棕色,证明NO存在。(4)NO2有毒,装置D
中NaOH溶液的作用为吸收多余的NO2,防止污染空气。
18.(12分)某些物质的转化可用下图表示。
请回答下列问题:
(1)完成化学方程式:
Ca(OH)2+ NaHCO3(过量) + + H2O
(2)若A、C均含有铝元素。
①当B为过量盐酸时,C为 ;
②当B为过量NaOH时,C为 。
(3)若A为第二周期元素形成的黑色固体单质,B为第二周期某元素的最高价氧
化物的水化物。写出该反应的化学方程式: 。
(4)若A为过量铁粉、B为稀硝酸,检验溶液中金属阳离子的方法是
。
(5)若C为能使湿润红色石蕊试纸变蓝的气体。实验室为了简便制取该气体,下
列方法中适合的是 (填字母)。
A.加热氯化铵固体,产生的气体用碱石灰干燥
B.在N2和H2混合气体中加入铁触媒并加热至500 ℃
C.在浓氨水中加入NaOH固体,产生的气体可用固体NaOH干燥
D.加热NH4HCO3,生成的气体用P2O5干燥
答案 (除标注外,每空2分)
(1)1 2 CaCO3↓ Na2CO3 2(共2分)
(2)①AlCl3 ②NaAlO2
(3)C+4HNO3(浓) CO2↑+4NO2↑+2H2O
(4)取少许反应后溶液于试管中,滴加少量酸性KMnO4溶液,紫红色褪去(合理即
可)
(5)C
解题思路 (2)若A、C均含有铝元素,①当B为过量盐酸时,A为NaAlO2,C为AlCl3,D为NaCl;②当B为过量NaOH时,A为AlCl3,C为NaAlO2,D为NaCl。(3)由题意可知,A是C,B是HNO3,则反应的化学方程式为C+4HNO3(浓) CO2↑+4NO2↑+2H2O。(4)若A为过量铁粉、B为稀硝酸,则溶液中的金属阳离子是Fe2+。
19.(14分)(2021济南外国语学校检测)在浓CaCl2溶液中通入NH3和CO2,可以制得
纳米级碳酸钙。如图所示,A~E为实验室常见的仪器装置(部分固定夹持装置已
略去),请根据要求回答问题。
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置中的 (填字
母)。写出A装置中发生反应的化学方程: 。若选用了C、D,则C中盛放的药品为 ;D的作用为
。
(2)向浓CaCl2溶液中通入NH3和CO2制纳米级碳酸钙时,应先通入的气体是
,写出制纳米级碳酸钙的化学方程式: 。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级: 。
答案 (每空2分)
(1)A、C、D、E 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O 碱石灰 吸收
尾气(防止污染空气),防倒吸
(2)NH3 CaCl2+CO2+2NH3+H2O CaCO3↓+2NH4Cl
(3)取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则
所得样品是纳米级,否则不是
解题思路 (1)实验室用A装置将铵盐与碱共热来制取氨气,通过装有碱石灰的
干燥管C干燥,用E装置收集,D装置进行尾气处理。(2)制取纳米级碳酸钙的原理
是先用CO2与过量NH3、H2O反应生成(NH4)2CO3,再与CaCl2反应生成CaCO3,由
于CO2在水中溶解度较小,要先通入NH3形成碱性环境,再通入CO2。(3)纳米级碳
酸钙颗粒分散到水中时形成的分散系为胶体,可以利用丁达尔效应加以判断。
20.(12分)某校化学兴趣小组的同学在进行研究性学习时,对“NO2能否支持燃
烧”这个问题很感兴趣,他们决定自己动手设计实验进行探究。
(1)甲组同学设计的实验方案如下:向烧瓶中加入适量浓硝酸并加热,当烧瓶中有
红棕色气体产生时,将燃着的木条伸入烧瓶中,发现木条熄灭。由此他们得出
“NO2不能支持燃烧”的结论。
甲组同学所得的结论一定正确吗 请你说明理由: 。
(2)乙组同学通过查阅资料得知,一些不活泼金属的硝酸盐受热时也能产生NO2
气体,如2Cu(NO3)2 2CuO+4NO2↑+O2↑,2AgNO3 2Ag+2NO2↑+O2↑。
他们根据此原理设计了如图所示的实验装置(加热、夹持仪器未画出),并分别
用Cu(NO3)2和AgNO3进行实验,实验中发现当红棕色气体进入集气瓶中,带火星
的木炭均能复燃,乙组同学由此得出“NO2能支持燃烧”的结论。
①老师认为上述两个实验中,有一个实验所得结论是不可靠的,你认为该实验中
选用的反应物是 ,其结论不可靠的原因是
。
②运用该实验装置进行实验时,造成的不良后果是 。
(3)丙组同学拟设计一个用较为纯净的NO2气体(无O2)来探究“NO2能否支持燃
烧”的实验。
①丙组同学制取NO2的化学方程式是 。
②下图是该组同学设计的制取并收集NO2气体的实验装置,请在方框中将该装
置补充完整,并注明补充装置中所用试剂。
答案 (除标注外,每空2分)
(1)不一定正确,加热时HNO3分解产生的H2O及溶液蒸发产生的水蒸气可能导致
木条熄灭
(2)①AgNO3(1分) AgNO3受热分解产生的混合气体中O2的体积分数为 ,大于
空气中O2的体积分数( ),故带火星的木炭复燃可能是由于O2浓度增大(3分)
②产生的氮氧化物会污染空气
(3)①Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
②
解题思路 (2)①因为AgNO3分解产生的NO2和O2中,O2的含量大于空气中O2的
含量,O2浓度增大可能导致带火星的木炭复燃。②乙组同学的实验中产生大量
的NO2,NO2扩散到空气中会造成环境污染。(3)Cu和浓硝酸反应可生成NO2,要
除去水蒸气,应先通过浓硫酸,然后收集,最后用NaOH溶液吸收尾气。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
