沪教版化学九年级上册 3.1 构成物质的基本微粒 课件(共58张PPT)
文档属性
| 名称 | 沪教版化学九年级上册 3.1 构成物质的基本微粒 课件(共58张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-15 12:04:02 | ||
图片预览











文档简介
(共57张PPT)
构成物质的基本微粒
物质构成的奥秘
绚丽多姿的物质
一:微粒的性质
2、微粒总在不停地做无规则的运动。
3、构成物质的微粒间都有一定的间隙。
1、物质都是由极其细小的、
肉眼看不见的微粒构成的
一:微粒的性质
根据已有知识,你对构成物质的微粒有怎样的认识?可用哪些事实来说明?
微粒的性质
1、构成物质的微粒极小,肉眼是看不见的。
微粒的性质
2、构成物质的微粒,是在不停地运动的
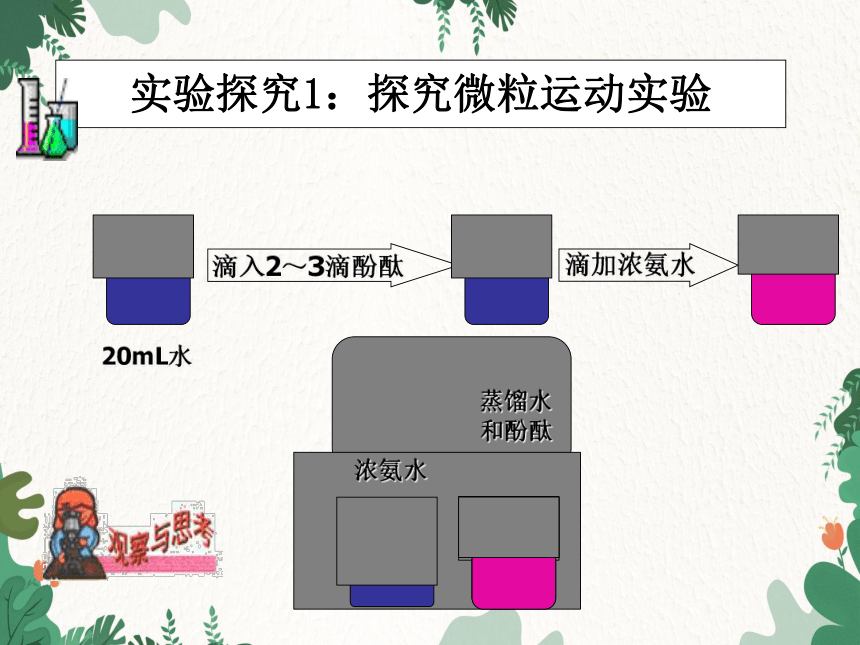
实验探究1:探究微粒运动实验
滴入2~3滴酚酞
20mL水
滴加浓氨水
浓氨水
蒸馏水
和酚酞
1、氨水能使酚酞变红,而不是空气或水;
2、氨水中的微粒从一只烧杯跑进另一烧杯中,发生化学变化,使酚酞变红。
3、微粒总在不停地做无规则的运动。
复习拓展:
1、探究微粒运动实验中,为什么装浓氨水的烧杯中液体没有变红呢
结论:构成物质的微粒虽然都在不停地做无规则的运动;但是不同的微粒运动情况不同。
用微粒的观点解释:湿衣服为什么会晒干?
为什么湿衣服在阳光照射的地方干燥的更快呢?
微粒的运动速率与温度有关;
温度越高运动速率越快。
分子的运动性
结论:构成物质的微粒,是在不停地运动的,且温度越高微粒运动速率越大。
微粒的性质
3、构成物质的微粒之间存在一定的空隙。
实验探究2:酒精与水混合
实验操作 体积变化情况
预测结果 测量结果
1、15mL水与15mL水混合
2、15mL酒精与15mL酒精混合
3、15mL水与15mL酒精混合
想一想:实验现象说明了什么?
影响微粒间空隙大小的因素:
1、温度:温度升高微粒间的空隙变大,温度降低微粒间的空隙变小。
2、物质的存在状态:一般来说,气体物质
中微粒间的空隙较大,液体、固体微粒间的
空隙较小。
物质状态的变化微观三维模拟动画
固态
固态 液态
液态 气态
构成物质的微粒之间都有一定的空隙,不同物质微粒之间的空隙存在差异;
物质的“三态”变化实际上就是微粒之间的间隙发生改变的过程;
在气体物质中,微粒之间的距离比较大;
所以气体分子容易被压缩。
温度会影响微粒间空隙的大小。
1、以下生活、学习经验,不能说明微粒之间有空 隙的是( )
A 打气筒能将气体压缩
B 酒精和水混合,总体积变小
C 物体有热胀冷缩的现象
D 海绵能吸水
小试身手:
2、打开食醋瓶盖时,闻到了刺激气味,表明微粒在_________;食盐能溶解在水里,说明组成物质的微粒间___ _.
不停地运动
有空隙
二、构成物质的基本微粒:分子、原子、离子
一、分子
不同物质具有不同的性质(构成物质的微粒不同)
氧气、氢气、水、二氧化碳都是由分子构成的
大量分子聚集形成物质
一、分子知识
1、分子由原子构成,是构成物质的一种微粒。如常见的水、氧气、氢气、二氧化碳、酒精、氮气等
2、分子的基本性质:分子是构成物质的一种微粒,具有微粒的基本性质,分子的质量和体积都很小,分子在不停地运动,分子之间有间隙
3、分子能保持物质化学性质(构成物质的微粒保持物质的化学性质)。同种物质的分子,化学性质相同,不同种物质的分子,化学性质不同。但分子不保持物质的物理性质。
问题解决一
1、水通电后会生成什么?
2、为什么生成的氢气和氧气不再具有水的性质?
水 氢气+氧气
通电
水分子
H2O
氢分子
H2
氧分子
O2
因为它们是由不同的微粒构成的 微粒不同性质不同
你能用分子的观点解释水蒸发吗?
蒸发时,温度高,分子间空隙变大,但分子本身没有发生变化,是物理变化
水电解时,水分子发生变化了吗
问题解决二
在水电解过程中,发生变化的是什么?不变的又是什么?
物理变化与化学变化的本质区别是什么?
化学变化的实质
分子1→原子→分子2 →新物质
分子分解成原子,原子重新组合成新分子
分子是否发生变化
二、原子
变化:分子,不变:原子
二、原子
化学变化中,分子可以分成原子,而原子不能分。
原子是构成物质的又一种基本粒子,是化学变化中最小的粒子。常见的金属(铁、铜、汞等)及稀有气体(如氦、氖等)、碳(金刚石、石墨等)、硅等都是由原子直接构成。
我来总结分子原子的联系和区别。
分 子 原 子
相同点
不同点
相互关系
1、很小 、彼此有间隔 、不停地运动
2、同种分子(原子)性质相同,不同种分子(原子)性质不相同。
3、都具有种类和数量的含义。
1、在化学反应中,分子可以分解为原子,原子又可以重新组合成新物质的分子。
1、原子是化学变化中的最小微粒。
2、在化学反应中,不可再分,不能变成其它原子。
分子由原子构成的,分子可以分解为构成它的原子。
1、水由 组成,
1个水分子由 构成。
2、在电解水的实验中,水的 破裂为氢
和氧 ,可见,分子很小,但在化学反应中可以 ,而 在化学变化中不可再分,所以说 是化学变化中的最小的粒子。(提示:填“分子”或“原子”)
氢元素和氧元素
两个氢原子和一个氧原子
分子
原子
原子
再分
原子
原子
常见题型举例:
三 原子的构成
原子很小,原子还可以再分吗?
原子并不是构成物质的最小微粒
(1897年) 发现了电子
原子学说:一切物质都是由最小的不能再分的原子构成。原子是坚实的、不再分的实心球。
汤姆生
1911年著名
α粒子(正电荷)
散射实验
英国物理学家卢瑟福α粒子散射实验
大部分α粒子(正电荷)直接穿透金属箔片;少数的α粒子方向明显发生大角度改变,极少数碰到坚硬不可穿透的质点弹回来
现代原子结构
电子在核外做无规则的高速运转
原子的构成
原子核(+)
原 子
(不带电)
{
{
核外电子(-)(一个电子带一个单位负电荷)
质子(+)(一个质子带一个单位正电荷)
中子(不带电)
在原子中,核电荷数=质子数=核外电子数=原子序数
核外电子的排布
1、核外电子的分层排布
在多个电子的原子里,核外电子是分层运动的,由里向外,电子能量渐增。
2
+8
6
原子核
核内质子数
电子层
电子层上的电子个数
2、原子结构示意图
1、电子层
符号
K L M N O P Q
n
1 2 3 4 5 6 7
能量高低
离核远近
低
高
近
远
2、各电子层最多容纳的电子数
2个 8个 18个 32个 …… 2n2个
Ne
Ar
He
Li
Be
Na
Mg
Al
H
C
B
N
O
Si
P
F
Ne
Ar
2
+18
8
8
最外层电子数8个,(氦2个)达到稳定状态。不易得、失电子。
特点
合作探究1:
+2
2
稀有气体元素
的原子结构
8
2
+10
He
合作探究2:
金属
元素
的原
子结
构
2
+3
1
Li
2
+ 4
2
Be
1
2
+11
8
Na
2
2
+12
8
Mg
Al
2
+13
8
3
最外层电子数一般少于4个,在化学变化容易失去电子。
特点:
合作探究3:
非金属元素的原子结构
1
+1
H
4
2
+6
C
3
2
+5
B
2
+7
5
N
+8
2
6
O
2
+14
8
4
Si
P
2
+15
8
5
7
2
+9
F
最外层电子数一般大于4个,在化学变化容易得到电子。
特点:
元素的分类、最外层电子数与元素化学性质有什么样的关系呢?
元素的分类 最外层电子数 元素化学性质
金属元素
非金属元素
稀有气体元素
小于4
一般大于4
等于8(氦等于2)
易失去电子,不稳定
易得到电子,不稳定
不易得失电子,稳定
原子最外层电子数决定着元素的化学性质。
稳定结构
最外层电子数为8
只有一层为2
1.当原子得失电子后,
还显电中性吗?
2.原子得失电子后,所得到
的微粒如何称呼?
四 离子
失去1个电子
得到1个电子
2 8
+1
Na+
2
+17
8 7
Cl
Cl-
2 8
+17
8
2
+11
8
Na
1
↓↓
原子
失去电子
形成
得到电子
形成
阳离子
阴离子
化合物
静电作用
形成
1、离子的概念、特征
2、离子 :带电荷的原子或原子团。
阳离子:
阴离子
Na+ Mg2+ NH4+(铵根离子)
Cl- OH- SO42- (硫酸根离子)
氯化钠由________________构成.
氯离子和钠离子
结论:
2
+16
8 6
S
2
2
+12
8
Mg
1、在原子中,质子数和电子数有何关系 ?
2 8
+12
2 8
+16
8
Mg2+
S2-
2、在离子中,质子数和电子数又有何关系?
原子中,质子数=电子数
阳离子中,质子数>电子数
阴离子中,质子数<电子数
微
区别
与 粒
联 系 原 子 离 子
阳离子 阴离子
结 构
电 性
表示法
相互转
化关系
质子数=电子数
质子数>电子数
质子数<电子数
不带电
带正电
带负电
用元素符号表示
Na,S
用离子符号表示
Na+
用离子符号表示
S2-
原子
失电子
阳离子
得电子
阴离子
失电子
得电子
分子
原子
构成
再分
物质
构成
构成
元素
组成
离子
构成
得失电子
小结:构成物质的基本微粒
同类原子总称
二、相对原子质量(Ar)
相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比值。
碳 原 子质量的1/12
Ar(A)=
原子(A)的实际质量
(1)“相对原子质量”是一个比值;
(2)“相对原子质量”单位为“ 1 ”,可省略。
碳原子的相对原子质量是:12
铁原子的相对原子质量是:56
知识补充
原子种类 质子数 中子数 相对原子质量
氢 1 0 1.008
碳 6 6 12.01
氧 8 8 16.00
钠 11 12 22.99
氯 17 18 35.45
你能找出相对原子质量与质子数和中子数之间的关系吗?
相对原子质量≈质子数+中子数
相对分子质量等于构成分子的各原子的相对原子质量的总和,用Mr表示。
举例:
Mr(A2BC)=2×Ar(A)+Ar(B)+Ar(c)
分子是由原子结合而成的,我们可以用相对分子质量表示分子质量的大小。
练习:计算相对分子质量
K2CO3
C16H12N2O
Mg(NO3)2
5C6H6
kAl(SO4)2.12H20
实 验 现 象 解 释 答 案
(1)50水mL和50mL酒精混合体积小于100mL A.微粒很小 (1)( )
(2)水电解分解 B.微粒之间有间隙 (2)( )
(3)一滴水中含有1.67×1027个水的微粒 C.微粒本身发生了变化 (3)( )
(4)氧气和液氧都能支持可燃物燃烧 D.微粒能保持物质的化学性质 (4)( )
1、选择左栏的“实验现象”和右栏“解释”之间相关的项填在答案栏中。
作业举例
2、通过反应示意图解答下列问题:
(1)该反应的基本反应类型为 反应。
(2)请分析以上微观过程模拟图,你能总结出的一条结论是:
。
甲 乙 丙
分解
在化学变化中分子可以在分而原子不能再分……
构成物质的基本微粒
物质构成的奥秘
绚丽多姿的物质
一:微粒的性质
2、微粒总在不停地做无规则的运动。
3、构成物质的微粒间都有一定的间隙。
1、物质都是由极其细小的、
肉眼看不见的微粒构成的
一:微粒的性质
根据已有知识,你对构成物质的微粒有怎样的认识?可用哪些事实来说明?
微粒的性质
1、构成物质的微粒极小,肉眼是看不见的。
微粒的性质
2、构成物质的微粒,是在不停地运动的
实验探究1:探究微粒运动实验
滴入2~3滴酚酞
20mL水
滴加浓氨水
浓氨水
蒸馏水
和酚酞
1、氨水能使酚酞变红,而不是空气或水;
2、氨水中的微粒从一只烧杯跑进另一烧杯中,发生化学变化,使酚酞变红。
3、微粒总在不停地做无规则的运动。
复习拓展:
1、探究微粒运动实验中,为什么装浓氨水的烧杯中液体没有变红呢
结论:构成物质的微粒虽然都在不停地做无规则的运动;但是不同的微粒运动情况不同。
用微粒的观点解释:湿衣服为什么会晒干?
为什么湿衣服在阳光照射的地方干燥的更快呢?
微粒的运动速率与温度有关;
温度越高运动速率越快。
分子的运动性
结论:构成物质的微粒,是在不停地运动的,且温度越高微粒运动速率越大。
微粒的性质
3、构成物质的微粒之间存在一定的空隙。
实验探究2:酒精与水混合
实验操作 体积变化情况
预测结果 测量结果
1、15mL水与15mL水混合
2、15mL酒精与15mL酒精混合
3、15mL水与15mL酒精混合
想一想:实验现象说明了什么?
影响微粒间空隙大小的因素:
1、温度:温度升高微粒间的空隙变大,温度降低微粒间的空隙变小。
2、物质的存在状态:一般来说,气体物质
中微粒间的空隙较大,液体、固体微粒间的
空隙较小。
物质状态的变化微观三维模拟动画
固态
固态 液态
液态 气态
构成物质的微粒之间都有一定的空隙,不同物质微粒之间的空隙存在差异;
物质的“三态”变化实际上就是微粒之间的间隙发生改变的过程;
在气体物质中,微粒之间的距离比较大;
所以气体分子容易被压缩。
温度会影响微粒间空隙的大小。
1、以下生活、学习经验,不能说明微粒之间有空 隙的是( )
A 打气筒能将气体压缩
B 酒精和水混合,总体积变小
C 物体有热胀冷缩的现象
D 海绵能吸水
小试身手:
2、打开食醋瓶盖时,闻到了刺激气味,表明微粒在_________;食盐能溶解在水里,说明组成物质的微粒间___ _.
不停地运动
有空隙
二、构成物质的基本微粒:分子、原子、离子
一、分子
不同物质具有不同的性质(构成物质的微粒不同)
氧气、氢气、水、二氧化碳都是由分子构成的
大量分子聚集形成物质
一、分子知识
1、分子由原子构成,是构成物质的一种微粒。如常见的水、氧气、氢气、二氧化碳、酒精、氮气等
2、分子的基本性质:分子是构成物质的一种微粒,具有微粒的基本性质,分子的质量和体积都很小,分子在不停地运动,分子之间有间隙
3、分子能保持物质化学性质(构成物质的微粒保持物质的化学性质)。同种物质的分子,化学性质相同,不同种物质的分子,化学性质不同。但分子不保持物质的物理性质。
问题解决一
1、水通电后会生成什么?
2、为什么生成的氢气和氧气不再具有水的性质?
水 氢气+氧气
通电
水分子
H2O
氢分子
H2
氧分子
O2
因为它们是由不同的微粒构成的 微粒不同性质不同
你能用分子的观点解释水蒸发吗?
蒸发时,温度高,分子间空隙变大,但分子本身没有发生变化,是物理变化
水电解时,水分子发生变化了吗
问题解决二
在水电解过程中,发生变化的是什么?不变的又是什么?
物理变化与化学变化的本质区别是什么?
化学变化的实质
分子1→原子→分子2 →新物质
分子分解成原子,原子重新组合成新分子
分子是否发生变化
二、原子
变化:分子,不变:原子
二、原子
化学变化中,分子可以分成原子,而原子不能分。
原子是构成物质的又一种基本粒子,是化学变化中最小的粒子。常见的金属(铁、铜、汞等)及稀有气体(如氦、氖等)、碳(金刚石、石墨等)、硅等都是由原子直接构成。
我来总结分子原子的联系和区别。
分 子 原 子
相同点
不同点
相互关系
1、很小 、彼此有间隔 、不停地运动
2、同种分子(原子)性质相同,不同种分子(原子)性质不相同。
3、都具有种类和数量的含义。
1、在化学反应中,分子可以分解为原子,原子又可以重新组合成新物质的分子。
1、原子是化学变化中的最小微粒。
2、在化学反应中,不可再分,不能变成其它原子。
分子由原子构成的,分子可以分解为构成它的原子。
1、水由 组成,
1个水分子由 构成。
2、在电解水的实验中,水的 破裂为氢
和氧 ,可见,分子很小,但在化学反应中可以 ,而 在化学变化中不可再分,所以说 是化学变化中的最小的粒子。(提示:填“分子”或“原子”)
氢元素和氧元素
两个氢原子和一个氧原子
分子
原子
原子
再分
原子
原子
常见题型举例:
三 原子的构成
原子很小,原子还可以再分吗?
原子并不是构成物质的最小微粒
(1897年) 发现了电子
原子学说:一切物质都是由最小的不能再分的原子构成。原子是坚实的、不再分的实心球。
汤姆生
1911年著名
α粒子(正电荷)
散射实验
英国物理学家卢瑟福α粒子散射实验
大部分α粒子(正电荷)直接穿透金属箔片;少数的α粒子方向明显发生大角度改变,极少数碰到坚硬不可穿透的质点弹回来
现代原子结构
电子在核外做无规则的高速运转
原子的构成
原子核(+)
原 子
(不带电)
{
{
核外电子(-)(一个电子带一个单位负电荷)
质子(+)(一个质子带一个单位正电荷)
中子(不带电)
在原子中,核电荷数=质子数=核外电子数=原子序数
核外电子的排布
1、核外电子的分层排布
在多个电子的原子里,核外电子是分层运动的,由里向外,电子能量渐增。
2
+8
6
原子核
核内质子数
电子层
电子层上的电子个数
2、原子结构示意图
1、电子层
符号
K L M N O P Q
n
1 2 3 4 5 6 7
能量高低
离核远近
低
高
近
远
2、各电子层最多容纳的电子数
2个 8个 18个 32个 …… 2n2个
Ne
Ar
He
Li
Be
Na
Mg
Al
H
C
B
N
O
Si
P
F
Ne
Ar
2
+18
8
8
最外层电子数8个,(氦2个)达到稳定状态。不易得、失电子。
特点
合作探究1:
+2
2
稀有气体元素
的原子结构
8
2
+10
He
合作探究2:
金属
元素
的原
子结
构
2
+3
1
Li
2
+ 4
2
Be
1
2
+11
8
Na
2
2
+12
8
Mg
Al
2
+13
8
3
最外层电子数一般少于4个,在化学变化容易失去电子。
特点:
合作探究3:
非金属元素的原子结构
1
+1
H
4
2
+6
C
3
2
+5
B
2
+7
5
N
+8
2
6
O
2
+14
8
4
Si
P
2
+15
8
5
7
2
+9
F
最外层电子数一般大于4个,在化学变化容易得到电子。
特点:
元素的分类、最外层电子数与元素化学性质有什么样的关系呢?
元素的分类 最外层电子数 元素化学性质
金属元素
非金属元素
稀有气体元素
小于4
一般大于4
等于8(氦等于2)
易失去电子,不稳定
易得到电子,不稳定
不易得失电子,稳定
原子最外层电子数决定着元素的化学性质。
稳定结构
最外层电子数为8
只有一层为2
1.当原子得失电子后,
还显电中性吗?
2.原子得失电子后,所得到
的微粒如何称呼?
四 离子
失去1个电子
得到1个电子
2 8
+1
Na+
2
+17
8 7
Cl
Cl-
2 8
+17
8
2
+11
8
Na
1
↓↓
原子
失去电子
形成
得到电子
形成
阳离子
阴离子
化合物
静电作用
形成
1、离子的概念、特征
2、离子 :带电荷的原子或原子团。
阳离子:
阴离子
Na+ Mg2+ NH4+(铵根离子)
Cl- OH- SO42- (硫酸根离子)
氯化钠由________________构成.
氯离子和钠离子
结论:
2
+16
8 6
S
2
2
+12
8
Mg
1、在原子中,质子数和电子数有何关系 ?
2 8
+12
2 8
+16
8
Mg2+
S2-
2、在离子中,质子数和电子数又有何关系?
原子中,质子数=电子数
阳离子中,质子数>电子数
阴离子中,质子数<电子数
微
区别
与 粒
联 系 原 子 离 子
阳离子 阴离子
结 构
电 性
表示法
相互转
化关系
质子数=电子数
质子数>电子数
质子数<电子数
不带电
带正电
带负电
用元素符号表示
Na,S
用离子符号表示
Na+
用离子符号表示
S2-
原子
失电子
阳离子
得电子
阴离子
失电子
得电子
分子
原子
构成
再分
物质
构成
构成
元素
组成
离子
构成
得失电子
小结:构成物质的基本微粒
同类原子总称
二、相对原子质量(Ar)
相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比值。
碳 原 子质量的1/12
Ar(A)=
原子(A)的实际质量
(1)“相对原子质量”是一个比值;
(2)“相对原子质量”单位为“ 1 ”,可省略。
碳原子的相对原子质量是:12
铁原子的相对原子质量是:56
知识补充
原子种类 质子数 中子数 相对原子质量
氢 1 0 1.008
碳 6 6 12.01
氧 8 8 16.00
钠 11 12 22.99
氯 17 18 35.45
你能找出相对原子质量与质子数和中子数之间的关系吗?
相对原子质量≈质子数+中子数
相对分子质量等于构成分子的各原子的相对原子质量的总和,用Mr表示。
举例:
Mr(A2BC)=2×Ar(A)+Ar(B)+Ar(c)
分子是由原子结合而成的,我们可以用相对分子质量表示分子质量的大小。
练习:计算相对分子质量
K2CO3
C16H12N2O
Mg(NO3)2
5C6H6
kAl(SO4)2.12H20
实 验 现 象 解 释 答 案
(1)50水mL和50mL酒精混合体积小于100mL A.微粒很小 (1)( )
(2)水电解分解 B.微粒之间有间隙 (2)( )
(3)一滴水中含有1.67×1027个水的微粒 C.微粒本身发生了变化 (3)( )
(4)氧气和液氧都能支持可燃物燃烧 D.微粒能保持物质的化学性质 (4)( )
1、选择左栏的“实验现象”和右栏“解释”之间相关的项填在答案栏中。
作业举例
2、通过反应示意图解答下列问题:
(1)该反应的基本反应类型为 反应。
(2)请分析以上微观过程模拟图,你能总结出的一条结论是:
。
甲 乙 丙
分解
在化学变化中分子可以在分而原子不能再分……
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
