第12章《盐》基础训练2022-2023学年九年级化学京改版(2013)下册(有答案)
文档属性
| 名称 | 第12章《盐》基础训练2022-2023学年九年级化学京改版(2013)下册(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 80.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-15 15:27:10 | ||
图片预览


文档简介
第12章《盐》基础训练
一、单选题
1.日前,国家食品监督部门检出一种由“返青棕叶”包装的粽子。这种“返青棕叶”多以硫酸铜为添加物,含砷、铅、汞等重金属元素,长期食用有害健康。硫酸铜是一种( )
A.有机物 B.酸
C.碱 D.盐
2.下列物质的性质与用途,不相匹配的是( )
A.氧气可以支持燃烧 工业上可用作燃料
B.氮气的化学性质定稳 工业上可用作焊接保护气
C.白醋含有醋酸,显酸性 家庭中可用作除水垢
D.硫酸钡既不溶于水,也不与酸反应 医疗上可用于“钡餐”造影
3.小美发现荔枝园旁边的水稻叶子发黄,并倒下了一片,你认为应该向稻田施用的复合肥是( )
A.CO(NH2)2 B.KCl C.Ca3(PO4)2 D.KNO3
4.下列做法中一定发生化学变化的是( )
A.用石油分馏制得汽油、柴油等 B.用柠檬酸和小苏打、白糖配置汽水
C.用钢丝球擦除灶具上的污渍 D.用汽油清洗衣服上的油污
5.下列实验现象的描述中正确的是
A.红磷燃烧,产生大量白烟,生成五氧化二磷
B.将铁丝伸入盛有氧气的集气瓶中,铁丝剧烈燃烧,火星四射,生成黑色固体
C.将氢氧化钠溶液滴加入硫酸铜溶液中,生成白色沉淀
D.碳酸钠固体和稀盐酸反应,生成能使澄清石灰水变浑浊的气体
6.下列各组溶液混合后能发生反应且无明显现象的一组是
A.NaNO3、NaCl、AgNO3 B.CuSO4、H2SO4、BaCl2
C.HCl、Na2SO4、NaOH D.HCl、NaHCO3、NaNO3
7.除去下列物质中的杂质,选用试剂和方法均正确的是
选项 物质 杂质(少量) 试剂和方法
A 氯化钾 氯酸钾 加入少量二氧化锰粉末,加热
B 稀硫酸 稀盐酸 加入适量的氯化钡溶液,过滤
C 氯化钙溶液 氢氧化钙 加入稍微过量的稀盐酸,加热
D 硝酸钾溶液 硫酸钾 加入过量的硝酸钡溶液,过滤
A.A B.B C.C D.D
8.西汉时期,人们就会用石灰水或草木灰水(主要成分是K2CO2)等碱性溶液为丝麻脱胶来造纸。下列物质属于碱的是
A.生石灰 B.水 C.熟石灰 D.草木灰
9.“河长制”有利于加强水资源保护,防治水体污染。研学小组对两个工厂排污口排放的污水进行检测,发现共含HNO3、K2SO4、MgCl2和NaOH四种物质,其中每个排污口排放两种不同物质。下列关于污水成分的分析合理的是( )
A.HNO3 和K2SO4一定来自同一排污口 B.HNO3 和MgCl2一定来自同 排污口
C.HNO3和NaOH一定来自同一排污口 D.将两处污水混合后,溶液一定呈中性
10.利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如下:(反应条件已略去)
已知:
下列说法正确的是
A.步骤II中分离操作必须用到的玻璃仪器是烧杯和漏斗
B.溶液A中溶质是H2SO4、CuSO4
C.上述流程中物质B是锌,物质D是盐酸
D.A~E中都含有铜、锌两种元素的物质有A和C
二、简答题
11.为了提高农作物的产量,需要庄稼施肥.以玉米为例,每公顷需施用约1吨尿素,其中只有约20%被玉米吸收,其余会随水流入江中.请回答:
(1)说说你对此现象的看法_____;
(2)对此情况你的建议是_____.
12.给盐酸、氯化锌、硫酸钠、碳酸钠、氢氧化钡这五种物质分类,将其化学式填入空格中。
酸____________,碱____________,盐____________,这五种物质的溶液两两混合相互能发生的复分解反应共有____________个,写出有关反应的化学方程式:____________。
三、推断题
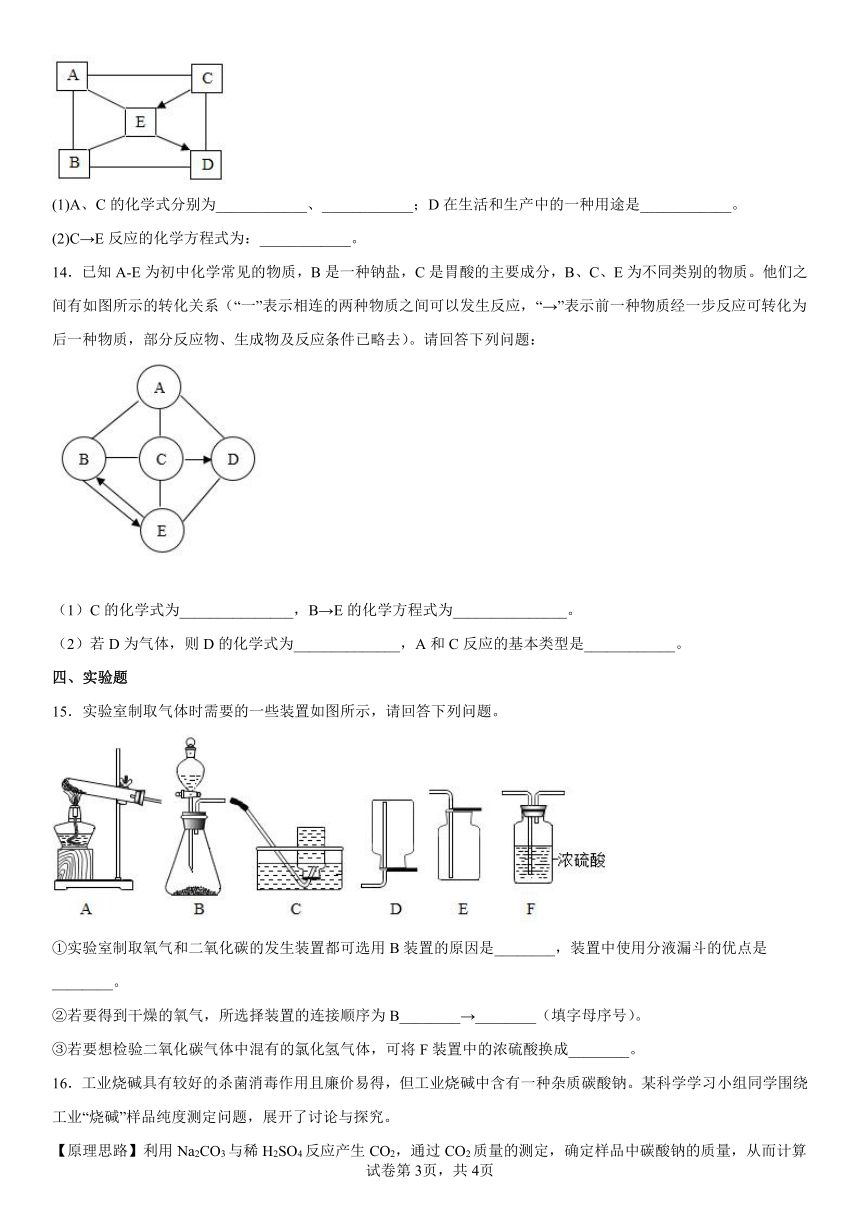
13.A~E是初中常见的物质:盐酸、氢氧化钠、氢氧化钙、碳酸钠、二氧化碳中的某一种。A可用于金属表面除锈,B可用来改良酸性土壤。它们相互间发生反应或转化的关系如图所示(“—”表面两种物质间能发生反应,“→”表示两种物质间的转化关系)。
(1)A、C的化学式分别为____________、____________;D在生活和生产中的一种用途是____________。
(2)C→E反应的化学方程式为:____________。
14.已知A-E为初中化学常见的物质,B是一种钠盐,C是胃酸的主要成分,B、C、E为不同类别的物质。他们之间有如图所示的转化关系(“一”表示相连的两种物质之间可以发生反应,“→”表示前一种物质经一步反应可转化为后一种物质,部分反应物、生成物及反应条件已略去)。请回答下列问题:
(1)C的化学式为_______________,B→E的化学方程式为_______________。
(2)若D为气体,则D的化学式为______________,A和C反应的基本类型是____________。
四、实验题
15.实验室制取气体时需要的一些装置如图所示,请回答下列问题。
①实验室制取氧气和二氧化碳的发生装置都可选用B装置的原因是________,装置中使用分液漏斗的优点是________。
②若要得到干燥的氧气,所选择装置的连接顺序为B________→________(填字母序号)。
③若要想检验二氧化碳气体中混有的氯化氢气体,可将F装置中的浓硫酸换成________。
16.工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中含有一种杂质碳酸钠。某科学学习小组同学围绕工业“烧碱”样品纯度测定问题,展开了讨论与探究。
【原理思路】利用Na2CO3与稀H2SO4反应产生CO2,通过CO2质量的测定,确定样品中碳酸钠的质量,从而计算工业“烧碱”样品纯度。
【实验方案】根据以上思路,小科设计的方案是:利用如图甲的装置(固定装置省略),通过测定反应前后整套装置和药品的总质量的减少量确定CO2质量。
(1)小科按该方案进行测定,加入足量稀硫酸充分反应后,发现最终测得碳酸钠的质量明显偏低。你认为导致测得的“碳酸钠”的质量明显偏低的原因是______;
【方案改进】为减少误差,小组同学经讨论,对小科方案进行改进,设计了如图乙的实验方案(固定装置省略)。通过测定反应前后D质量的变化。
(2)图乙B装置中样品在与足量稀硫酸反应前和停止反应后,都要鼓入足量的空气,在反应前通空气时,a、b、c三个弹簧夹的控制方法是______。
(3)若撤去图乙中的A和E装置,则测得工业“烧碱”的纯度将______(选填“偏高”“偏低”或“无影响”)。
(4)按改进后的图乙实验方案进行实验,发现测得的工业“烧碱”的纯度明显偏高,从实验操作上分析产生上述结果的原因是______(写出一种即可)。
五、计算题
17.为测定某CuSO4溶液的溶质质量分数,化学小组的同学取CuSO4溶液100 g,向其中滴加一定浓度的NaOH溶液,至不再产生沉淀为止,共用去NaOH溶液80 g,过滤,得到滤液175.1 g。请计算:
(1)该反应生成沉淀________g;
(2)该CuSO4溶液中溶质的质量分数为___________。
18.实验室有化学实验考试后留下混有少量食盐的小苏打( NaHCO3)样品。现称取样品10克,加入某溶质质量分数的稀盐酸90克,至充分反应不再有气泡产生为止,称得剩余溶液质量为96.04克。求:
(1)生成气体的质量;
(2)样品中 NaHCO3的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.D
4.B
5.D
6.C
7.C
8.C
9.B
10.D
11. 化肥的过量使用会造成水污染 应合理使用化肥,最好与农家肥混合使用
12. HCl Ba(OH)2 ZnCl2、Na2SO4、Na2CO3 6 2HCl+Na2CO3=CO2↑+H2O+2NaCl Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
13.(1) HCl NaOH 灭火
(2)2NaOH+CO2=Na2CO3+H2O
14. HCl CO2 复分解反应
15. 反应物都是固体和液体,反应条件是在常温下反应 可以控制液体滴加的速度从而控制反应的速率(答案合理即可) F E AgNO3溶液
16.(1)反应生成的二氧化碳部分留在装置中
(2)打开ab,关闭c
(3)偏低
(4)反应后没有鼓入足量的空气
17.(1)4.9
(2)设100 g CuSO4溶液中所含CuSO4的质量为x。
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
160 98
x 4.9 g
= x=8 g
CuSO4溶液中溶质的质量分数为×100%=8%
答:该CuSO4溶液中溶质的质量分数为8%。
18.3.96g;75.6%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.日前,国家食品监督部门检出一种由“返青棕叶”包装的粽子。这种“返青棕叶”多以硫酸铜为添加物,含砷、铅、汞等重金属元素,长期食用有害健康。硫酸铜是一种( )
A.有机物 B.酸
C.碱 D.盐
2.下列物质的性质与用途,不相匹配的是( )
A.氧气可以支持燃烧 工业上可用作燃料
B.氮气的化学性质定稳 工业上可用作焊接保护气
C.白醋含有醋酸,显酸性 家庭中可用作除水垢
D.硫酸钡既不溶于水,也不与酸反应 医疗上可用于“钡餐”造影
3.小美发现荔枝园旁边的水稻叶子发黄,并倒下了一片,你认为应该向稻田施用的复合肥是( )
A.CO(NH2)2 B.KCl C.Ca3(PO4)2 D.KNO3
4.下列做法中一定发生化学变化的是( )
A.用石油分馏制得汽油、柴油等 B.用柠檬酸和小苏打、白糖配置汽水
C.用钢丝球擦除灶具上的污渍 D.用汽油清洗衣服上的油污
5.下列实验现象的描述中正确的是
A.红磷燃烧,产生大量白烟,生成五氧化二磷
B.将铁丝伸入盛有氧气的集气瓶中,铁丝剧烈燃烧,火星四射,生成黑色固体
C.将氢氧化钠溶液滴加入硫酸铜溶液中,生成白色沉淀
D.碳酸钠固体和稀盐酸反应,生成能使澄清石灰水变浑浊的气体
6.下列各组溶液混合后能发生反应且无明显现象的一组是
A.NaNO3、NaCl、AgNO3 B.CuSO4、H2SO4、BaCl2
C.HCl、Na2SO4、NaOH D.HCl、NaHCO3、NaNO3
7.除去下列物质中的杂质,选用试剂和方法均正确的是
选项 物质 杂质(少量) 试剂和方法
A 氯化钾 氯酸钾 加入少量二氧化锰粉末,加热
B 稀硫酸 稀盐酸 加入适量的氯化钡溶液,过滤
C 氯化钙溶液 氢氧化钙 加入稍微过量的稀盐酸,加热
D 硝酸钾溶液 硫酸钾 加入过量的硝酸钡溶液,过滤
A.A B.B C.C D.D
8.西汉时期,人们就会用石灰水或草木灰水(主要成分是K2CO2)等碱性溶液为丝麻脱胶来造纸。下列物质属于碱的是
A.生石灰 B.水 C.熟石灰 D.草木灰
9.“河长制”有利于加强水资源保护,防治水体污染。研学小组对两个工厂排污口排放的污水进行检测,发现共含HNO3、K2SO4、MgCl2和NaOH四种物质,其中每个排污口排放两种不同物质。下列关于污水成分的分析合理的是( )
A.HNO3 和K2SO4一定来自同一排污口 B.HNO3 和MgCl2一定来自同 排污口
C.HNO3和NaOH一定来自同一排污口 D.将两处污水混合后,溶液一定呈中性
10.利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如下:(反应条件已略去)
已知:
下列说法正确的是
A.步骤II中分离操作必须用到的玻璃仪器是烧杯和漏斗
B.溶液A中溶质是H2SO4、CuSO4
C.上述流程中物质B是锌,物质D是盐酸
D.A~E中都含有铜、锌两种元素的物质有A和C
二、简答题
11.为了提高农作物的产量,需要庄稼施肥.以玉米为例,每公顷需施用约1吨尿素,其中只有约20%被玉米吸收,其余会随水流入江中.请回答:
(1)说说你对此现象的看法_____;
(2)对此情况你的建议是_____.
12.给盐酸、氯化锌、硫酸钠、碳酸钠、氢氧化钡这五种物质分类,将其化学式填入空格中。
酸____________,碱____________,盐____________,这五种物质的溶液两两混合相互能发生的复分解反应共有____________个,写出有关反应的化学方程式:____________。
三、推断题
13.A~E是初中常见的物质:盐酸、氢氧化钠、氢氧化钙、碳酸钠、二氧化碳中的某一种。A可用于金属表面除锈,B可用来改良酸性土壤。它们相互间发生反应或转化的关系如图所示(“—”表面两种物质间能发生反应,“→”表示两种物质间的转化关系)。
(1)A、C的化学式分别为____________、____________;D在生活和生产中的一种用途是____________。
(2)C→E反应的化学方程式为:____________。
14.已知A-E为初中化学常见的物质,B是一种钠盐,C是胃酸的主要成分,B、C、E为不同类别的物质。他们之间有如图所示的转化关系(“一”表示相连的两种物质之间可以发生反应,“→”表示前一种物质经一步反应可转化为后一种物质,部分反应物、生成物及反应条件已略去)。请回答下列问题:
(1)C的化学式为_______________,B→E的化学方程式为_______________。
(2)若D为气体,则D的化学式为______________,A和C反应的基本类型是____________。
四、实验题
15.实验室制取气体时需要的一些装置如图所示,请回答下列问题。
①实验室制取氧气和二氧化碳的发生装置都可选用B装置的原因是________,装置中使用分液漏斗的优点是________。
②若要得到干燥的氧气,所选择装置的连接顺序为B________→________(填字母序号)。
③若要想检验二氧化碳气体中混有的氯化氢气体,可将F装置中的浓硫酸换成________。
16.工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中含有一种杂质碳酸钠。某科学学习小组同学围绕工业“烧碱”样品纯度测定问题,展开了讨论与探究。
【原理思路】利用Na2CO3与稀H2SO4反应产生CO2,通过CO2质量的测定,确定样品中碳酸钠的质量,从而计算工业“烧碱”样品纯度。
【实验方案】根据以上思路,小科设计的方案是:利用如图甲的装置(固定装置省略),通过测定反应前后整套装置和药品的总质量的减少量确定CO2质量。
(1)小科按该方案进行测定,加入足量稀硫酸充分反应后,发现最终测得碳酸钠的质量明显偏低。你认为导致测得的“碳酸钠”的质量明显偏低的原因是______;
【方案改进】为减少误差,小组同学经讨论,对小科方案进行改进,设计了如图乙的实验方案(固定装置省略)。通过测定反应前后D质量的变化。
(2)图乙B装置中样品在与足量稀硫酸反应前和停止反应后,都要鼓入足量的空气,在反应前通空气时,a、b、c三个弹簧夹的控制方法是______。
(3)若撤去图乙中的A和E装置,则测得工业“烧碱”的纯度将______(选填“偏高”“偏低”或“无影响”)。
(4)按改进后的图乙实验方案进行实验,发现测得的工业“烧碱”的纯度明显偏高,从实验操作上分析产生上述结果的原因是______(写出一种即可)。
五、计算题
17.为测定某CuSO4溶液的溶质质量分数,化学小组的同学取CuSO4溶液100 g,向其中滴加一定浓度的NaOH溶液,至不再产生沉淀为止,共用去NaOH溶液80 g,过滤,得到滤液175.1 g。请计算:
(1)该反应生成沉淀________g;
(2)该CuSO4溶液中溶质的质量分数为___________。
18.实验室有化学实验考试后留下混有少量食盐的小苏打( NaHCO3)样品。现称取样品10克,加入某溶质质量分数的稀盐酸90克,至充分反应不再有气泡产生为止,称得剩余溶液质量为96.04克。求:
(1)生成气体的质量;
(2)样品中 NaHCO3的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.D
4.B
5.D
6.C
7.C
8.C
9.B
10.D
11. 化肥的过量使用会造成水污染 应合理使用化肥,最好与农家肥混合使用
12. HCl Ba(OH)2 ZnCl2、Na2SO4、Na2CO3 6 2HCl+Na2CO3=CO2↑+H2O+2NaCl Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
13.(1) HCl NaOH 灭火
(2)2NaOH+CO2=Na2CO3+H2O
14. HCl CO2 复分解反应
15. 反应物都是固体和液体,反应条件是在常温下反应 可以控制液体滴加的速度从而控制反应的速率(答案合理即可) F E AgNO3溶液
16.(1)反应生成的二氧化碳部分留在装置中
(2)打开ab,关闭c
(3)偏低
(4)反应后没有鼓入足量的空气
17.(1)4.9
(2)设100 g CuSO4溶液中所含CuSO4的质量为x。
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
160 98
x 4.9 g
= x=8 g
CuSO4溶液中溶质的质量分数为×100%=8%
答:该CuSO4溶液中溶质的质量分数为8%。
18.3.96g;75.6%。
答案第1页,共2页
答案第1页,共2页
